高考理综教学测试化学卷
理科综合试卷
相对原子质量(原子量):C—12;H—1;O—16;S—32;Al—27;Ba—137;
6.科学家在研究探索中不断发现新的物质,据报道,1996年科学家在宇宙中发现了H3分子,那么H3和H2属于
A.同位素 B.同分异构体 C.同系物 D.同素异形体
7.用NA代表阿伏加德罗常数,下列说法中正确的是
A.12g金刚石中含有C—C键个数为1.0NA
B.标况下,11.2L庚烷所含的分子数目为0.5 NA
C.用惰性电极电解CuSO4溶液时,当电路中通过1mol eˉ时,溶液中产生的H+数目为NA
D.0.1molFe(OH)3胶体所含胶体微粒数为0.1NA
8.下列离子方程式中书写正确的是
A.碳酸氢钙溶液中加入了少量氢氧化钠溶液 HCO3ˉ+OHˉ= CO32ˉ+H2O
B.氯化铁溶液中通入硫化氢气体 2 Fe3+ + H2S = 2 Fe2+ + S↓+ 2 H+
C.氯化铝溶液中加入过量氨水 Al3+ + 4 NH3·H2O = AlO2ˉ+ 4 NH4+ + 2 H2O
D.碘化亚铁溶液中通入少量氯气 2 Fe2+ + Cl2 = 2 Fe3+ + 2 Clˉ
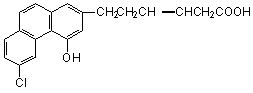 9.某有机物的结构简式可用下图表示,关于该物质的下列说法中错误的是
9.某有机物的结构简式可用下图表示,关于该物质的下列说法中错误的是
A.该物质具有酸性
B.该物质中含有多个苯环
C. 该物质相对分子质量很大,属于高分子化合物
D.该物质可以发生加成反应
10.下列实验方案合理的是
A.用氢氧化钠溶液除去乙酸乙酯中混有的乙酸等杂质
B.制备FeCl3溶液时,先将固体溶于较浓盐酸,再加水稀释
C.用加入浓溴水的方法分离苯和苯酚的混合物
D.用润湿的pH试纸测量某酸溶液的pH
11.以下因果关系中不成立的是
A.苯酚具有弱酸性,其原因是羟基对苯环的影响
B.蛋白质溶液可发生丁达尔效应,其原因是分散质微粒直径在10-9m~10-7m之间
C.冰的密度小于液态水、水的沸点高于硫化氢等性质,其原因是与氢键的存在有关
D.配制一定物质的量浓度的溶液时,要洗涤烧杯,其原因是防止溶质流失
12.某氢氧燃料电池所消耗的原料为H2和O2,电极为多孔镍,电解质溶液为30%的KOH溶液,下列有关说法中正确的是
A.正极反应为 4 OHˉ- 4eˉ= 2 H2O + O2
B.负极反应为 2 H2 + 4 OHˉ-4 eˉ= 4 H2O
C.工作时,正极区pH下降
D.工作时,溶液中阴离子移向正极
13.下列说法中正确的是
A.常温下醋酸分子不可能存在于pH > 7的溶液中
B.常温下等物质的量浓度的醋酸钠、碳酸钠、碳酸氢钠溶液pH依次增大
C.0.2 mol •Lˉ1的醋酸钠溶液中各离子浓度大小可能的关系是:
c(Na+) > c(CH3COOˉ)> c( OHˉ)> c( H+)
D.c( H+)=1×10ˉ13 mol•Lˉ1的溶液中,一定能大量存在Al3+、Clˉ、NH4+、NO3ˉ
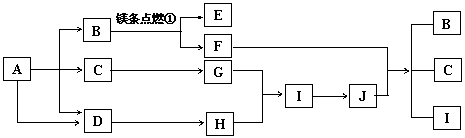
26.(12分)下列图中A—J分别代表相关反应中的一种物质,已知A是常用作肥料的无机盐,A分解得到相等物质的量的B、C、D,已知F是一种单质,图中有一些生成物未写出。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
请填写以下空白:
(1)A的化学式___▲___,D的电子式__▲__ ,B物质的晶体类型为__▲ 。
(2)写出反应②的化学方程式:_______▲_____;
(3)写出反应④的化学方程式,并标出电子的转移方向和数目:____▲______。
27(16分)某研究性学习小组的同学为在实验室再现二氧化硫催化氧化的过程,并制取少量三氧化硫晶体,设计了如图所示的装置。
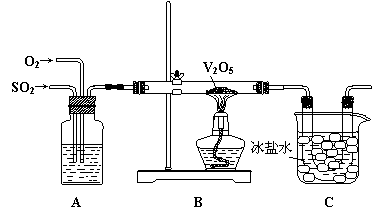 |
已知: ①三氧化硫遇水生成硫酸并放出大量热,容易形成酸雾。
②V2O5在450℃左右,活性最好,温度过高或过低都会使催化剂活性下降。
试回答:
(1)已知3.2g二氧化硫被氧气完全氧化成气态三氧化硫时,可以放出4.915kJ热量。反应的热化学方程式为 ▲ ;
(2)A装置可用来观察二氧化硫和氧气的进气量。实验时使A中氧气导管冒出的气泡与二氧化硫导管冒出的气泡速率相近,其目的是 ▲ ;A中的药品是 ▲ ;
(3)检查完装置的气密性且加入药品后,开始进行实验。此时首先应该进行的操作是
▲ ;
(4)在实验过程中不能持续加热的理由是 ▲ ;
(5)C装置用来收集三氧化硫,其中冰盐水的作用是 ▲ ;
(6)为了减轻实验对环境的污染,请你设计尾气处理装置,用简要文字回答: ▲ 。
![]() 28.(17分)已知如下信息:
28.(17分)已知如下信息:
① RNH2+R∕CH2Cl RNHCH2R∕+HCl (R和R∕代表烃基)
![]()
② 苯的同系物能被高锰酸钾氧化,如:
![]()
![]() ③
③
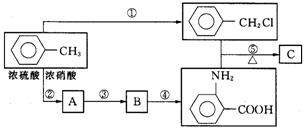
化合物C是制取消炎灵(盐酸祛炎痛)的中间产物,其合成路线为:
请回答下列问题:
(1)写出反应④的主要产物中含有的官能团的结构简式(除苯环外)____▲____;
(2)写出B、C物质的结构简式是_____▲_____, ▲ ;
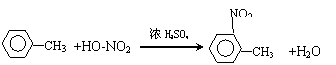
(3)写出反应①②的化学方程式 ①______▲____,②___▲____;
(4)反应①-⑤中,属于取代反应的有(填反应序号)______▲____;
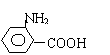 (5)写出符合下列要求的
的含有苯环的同分异构体
(5)写出符合下列要求的
的含有苯环的同分异构体
①含硝基的(任选一种) ▲ ;②属于酯类(任选一种) ▲ 。
29.(15分)(1)在100 mL浓度为1mol•Lˉ1的明矾[KAl(SO4)2•12H2O]溶液中,加入
▲ mL 1mol•Lˉ1的氢氧化钡溶液,能使产生的沉淀中Al(OH)3质量最多。当加入过量的1mol•Lˉ1的氢氧化钡溶液后,产生的沉淀的质量是 ▲ g。(6分)
(2)在2L恒容的密闭容器中,加入1molN2和3molH2,在一定温度和催化剂条件下使其反应,当反应到8min时达到平衡,此时NH3的浓度c (NH3) = a mol•Lˉ1;分离出NH3,剩余气体回收于原容器,再向该容器通入1molN2和3molH2,平衡时N2的转化率比第一次增大5%,c (NH3) = b mol•Lˉ1。
①下列属于工业上增加氮气转化率的措施是 ▲ ;
A、提高反应温度至500℃ B、使用催化剂
C、增大压强至20-50MPa D、充入过量的氮气
②第一次达到平衡时c(N2)=c(NH3),则a= ▲ ;第二次达到平衡时b= ▲ ;
二模化学试题参考答案及评分建议
选择题:6D 7C 8B 9C 10B 11A 12B 13C
 |
26:(共12分)
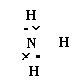
![]() (1)NH4HCO3 NH3的电子式
分子晶体
(1)NH4HCO3 NH3的电子式
分子晶体
(2)4NH3+5O2 4NO+6H2O 以上每空2分
![]() (3)C+4HNO3
(3)C+4HNO3![]() CO2↑+NO2↑+2H2O 方向1分、电子数目1分、方程式2分
CO2↑+NO2↑+2H2O 方向1分、电子数目1分、方程式2分
![]() 27:(共16分)
27:(共16分)
(1)2SO2(g)+O2(g) 2SO3(g) △H=-196.6kJ/mol (3分)
(2)使用过量氧气以提高二氧化硫的转化率 浓硫酸
(3)加热
(4)反应为放热反应温度过高催化剂活性下降
(5)降温冷却三氧化硫使之成为晶体 (以上每空2分)
(6)通入盛有氢氧化钠溶液的烧杯中(其它答案合理可给分)(3分)
28、(17分,除第4小题为3分外,其余每空2分,28题共17分。又注:第4小题答对1个给1分答错1个扣1分直至0分为止。)
(1) —NH2;—COOH;
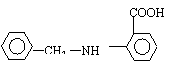

(2)
![]()
(3)

 (4)①②⑤
(4)①②⑤
(5) ① ②
29、(共15分,每空3分)(1)150ml;46.6g;(2)①C;② a=1/3 mol/L b=7/12 mol/L