高考化学规范训练三
第Ⅰ卷(选择题 共64分)
一、单项选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
⒈下列说法正确的是( )
A.增大压强,活化分子百分数增加,化学反应速率一定增大
B.升高温度,活化分子百分数增加,化学反应速率一定增大
C.活化分子间所发生的碰撞为有效碰撞
D.加入反应物,使活化分子百分数增加,化学反应速率增大
 2.下列化学用语表达正确的是
2.下列化学用语表达正确的是
A.S2—的结构示意图: B.乙炔的结构简式CHCH
![]()
![]() C.NaCl的电子式:
D.硝基苯的结构简式:
C.NaCl的电子式:
D.硝基苯的结构简式:
3.下列有关说法正确的是
A.CaCl2、聚苯乙烯、HD均为化合物
B.CH2O2、C3H6O2、C4H8O2互为同系物
C.明矾、冰醋酸、硫酸钡均为电解质
D.SiO2、NaCl、S8、Cu均能表示物质分子组成
4.根据所学知识,下列有关胶体的说法中正确的是
A.将饱和的FeCl3溶液加热至沸,制得Fe(OH)3胶体
B.将磁性物质制成胶体离子作为药物的载体,可在磁场作用下送到病灶
C.化工生产上可利用丁达尔效应将油漆粒子均匀地沉积在镀件上
D.将蔗糖溶于溶解在酒精中,则可形成胶体
5.通过复习总结,你认为下列对化学知识概括合理的是
A.氧化物不可能是还原产物,只可能是氧化产物
B.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
C.原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键
D.原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低
6.下列各组离子,在指定的环境中一定能大量共存的是
A.在c(H+)/c(OH-)=1×1012的溶液中:I-、Cl-、HCO3—、Na+
B.在能使pH试纸变红色的溶液中:Na+、S2—、NO3—、CO32—
C.在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42—、Cl—、
D.由水电离出的c(H+)=1×10-12mol·L-1的溶液中:K+、Cl-、NO3—、N
7.NA代表阿伏加德罗常数的值,下列说法正确的是
A.4 g重水(D2O)中所含质子数为0.2NA
B.在通常状况下,22.4 LH2和4 gHe均含有NA个分子
C.8.0 g Cu2S和CuO的混合物中约含有铜原子数为0.1NA
D.常温常压下,0.1mol铁与0.1molCl2充分反应,转移的电子数约为0.3NA
8.下列事实,不能用勒夏特列原理解释的是
A.溴水中有平衡:Br2+H2O![]() HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
B.对2HI(g)![]() H2(g)+I2(g),平衡体系增大压强可使颜色变深
H2(g)+I2(g),平衡体系增大压强可使颜色变深
C.反应CO+NO2![]() CO2+NO;△H<0。升高温度可使平衡向逆反应方向移动
CO2+NO;△H<0。升高温度可使平衡向逆反应方向移动
D.合成NH3反应,为提高NH3的产率,理论上应采取相对较低温度的措施
二、不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
9.A、B、C均为短周期元素,A、B同周期,A、C的最低价阴离子分别为A2-、C-,
B2+与C-具有相同的电子层结构。下列叙述中正确的是
A.它们的原子序数A>B>C B.它们的离子半径A2->C->B2+
C.它们的原子半径C>B>A D.它们的最外层电子数B>A>C
10.t℃时,将100 g某物质A的溶液蒸发掉10 g水,恢复至t℃,析出2.5 g晶体;再蒸发掉10 g水,恢复至t℃,析出7.5 g晶体。下列说法中正确的是
A.t℃时原溶液是饱和溶液
B.若A是CuSO4,则7.5 g晶体中含水2.7 g
C.t℃时A的溶解度为75 g
D.原溶液中A的质量分数为40%
11.a mol FeS与b mol FeO投入到V L、c mol•L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液的成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
A.(a+b)×63g B.(a+b)×189g C.(a+b)mol
D.(cV-![]() )mol
)mol
12.下列离子反应方程式不正确的是
A.KHCO3的水解:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B.NaHSO4溶液与Ba(OH)2溶液混合呈中性:
2HSO4—+Ba2++2OH—=BaSO4↓+SO42—+2H2O
C.将少量铁粉加入到过量的稀硝酸中:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
D.碳酸氢钙溶液中加入足量石灰水:Ca2++HCO3—+OH-= CaCO3↓+H2O
13.对于平衡体系mA(g)+nB(g)![]() pC(g)+qD(g);△H<0。下列结论中正确的是
pC(g)+qD(g);△H<0。下列结论中正确的是
A.若平衡时A、B的转化率之比为m∶n,说明反应开始时,A、B的物质的量相等
B.若温度不变,将容器的体积增大1倍,此时A的浓度变为原来的0.48倍,则m+n>p+q
C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入b mol B,达到新平衡时,气体的总物质的量等于(a+b)
D.若升高温度时,平衡混合气体的平均相对分子质量增大,则m+n>p+q
14.T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是
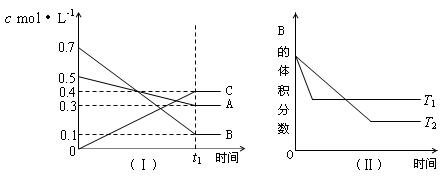
A.在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动
B.(t1+10)min时,保持容器体积不变,通入稀有气体,平衡向逆反应方向移动
C.T℃时,在相同容器中,若由0.3mol·L—1 A、0.1 mol·L—1 B和0.4 mol·L—1 C反应,达到平衡后,C的浓度仍为0.4 mol·L—1
D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
15.一定温度下,将2mol A、2mol B、2mol C的气体混合物充入一体积不变的密闭容器中,充分反应后恢复到起始温度,测得容器内的压强比起始时增大了20%,则容器中可能发生的反应是
A.2A+B![]() 2C B.A+B
2C B.A+B![]() 2C
2C
C.2A+B![]() C D.A+B
C D.A+B![]() 3C
3C
16。某温度时,把1molN2O4气体通入体积为10L的真空密闭容器中,立即出现棕色,反应进行4s时NO2的浓度为0.04mol/L,再经过一定时间后,反应到达平衡,这时容器内压强为开始时的1.8倍。则下列说法正确的是
A 前4s中以N2O4的浓度变化表示的平均反应速度为0.01mol/L·s
B 在4s时容器内的压强为开始时的1.2倍
C 在平衡时容器内含N2O40.4mol
D 在平衡时容器内含NO21.6mol
第Ⅱ卷(非选择题 共86分)
三、(本题包括2小题,共17分)
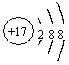
17.(6分)⑴可以验证镁、铝的金属性强弱的实验是 。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
⑵现有MgCl2溶液、AlCl3溶液、NaOH溶液、氨水、盐酸等几种物质,试设计实验方案证明镁、铝的金属性强弱。
18.(11分)在常温下,取两片质量相等、外形和组成相同表面经过砂纸打磨(完全去掉了氧化物)的铝片,分别加入到盛有体积相同、![]() 相同的稀硫酸和稀盐酸溶液的两支试管(相同体积)中,发现铝片在稀盐酸中产生氢气的速率比在稀硫酸中快。
相同的稀硫酸和稀盐酸溶液的两支试管(相同体积)中,发现铝片在稀盐酸中产生氢气的速率比在稀硫酸中快。
(1)写出以上反应的离子方程式
(2)你认为出现以上现象的可能原因是:
假设①
假设②
(3)请设计实验对以上的假设进行验证:
①
②
(4)如果上述假设都成立,要使以上稀硫酸与铝反应产生的氢气速率加快,可以采取的措施有:(至少填四种)
四、(本题包括2小题,共20分)
19.(10分)某种晶体的晶胞为立方体,结构如右图所示:
通过观察和计算,回答下列有关问题:
⑴晶体中每个Mg2+周围与它最邻近的Mg2+围成的空 间构型是 ,每个F—周围与它最邻近的K+有 个。
⑵若将该晶体重新切割晶胞,使Mg2+置于晶胞的体心,K+置于晶胞的顶点,F—应占据立方体的 位置。
⑶设该晶体的密度为![]() g/cm3,阿伏加德罗常数用NA表示,求算晶体中两个距离最近的Mg2+中心间距离
g/cm3,阿伏加德罗常数用NA表示,求算晶体中两个距离最近的Mg2+中心间距离
20.(10分) 下表是元素周期表的前三周期,用相应的化学用语回答下列问题:
| a | b | c | d | e | |||
| f | g |
⑴g的单质能与f元素的最高价氧化物对应的水化物的溶液反应,请写出该反应的离子方程式 。
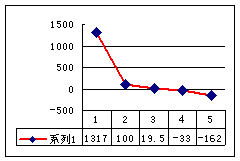
⑵第三周期8种元素按单质熔点(℃)大小顺序的柱形图(上左图),其中序列“2”代表 ,“8”代表 。
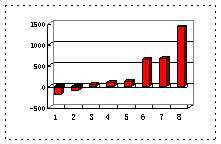
⑶a、b、c、d、e的氢化物的沸点直角坐标图(上右图),序列“5”氢化物的化学式为 ,序列“1”的氢化物的电子式: 。
五、(本题包括1小题,共22分)
21、一定温度下C(固)和水蒸气在密闭容器中发生反应,建立化学平衡:C(固)+H2O(气)![]() CO(气)+H2(气);△H>0
CO(气)+H2(气);△H>0
(1)平衡混合气的平均分子量M平的取值范围为 >M平>
(2)若使用CO和H2从逆反应方向在相同温度下建立平衡,则平衡混合气的平均相对分子质量M平的取值范围为 >M平>
此时若加压,平衡将 (向左、向右、不)移动,设原平衡时混合气体中气体的物质的量共a mol ,加压、重新达到平衡后,气体比原平衡减少b mol,则新平衡时混合气平均相对分子质量M平‘与M平的关系为M平‘= (用M平、a、b的数学式表示)
(3)在(2)建立的平衡中,当①M平‘=M平时,M平= ,此时反应开始时,所用CO、H2的物质的量之比= ,②当M平< 时,M平‘<M平,③当M平> 时,M平’>M平
(4)由(3)得出结论:从逆反应方向建立平衡时,M平‘与M平的相对大小主要取决于 。
22.(8分)配平下列离子方程式,并回答问题:
(1)□Fe(OH)3+□ClO-+□OH-=□FeO4n-+□Cl-+□______
(2)若有3.21 g Fe(OH)3参加反应,共转移了5.418×1022个电子,则n=____,FeO4n-中铁元素的化合价为_______。
(3)试推测Fe(OH)3能与下列哪些物质反应(填序号)_________。
A.Cl2 B.SO2 C.H2S D.O2
六、(本题包括2小题,共18分)
23.(10分)发生的基本反应之一如下:FeO(固)+CO(气)≒Fe(固)+CO2(气)ΔH=-Q ,其平衡常数可表达为 K=![]() ,已知1100℃时,K=0.263 。
,已知1100℃时,K=0.263 。
(1)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO和体积比值
平衡常数K值 (本小题空格均备选:增大、减小或不变)
(2)1100℃时测得高炉中[CO2]=0.025mol/L [CO]=0.1mol/L,在这种情况下,该反应是否处于化学平衡状态 (选填是或否),此时,化学反应速度是V正 V逆(选填大于、小于或等于),其原因是
24.将等物质的量的A、B、C、D四种物质混合,发生如下反应:
![]() aA+bB cC(固)+dD
aA+bB cC(固)+dD
当反应进行一定时间后,测的A减少了n摩,B减少了n/2摩,C增加了3/2n摩,D增加了n摩,此时达到了化学平衡
(1)该化学方程式中各物质的系数为:a= 、b= 、c= 、d= ;
(2)若只改变压强,反应速度发生变化,但平衡不发生移动,该反应中各物质的聚集状态:A 、B 、D ;
(3)若只升高温度,反应一段时间后,测知四种物质其物质的量又达到相等,则该反应为 反应(填"放热"或"吸热").
七、(本题包括2小题,共18分)
![]()
![]() 26.(10分)在完全满足可逆反应:2H2O(g) 2H2+O2, 2CO+O2 2CO2
26.(10分)在完全满足可逆反应:2H2O(g) 2H2+O2, 2CO+O2 2CO2
能顺利进行的条件下,将2molH2O(g)和2molCO充入1L密闭容器中,使其发生反应,一段时间后反应达到平衡。反应过程中部分气体浓度随时间t的变化情况如下图所示:
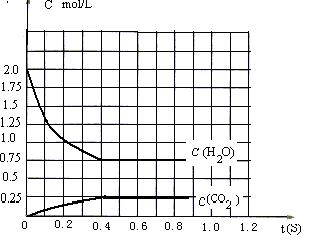
(1)请在图中画出c(H2) 随时间t的变化曲线图;平衡时 c (O2)平为 mol/L。
(2)欲计算出平衡时O2的浓度,除已知“H2O(g)和CO”的物质的量外,至少需要知道平衡体系中某两种气体的平衡浓度。这两种气体除可以是H2O和CO2外还可以是
。
(4)在其它条件不变的情况下,若改为起始时在容器中充入2molH2和2molCO2,则上述两反应达到平衡时,c (O2)平= mol/L。
。
参考答案
17.⑴bc (3分)
⑵分别取适量MgCl2溶液、AlCl3溶液于两支试管中,分别向两支试管中加入适量NaOH溶液或氨水,将所得沉淀分别等分为两份,分别向一份Mg(OH)2、Al(OH)3中加入适量NaOH溶液,Mg(OH)2不溶解,Al(OH)3溶解;再分别向另一份Mg(OH)2、Al(OH)3中加入适量盐酸,全部溶解,说明Mg的金属性比Al强。(3分)
18.⑴2Al+6H+==2Al3++3H2(1分)
⑵①Cl-对铝与H+反应有促进作用(1分)
②SO42-对铝与H+反应有抑制作用(1分)
⑶①向以上稀H2SO4中加入少量NaCl或KCl固体,如果能使反应速度加快,则假设①成立(2分)
②向以上稀HCl中加入少量Na2SO4或K2SO4固体,如果都能使反应速率减慢,则假设②成立(2分)
⑷①加入含有Cl-的可溶性氯化物②增加浓度③加热④将铝片改为铝丝⑤利用不活泼金属或不活泼金属的可溶性盐形成原电池(4分
19.⑴正八面体 4 ⑵面心(每空2分,共6分)
⑶每个晶胞中含F—:12×1/4 =3 K+:1 Mg2+:8×1/8 =1
该晶体的化学式为KMgF3 (2分)
晶体中两个距离最近的Mg2+中心间距离,即为立方晶胞的边长,设为a cm
则有a3 cm
3·NA
mol-1·![]() g/cm3 = 120 g /mol
g/cm3 = 120 g /mol
a=![]() cm(2分)
cm(2分)
20.⑴2OH—+2Al+2H2O=2AlO2—+3H2↑
⑵Cl2 Si ⑶ CH4 Li+[∶H]— (每空2分,共10分)
21. (1)18 >M平> 15
(2)2 >M平> 2 8 、向左 、(aM平—12b)/(a—b)
(3)12 、5:8、12 、12
(4)CO与H2 的起始投入量的相对大小
22.(1)2 5-n 2n 2 5-n n+3 H2O(2分) (2)2 +6(4分)(3)BC(2分)
25.(10分)(1)如右下图 (2)0.5mol /L (3)H2和CO(或H2和CO2或H2O和CO)
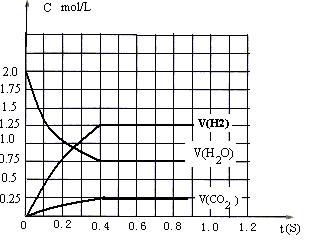 (4)0.5mol/L
(4)0.5mol/L
| |