高考化学第一次调研测试卷
可能用到的原子量:H:1 C:12 N:14 O:16 S:32 Cl:35.5 Ag:108
第Ⅰ卷 (选择题 共64分)
一、单项选择题(本题包括8小题,每小题4分,共32分。每小题只有一个答案)
1.“抓好资源节约,建设环境友好型社会”,是我国社会和经济长期发展的重要保证。你认为下列做法与之不相符的是
A.推广使用乙醇汽油作汽车燃料
B.研制开发以水代替有机溶剂的化工涂料
C.农村大力发展沼气,将废弃的秸杆转化为清洁高效的能源。
D.包装盒、快餐盒等全部用聚苯乙烯生产,以减少木材的使用
2.一定量的锎(252 98Cf)是有用的中子源,1 mg (252 98Cf)每秒约放出2.34×199个中子,在医学上常用作治疗恶性肿瘤的中子源。下列有关锎的说法错误的是
A.(252 98Cf)原子中,中子数为154 B.(252 98Cf)原子中,质子数为98
C.(252 98Cf)原子中,电子数为98 D.锎元素的相对原子质量为252
3.氧可与许多元素形成化合物,下列有关叙述错误的是
A.水分子的结构式为
B.氧与氟形成的化合物(OF2)中,氧元素的化合价为-2价
 C.Na2O2的电子式为Na+
Na+
C.Na2O2的电子式为Na+
Na+
D.在MgO晶体中,O2-的结构示意图可表示为
4.下列做法符合实验操作或事故处理规范的是
A.做氢气还原氧化铜的实验时,先加热氧化铜再通氢气
B.蒸馏石油时,将温度计插入到石油液面以下
C.皮肤上不慎沾有少量浓硫酸时,立刻用大量水冲洗
D.配制浓硫酸与酒精的混合液时,将酒精加入盛有浓硫酸的烧杯中
5.下列有关物质性质的比较中,正确的是
....
A.酸性:H2SO4 < HClO4
B.水溶性: CH3CH2OH < CH3COOCH2CH3
C.稳定性: HF < HBr
D.碱性 RbOH < Mg(OH)2
6.下图分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图
 |
在上述实验过程中,所涉及的三次分离操作分别是
A.① 蒸馏 ② 过滤 ③ 分液 B.① 分液 ② 蒸馏 ③ 蒸馏
C.① 蒸馏 ② 分液 ③ 分液 D.① 分液 ② 蒸馏 ③ 结晶、过滤
7.已知下列几种烷烃的燃烧热数据如下:
| 烷烃 | 甲烷 | 乙烷 | 丙烷 | 丁烷 |
| 燃烧热/(kJ/mol-1) | 890 | 1560 | 2220 | 2880 |
据此判断,表示戊烷燃烧的热化学方程式正确的是
A.C5H12(l) + 8O2(g) = 5CO2(g) + 6H2O(l);△H = - 3540 kJ/mol
B.C5H12(l) + 8O2(g) = 5CO2(g) + 6H2O(g);△H = - 3540 kJ/mol
C.C5H12(l) + 8O2(g) = 5CO2(g) + 6H2O(g);△H = + 3540 kJ/mol
D.C5H12(l) + 8O2(g) = 5CO2(g) + 6H2O(l);△H = + 3540 kJ/mol
8.下列对有关化学反应过程或实验现象的解释中,正确的是
A.Cl2的水溶液可以导电,说明Cl2是电解质
B.在高温条件下,C能置换出SiO2中的Si,说明C的氧化性强于Si
C.向淀粉碘化钾的溶液中加入氯水,溶液变为蓝色,说明Cl2的氧化性强于I2
D.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后,溶液褪色,说明BaCl2溶液有酸性
二、不定项选择题(每小题有一个或两个选项符合题意。每小题4分,共32分。)
9.阿佛加德罗常数约为6.02×1023 mol-1下列说法中正确的是
A.25℃时,纯水中含有的H+数为1×10-7×6.02×1023
B.Na与H2O反应生成1.12LH2(标准状况),反应中转移的电子数为0.1×6.02×1023
C.100mL0.2mol/L的Fe2(SO4)3溶液中,含有的Fe3+数为0.1×0.2×6.02×1023
D.46gN2O4气体中所含有的原子数为3×6.02×1023
10.下列反应的离子方程式正确的是
A.Cu和稀硝酸反应:3Cu + 8H+ + 2NO3- ![]() 3Cu2+ + 2NO↑+
4H2O
3Cu2+ + 2NO↑+
4H2O
 B.氢氧化镁与稀硫酸反应:H+ + OH- = H2O
B.氢氧化镁与稀硫酸反应:H+ + OH- = H2O
C.Ca(HCO3)2溶液与过量的NaOH溶液反应:
Ca2+ + 2HCO3- +2OH- = CaCO3↓+ CO32- + 2H2O
D.等物质的量浓度、等体积的NH4HCO3溶液与NaOH溶液相混合:
NH4+ + HCO3- + 2OH- = NH3·H2O + CO32- + H2O
11.右图是10mLpH均为2的盐酸和醋酸分别与足量的碳酸钙反应
一段时间后,所观察到的实验现象(反应过程中产生的气体收集
在试管上部的气球中)。下列说法正确的是
A.甲试管中盛放的是盐酸溶液
B.甲试管中盛放的是醋酸溶液
C.图中所示的反应瞬间,甲试管中溶液的pH小于乙试管中溶液的pH
D.图中所示的反应瞬间,甲试管中溶液的pH大于乙试管中溶液的pH
12.下列混合溶液中,各离子浓度的大小顺序正确的是
A.10mL0.1mol/LNH3·H2O溶液与10mL0.1mol/LHCl溶液混合:
c(Cl-) > c(NH4+) > c(OH-) > c(H+)
B.10mL0.1mol/LNH4Cl溶液与5mL0.2mol/LNaOH溶液混合:
c(Na+) = c(Cl-) > c(OH-) > c(H+)
C.10mL0.1mol/LCH3COOH溶液与5mL0.2mol/LNaOH溶液混合:
c(Na+) > C(CH3COO-) > c(OH-) > c(H+)
D.10mL0.5mol/LCH3COONa溶液与6mL1mol/LHCl溶液混合
c(Cl-) > c(Na+) > c(OH-) > c(H+)。
13.镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,使镁原电池越来越成为人们研制绿色原电池的关注焦点。其中一种镁原电池的反应为:
x Mg + Mo3S4 ![]()
![]() MgxMo3S4
MgxMo3S4
在镁原电池放电时,下列说法错误的是
A.Mo3S4发生氧化反应
B.正极反应为:Mo3S4 + 2xe- = Mo3S42x-
C.Mg2+向正极迁移
D.负极反应为:xMg - 2xe- = xMg2+
14.接触法制硫酸通常在400~500℃、常压和催化剂的作用下,用SO2与过量的O2反应生成SO3。 2SO2(g)
+ O2(g) ![]() 2SO3(g) ;△H < O
2SO3(g) ;△H < O
在上述条件下,SO2的转化率约为90%。但是部分发达国家采用高压条件SO3,采取加压措施的目的是
A.发达国家电能过量,以此消耗大量能源
B.高压将使平衡向正反应方向移动,有利于进一步提高SO2的转化率
C.加压可使SO2全部转化为SO3,消除SO2对空气的污染
 D.高压有利于加快反应速率,可以提高生产效率
D.高压有利于加快反应速率,可以提高生产效率
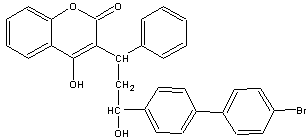
15.溴敌隆是一种理想的杀鼠剂,其结构简式如右图所示。溴敌隆在碱性条件下水解,再经酸化,其产物的化学式为C30H25BrO5。下列说法正确的是
A.溴敌隆的化学式为C30H24BrO4
B.在碱性条件下水解时,1mol溴敌隆将消耗4molNaOH
C.溴敌隆经水解,酸化后的产物(C30H25BrO5)1mol与足量浓溴水反应,消耗Br2的物质的量为3mol
D.1mol溴敌隆最多可与12molH2发生加成反应
16.某无色溶液,由Na+、Ba2+、Al3+、AlO2-、Fe3+、CO32-、SO42-中的若干种组成。取适量该溶液进行如下实验:① 加入过量盐酸,有气体生成;② 在①所得的溶液中再加入过量碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲;③ 在②所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出。原溶液中一定存在的离子是
A.Al3+、Fe3+、SO42- B.Na+、AlO2-、CO32-
C.Na+、AlO2-、SO42-、CO32- D.Na+、Ba2+、AlO2-
第Ⅱ卷 (非选择题 共86分)
三、(本题包括2小题,共21分)
17.现有含NaCl、Na2SO4、NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、NO3-的相互分离。相应的实验过程可用下图表示:
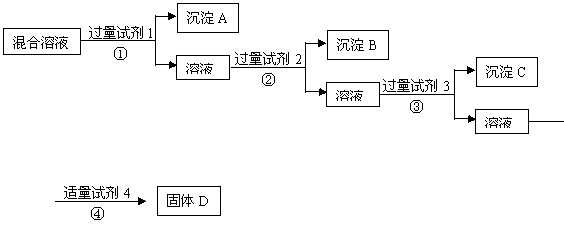
(1) 写出上述实验过程中所用试剂的名称:
试剂1___________试剂2_____________试剂4________________
(2)恰当地控制试剂4的加入量的方法是_________________________________
(3)加入过量试剂3的目的是_______________________________
(4)在加入试剂4后,获得固体D的实验操作④是___________(填操作名称)
18.阿斯匹林(乙酰水杨酸)是由水杨酸和乙酸酐合成的:
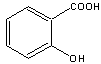 | |||
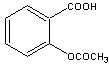 | |||
+ (CH3CO)2O ![]() + CH3COOH
+ CH3COOH
(水杨酸) (乙酸酐) (阿斯匹林)
在生成乙酰水杨酸的同时,水杨酸分子间也能发生缩合反应,生成少量聚合物(副产物)。合成乙酰水杨酸的实验步骤如下:
① 向150mL干燥锥形瓶中加入2g水杨酸、5mL乙酸酐和5滴浓硫酸,振荡,待其溶解后,控制温度在85~90℃条件下反应5~10min。然后冷却,即有乙酰水杨酸晶体析出。
② 减压过虑,用滤液淋洗锥形瓶,直至所有晶体被收集到布氏漏斗中。抽滤时用少量冷水洗涤晶体几次,继续抽滤,尽量交溶剂抽干。然后将粗产品转移至表面皿上,在空气中风干。
③ 将粗产品置于100mL烧杯中,搅拌并缓慢加入25mL饱和碳酸氢钠溶液,加完后继续搅拌2~3分钟,直到没有二氧化碳气体产生为止。过滤,用5~10mL蒸馏水洗涤沉淀,合并滤液于烧杯中,不断搅拌,慢慢加入15mL4mol/L盐酸,将烧杯置于冷水中冷却,即有晶体析出。抽滤,用冷水洗涤晶体1~2次,再抽干水分,即得产品。
请回答下列问题:
(1) 第①步中,要控制反应温度在85~90℃,应采用_________ 加热方法。用这种加热方法需要的玻璃仪器有__________。
(2) 在第②步中,用冷水洗涤晶体,其目的是___________________________
(3) 第③步中,加入碳酸氢钠的作用是____________________
加入盐酸的作用是________________________
(4) 如何检验产品中是否混有水杨本?___________________________
四、(本题包括2小题,共18分)
19.X、Y、Z、W是原子序数依次增大的短周期元素(稀有气体除外),其中两种为金属元素。X原子的原子半径是短周期元素中原子半径最大的,Y的单质可与浓NaOH溶液反应,X原子与Z原子最外层电子数之和为7。请回答下列问题:
(1) X和W形成的化合物的晶体类型为_______________
(2) Z的氢化物的相对分子质量与H2O2的相对分子质量相等,但其沸点却低于H2O2的沸点,理由是___________________________
(3) Y的单质与浓NaOH溶液反应的离子方程式是_________________________
(4) 0.1molW的单质与50mL1.5mol/L 的FeBr2溶液完全反应,则反应中被氧化的Fe2+和Br-的物质的量之比是_____________
20.将一定量的晶体A,隔绝空气加热到200℃时,A全部分解为等物质的量的四种气体。这四种物质与其他的相互转化关系如下图所示,J是一种常见的金属单质,C是一种非极性分子。图中部分反应条件及生成物没有列出。
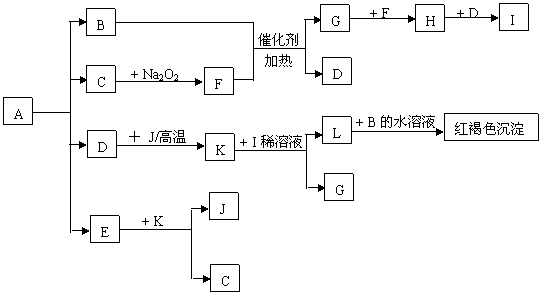 |
请按要求填空:
(1) 单质J的化学式_____________,E的分子式是______________
(2) 写出B和F反应的化学方程式______________________________
(3) 写出K和I的稀溶液反应的离子方程式___________________________
(4) A的化学式为______________________________
五、(本题包括1小题,共10分)
21.汞单质及其化合物在工业生产和研究上有广泛的用途,汞唯一重要的矿源是朱砂(HgS)。朱砂炼汞的反应之一为:
HgS + O2
![]() Hg + SO2
Hg + SO2
请完成下列问题:
(1) HgS与O2的反应中,氧化剂是______________,每生成1molHg转移电子的物质的量为__________
(2) 电解某汞的硝酸盐溶液,当阴极消耗a mol金属阳离子时,可获得2a mol金属单质,同时阳极可得0.5a mol的气体产物。则该气体产物是____________(填化学式),由此可推断出该盐的化学式为_____________。其阴极上所发生的还原反应的方程式是___________________________
(3) 随着冶炼、电镀等工业生产的不断发展,所需汞及其化合物的用量也日趋增多,随之排放出来的含汞的废水也愈加严重,现已成为世界上危害较大的工业废水之一。请你提出一种处理含汞(Hg2+)废水的方法____________________________
六、(本题包括2小题,共19分)
22.有机物A的化学式为C5H8O4。对其进行分析的实验结果如下:
① A与银氨溶液共热,发生银镜反应。
② A分子内酯化形成含有五元环的化合物
③ 1molA与足量的NaHCO3溶液反应放出22.4LCO2,1molA与足量的Na反应放出22.4LH2(气体体积均在标准状况下测定)。
试回答下列问题:
(1) 写出A中含有的所有官能团的名称______________
(2) 写出符合上述条件的A的各种结构简式______________________
(3) C5H8O4的同分异构体很多,其中含有两个羧基的同分异构体有_________种。
23.已知:(1) 同一个碳原子上连接两个羧基是不稳定的。
(2) 碳碳双键有如下的断裂方式:
R'CH=CR2 ![]()
![]() R'COOH + R-
R'COOH + R-![]() -R
-R
R'CH=CH2 ![]()
![]() R'COOH + CO2
R'COOH + CO2
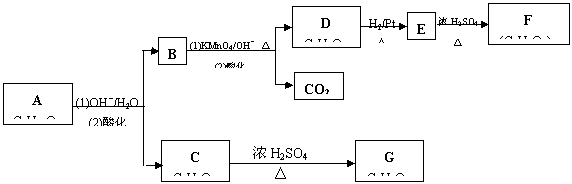 酯A(C6H10O3) 可发生如下图所示的转化:
酯A(C6H10O3) 可发生如下图所示的转化:
(1) 写出A、D、G的结构简式
A_________ D______________ G______________
(2) 指出相关转化过程的反应类型:
A ![]() B + C ____________ D
B + C ____________ D ![]() E
_________________
E
_________________
(3) 写出E转化为F的化学方程式_________________________
七、(本题包括2小题,共18分)
24.用含淀粉质量分数为54%的薯干2.0t来制取酒精。若在发酵过程中有85%的淀粉转化为酒精,求发酵后最多能生产含乙醇质量分数为50%的酒精多少吨?
25.某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路。某实验小组的同学对该厂生产的印刷电路后所得的废液进行了分析:取50mL废液,向其中加入足量的稀硝酸,生成0.02molNO;另取50mL废液,向其中加入足量的AgNO3溶液,析出沉淀43.05g。请回答以下问题
(1) 该厂原来使用的FeCl3溶液中溶质的物质的量浓度为____________(反应前后溶液的体积变化忽略不计)
(2) 原废液中各金属阳离子的物质的量浓度之比为__________
(3) 另取50mL废液,加入一定量铁屑,充分反应后有铜析出,则所得溶液中Fe2+的物质的量范围为__________________
参考答案
1、D 2、D 3、B 4、D 5、A 6、B 7、A 8、C
9、BD 10、AC 11、BC 12、B 13、A 14、BD 15、C 16、B
17、(1)氯化钡溶液或硝酸钡溶液 硝酸银溶液 硝酸溶液
(2) 测定溶液的pH
(3) 除去溶液中过量的Ba2+、Ag+
(4) 蒸发、冷却、结晶、过滤
18、(1)水浴、酒精灯、烧杯、温度计
(2) 洗涤晶体表面附着的杂质、减少阿斯匹林因溶解而引起的损耗、
(3) 使阿斯匹林转化为可溶性盐,而与不溶性的物质相互分离。
将阿斯匹林的可溶性盐重新转化为阿斯匹林,从而达到提纯的目的
(4) 向水中加入少量产品,然后滴加FeCl3溶液,若有紫色出现,说明产品中有水杨酸;若无紫色出现,说明产品中不含水杨酸
19、(1) 离子晶体
(2) H2O2分子间可以形成氢键,从而导致其沸点升高
(3) 2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑
(4) 3:5
20、(1) Fe CO
(2) 4NH3 + 5O2
![]() 4NO + 6H2O
4NO + 6H2O
(3) 3Fe3O4 + 28H+ + NO3- = 9Fe3+ + NO↑+ 14H2O
(4) NH4HC2O4
21、(1) HgS和O2 6
(2) O2 Hg2(NO3)2 Hg22+ + 2e- = 2Hg
(3) ①向含Hg2+的废水中加入Na2S等可溶性硫化物,② 电解法 ③ 加入金属还原剂等合理的方法均可
22、(1) 羟基、醛基、羧基
(2)
(3) 4
![]()
![]()
![]()
![]() 23、(1) CH2=C-
23、(1) CH2=C-![]() -O-CH2CH2OH CH3-
-O-CH2CH2OH CH3-![]() -COOH
-COOH
(2) 取代(或水解) 加成(或还原)
(3)
24、1.04 t
25、(1) 2mol/L
(2) c(Fe3+):c(Fe2+):c(Cu2+) = 4 : 6 : 3
(3) 0.12 mol < n(Fe2+) ≤ 0.15 mol