高考化学第一次调研考试试题卷
化学试题
第Ⅰ卷 (选择题共48分)
可能用到的相对原子量:H 1 C 12 N 14 O 16 K 39 Cr 52
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有1个选项符合题意)
1.中共十七大报告提出:“建设生态文明,基本形成节约能源资源和保护生态环境的产业结构、增长方式、消费模式”。下列行为不利于“生态文明”建设的是
A.设计绿色化工工艺,提高原子利用率
B.推广“低碳经济”,减少温室气体的排放
C.开发可再生能源,合理使用化石燃料,提高能源利用率
D.推进小煤矿、小火力电站的兴建,促进地方经济的快速发展
2.2007年诺贝尔化学奖授予德国化学家Gerhard Ertl,以表彰他在表面化学领域研究所取得的开拓性成就。某反应在Pd/Al2O3/Ba催化剂表面吸附与解吸作用的机理如下图所示(图中HC表示碳氢化合物,nitrate指硝酸盐),该机理研究是指
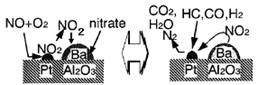
A.汽车尾气催化转化机理 B.钢铁生锈机理
C.合成氨工业催化氧化机理 D.氢氧燃烧电池电极反应机理
3.下列实验设计不能达到目的的是
A.除去乙酸乙酯中少量的乙酸,用饱和碳酸钠溶液洗涤分液
B.碘水中的碘,用酒精萃取
C.鉴别硅酸胶体与碳酸钠两种无色液体,用丁达尔效应
D.检验Fe2+可用KSCN溶液和氯水
4.下列各组离子在强碱性溶液中一定能大量共存的是
A.Na+、NH4+ 、SO42- B.Ag+、Fe3+ 、Cl-
C.K+、Ba2+、HCO3- D.Ba2+、K+、NO3-
5.下列叙述不正确的是
A.氨气变成液氨的过程中,熵值减小,同时向环境释放能量
B.废旧电池必须回收处理,防止电池中含有的汞、铅、镉等金属污染环境
C.pH=5的盐酸,稀释1000倍后,溶液pH约为8
D.离子化合物中一定含有离子键,可能还含有共价键
6.下列有关生活中的化学问题,说法正确的是
A.因脂肪氧化产生的能量比糖类高,可大量饮食脂肪
B.若工厂贮氯罐意外泄漏时,应紧急组织邻近群众沿逆风方向撤离
C.人体中不含水解纤维素的酶,故人类饮食中不需摄入纤维素含量高的食品
D.给酸性土壤施肥时,可将铵盐与石灰混合后再使用
 7.2008年北京奥运会主体育场——“鸟巢”,被《泰晤士报》评为全球 “最强悍”工程。 “鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓铟高亮度LED材料。有关说法正确的是
7.2008年北京奥运会主体育场——“鸟巢”,被《泰晤士报》评为全球 “最强悍”工程。 “鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓铟高亮度LED材料。有关说法正确的是
A. 合金的熔点通常比组分金属高,硬度比组分金属小
B.已知Ga处于ⅢA主族,可推知氮化镓化学式为Ga3N2
C.用金属铝与V2O5冶炼钒,铝作还原剂
D.ETFE膜(![]() )是由两种单体缩聚而成的
)是由两种单体缩聚而成的
 8.我国成功地发射了嫦娥一号探测卫星,确定对月球土壤中14种元素的分布及含量进行探测等。月球的矿产资源极为丰富,仅月面表层5cm厚的沙土就含铁单质有上亿吨,月球上的主要矿物有辉石[CaMgSi2O6]、斜长石[KAlSi3O8] 和橄榄石[(Mg,Fe)2SiO4]等,下列说法或分析不正确的是
8.我国成功地发射了嫦娥一号探测卫星,确定对月球土壤中14种元素的分布及含量进行探测等。月球的矿产资源极为丰富,仅月面表层5cm厚的沙土就含铁单质有上亿吨,月球上的主要矿物有辉石[CaMgSi2O6]、斜长石[KAlSi3O8] 和橄榄石[(Mg,Fe)2SiO4]等,下列说法或分析不正确的是
A.辉石、斜长石及橄榄石均属于硅酸盐矿
B.斜长石的氧化物形式可表示为:K2O·Al2O3·6SiO2
C.橄榄石中铁为+2价
D.月球上有游离态铁是因为月球上铁的活动性比地球上铁的活动性弱
二、不定项选择题(本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
9.下列离子方程式书写正确的是
A.氨水吸收少量的二氧化硫:NH3·H2O + SO2 = NH4+ + HSO3-
B.用两个铜片作电极电解盐酸:Cu + 2H+ ![]() H2↑+ Cu2+
H2↑+ Cu2+
C.钠与水反应:Na +2H2O = Na+ +2OH- +H2↑
D.铜与稀硝酸反应:3Cu +8H+ + 2NO3- = 3Cu2+ +2NO↑ +4H2O
10.镁/H2O2酸性燃料电池采用海水作电解质(加入一定量的酸),下列说法不正确的是
A.电池总反应为:Mg+H2O2=Mg(OH)2
 B.正极发生的电极反应为:H2O2+2H++2e-=2H2O
B.正极发生的电极反应为:H2O2+2H++2e-=2H2O
C.工作时,正极周围海水的pH增大
D.电池工作时,溶液中的H+向负极移动
11.百里酚酞是常用的滴定指示剂,pH小于9.4为无色,大于10.6时为蓝色,百里酚酞的结构式如右图,可由邻苯二甲酸酐 等原料合成得到。有关说法不正确的是
等原料合成得到。有关说法不正确的是
A.百里酚酞中含有羟基、酯基及苯基等官能团
B.邻苯二甲酸酐分子中所有原子处于同一平面
C.1mol百里酚酞在溶液中最多可与4molNaOH反应
D.用已知浓度的烧碱滴定未知浓度的盐酸,用酚酞作指示剂比百里酚酞误差小
12.阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是
A.1molNH3催化氧化完全转变为NO时,转移5×6.02×1023e-
B.-140℃下,92g四氧化二氮晶体,恢复到标准状况时,N2O4分子数为6.02×1023个
C.3.9g过氧化钠中含有6.02×1023个O2-离子
D.1mol ![]() U核素,含有235×6.02×1023个中子
U核素,含有235×6.02×1023个中子
13.下列说法不正确的是
A.配制FeCl2溶液时,可将FeCl2晶体先溶于浓盐酸,再加水稀释和少量铁屑保存
B.输油管道,为防止其表面被腐蚀应涂上隔水材料并与外电源负极相连
C.pH值均为9的NaOH溶液和Na2CO3溶液,两溶液中水的电离程度相同
D.0.1mol/L 弱酸HA溶液与0.05mol/L NaOH溶液等体积混合后所得溶液微粒浓度间有: 2c(H+)+c(HA) = c(A-)+2 c(OH-)
14.已知2-丁烯有顺、反两种异构体,在某条件下两种气体处于平衡,
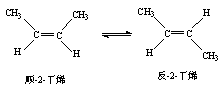 △H= -4.2 kJ/mol
△H= -4.2 kJ/mol
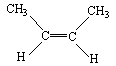 (g)+H2(g)→CH3CH2CH2CH3(g) △H=-118.9kJ/mol;
(g)+H2(g)→CH3CH2CH2CH3(g) △H=-118.9kJ/mol;
下列说法正确的是
A.顺-2-丁烯比反-2-丁烯稳定 B.顺-2-丁烯的燃烧热比反-2-丁烯大
C.加压和降温有利于平衡向生成顺-2-丁烯反应方向移动
D.反-2-丁烯氢化的热化学方程式为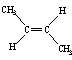 (g)+H2(g)→CH3CH2CH2CH3(g)
(g)+H2(g)→CH3CH2CH2CH3(g)
△H=-114.7kJ/mol
第Ⅱ卷(非选择题 共72分)
三、(本题包括2小题,共16分)
15.(8分)据统计,每年世界上银总消耗量的40%用于感光材料的生产,感光材料经曝光、显影、定影后,黑白片上的银80%左右进入定影液,彩色片上的银几乎全部进入废定影液,所以废定影液中银的含量是十分惊人的。
某研究性学习小组拟对某照相公司的废定影液进行实验处理,回收其中的银和溴。
(一) 资料支撑:
① 定影液(硫代硫酸钠,Na2S2O3)跟胶片或相纸上没有感光部分的溴化银反应,反应方程式为:AgBr(s)+ 2Na2S2O3(aq) = Na3[Ag(S2O3)2](aq) + NaBr(aq)。
② 在酸的作用下,Na3[Ag(S2O3)2]能转化为不溶性的Ag2S。反应原理为:
6HCl+2Na3[Ag(S2O3)2]=6NaCl+Ag2S↓+3S↓+3SO2↑+H2SO4+2H2O。
③溶液中有少量溴化银,可用锌将其还原出来。
(二) 实验程序设计
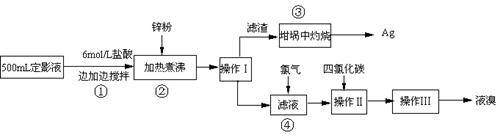
(三) 试回答下列问题
(1)本实验需用6mol/L的盐酸250mL,配制时除需量筒、烧杯、玻璃棒外,还需用的仪器有: 、 。
(2)指出流程图中操作所包含的装置是(填序号:A、B、C)Ⅰ Ⅱ Ⅲ 。

(3)步骤③是在空气中灼烧的。该反应的化学方程式: 。实验操作时,加入适量的硝酸钾加盖后再灼热,加硝酸钾的目的可能是: 。
(4)加入锌粉发生的离子反应为: 。
16.(8分)铝及铝合金经过阳极氧化,铝表面能生成几十微米的氧化铝膜。某研究性学习小组模拟工业法对铝片表面进行氧化处理。他们的实验步骤如下:
a.铝片的预处理,取出一定大小的铝片,依次用苯、酒精擦洗铝片的表面
b.用水冲洗经有机物擦洗的铝片,浸入60~70℃的2mol/L的NaOH溶液中,约l min后,取出用水冲洗干净,再用钼酸铵溶液处理以抑制电解生成的氧化铝被硫酸溶解。
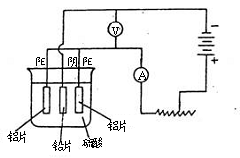 c.阳极氧化。以铅为阴极,铝片为阳极,以硫酸溶液为电解液,按照下图连接电解装置,电解40min后取出铝片,用水冲洗,放在水蒸汽中封闭处理20~30min,即可得到更加致密的氧化膜。
c.阳极氧化。以铅为阴极,铝片为阳极,以硫酸溶液为电解液,按照下图连接电解装置,电解40min后取出铝片,用水冲洗,放在水蒸汽中封闭处理20~30min,即可得到更加致密的氧化膜。
试回答下列问题
(1)用苯和酒精擦拭铝片的目的: ,氢氧化钠溶液处理铝片的目的是: 。
(2)下列有关说法正确的是 (填序号)。
A.电解时电流从电源正极→导线→铝极,铅极→导线→电源负极
B.在电解过程中,H+向阳极移动,SO42-向阴极移动
C.电解过程中阳极周围的pH明显增大
D.电解的总方程式可表示为:2Al +6H+ ![]() 2Al3+ +3H2↑
2Al3+ +3H2↑
(3)阴极的电极反应式为: 。
四、(本题包括2小题,共16分)
17.(8分)现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等, A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子。
请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关):
(1) A~F六种元素原子,原子半径最大的是 (填序号)。
(2)A、C、D三种元素组成的一种常见化合物,是重要的工业产品,该化合物电子式为: 。
(3)B与F两种元素形成的一种化合物分子,各原子均达八电子结构,其中B显负价,F显正价,则该化合物水解的主要产物是: 。
(4)A、C、E三种元素形成的一种常见化合物,其浓溶液在加热条件下可与铜反应,该反应的化学方程式为: 。
18.(8分)氨在国民经济中占有重要的地位,请参与下列探究。
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。
C(s) + H2O(g) ![]() H2(g) + CO(g) △H = +131.3 kJ ,△S = +133.7 J/K
H2(g) + CO(g) △H = +131.3 kJ ,△S = +133.7 J/K
该反应在低温下能否自发 (填:能或否)。
(2)已知在400℃时,N2 (g)+ 3H2(g) ![]() 2NH3(g)的K=0.5,
2NH3(g)的K=0.5,
①2NH3(g)![]() N2 (g)+ 3H2(g)的K=
(填数值)。
N2 (g)+ 3H2(g)的K=
(填数值)。
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)
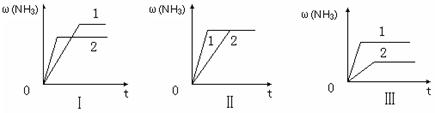
(3)在三个相同容器中各充入1 molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如下图。下列说法正确的是 (填序号) 。
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1
B.图Ⅱ可能是不同压强对反应的影响,且P1>P2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下,催化剂性能,1>2
五、(本题包括1小题,共16分)
19.(16分)人类利用太阳能已有3000多年的历史,太阳能科技突飞猛进。塑晶学名为新戊二醇(NPG),它和液晶相似,塑晶在恒温44℃时,白天吸收太阳能而贮存热能,晚上则放出白天贮存的热能。NPG是一种白色结晶固体,熔点124-130℃,沸点210℃,主要作为生产聚酯树脂、无油醇酸树脂等。已知:NPG的结构式为:,试回答下列问题:
(1)有关NPG说法正确的是 (填序号)。
A.NPG与乙二醇互为同系物
B.NPG可命名为:2,2-二甲基-1,3-丙二醇
C. NPG一定条件下能发生消去反应
D.研究确定NPG的结构,需经重结晶提纯并干燥、元素定量分析确定分子、相对分子质量测定和波谱分析确定结构
(2)已知同一个碳原子连两个羟基该物质不稳定,与NPG互为同分异构体且属于5碳直链稳定的二元醇有: 种;在其所有异构体中,消去2个水分子得到橡胶单体异戊二烯()的二元醇结构可能有: 种。
(3)NPG可与丙二酸等物质的量缩聚形成一种用途非常广泛的聚酯,该反应的化学方程式为: 。
(4)NPG合成方法之一是利用两种醛加成后再用Cu-ZnO作催化剂加氢得到,已知:
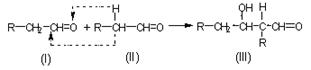
则两种醛的结构简式是: 。
(5)二溴新戊二醇,是一种纤维类织品的阻燃剂,文献记载二溴新戊二醇的合成方法,“季戊四醇先与浓度在98%以上的醋酸进行酯化反应,再通入溴化氢气体进行取代反应,保温后分离出二溴新戊二醇的二酯化物,然后于0.4-0.6Mpa压力下用甲醇和无机酸进行恒压酯分解,该合成方法反应温度低,生成的粗品二溴新戊二醇含量可达88%左右,产品收率高。”
试补充合成路线(只写相关反应物和相关生成物)
→□→□→
六、(本题包括1小题,共12分)
20.(12分)为研究水滑石的组成、结构和性质,某校研究性学习小组取得了二种牌号的水滑石样品拟进行探究,请你参与探究并回答相关问题。
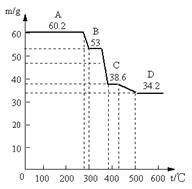 (1)甲同学取天然水滑石样品进行恒重分析,已知天然水滑石的化学式可表示为:6MgO·Al2O3·CO2·12H2O,取0.1mol水滑石进行加热时,温度与剩余固体质量的关系如下图,平行线上的数字表示残留固体的质量。
(1)甲同学取天然水滑石样品进行恒重分析,已知天然水滑石的化学式可表示为:6MgO·Al2O3·CO2·12H2O,取0.1mol水滑石进行加热时,温度与剩余固体质量的关系如下图,平行线上的数字表示残留固体的质量。
当温度在0~280℃质量不变,是什么原因: 。
A→B减少的物质及其物质的量为: ;
C→D减少的物质及其物质的量为: ;
D处化学组成为: 。
(2)乙组取的CA(美国化学文摘)登记号为12304-65-3 的合成水滑石样品,现只知其化学式为:MgaAlb(OH)C(CO3)d, a+b+c+d=25, a、b、c、d为正整数。取该水滑石样品0.1mol,用1mol/L盐酸使其完全溶解。
①消耗盐酸的体积至少为: L(用字母表示);
②若参加反应的盐酸的物质的量与生成CO2的物质的量之比为18∶1,则该水滑石的化学式为: 。
七、选做题(下列21、22两题分别对应于“物质的结构与性质”和“实验化学”两个选修课程模块的内容,请你选择其中的一题作答,如果两题全做,按第一题评分。共12分)
21.(12分)过渡金属元素氧化物的应用研究是目前科学研究的前沿之一,试回答下列问题:
Ⅰ、二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化。有关甲醛、苯、二氧化碳及水说法正确的是 。
A.苯与B3N3H6互为等电子体
B.甲醛、苯分子中碳原子均采用sp2杂化
 C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
D.水的沸点比甲醛高得多,是因为水分子间能形成氢键
Ⅱ、2007年诺贝尔物理学奖为法国科学家阿尔贝·费尔和德国科学家彼得·格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就。某钙钛型复合氧化物(如右图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应。
⑴用A、B、O表示这类特殊晶体的化学式: 。
⑵已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3, (x < 0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁转变及金属-半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为: 。(用含x的代数式表示)
⑶Mn的核外电子排布式为: 。
 ⑷下列有关说法正确的是
。
⑷下列有关说法正确的是
。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧的第一电离能比氮的第一电离能大
C.锰的电负性为1.59 ,Cr的电负性为1.66,说明锰的金属性比铬强
D.铬的堆积方式与钾相同,则其堆积方式如右图:
22.(12分)重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:
6FeO·Cr2O3 +
24NaOH +7KClO3![]() 12Na2CrO4 + 3Fe2O3 +7KCl + 12H2O,
12Na2CrO4 + 3Fe2O3 +7KCl + 12H2O,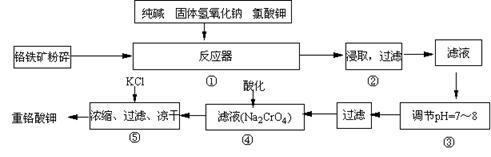
试回答下列问题
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出二氧化硅、氧化铝分别与碳酸钠反应的化学方程式:
; 。
(2)NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式: 。
(3)操作③的目的是什么,用简要的文字和化学方程式说明: 。
(4)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:
。
(5)称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①判断达到滴定终点的依据是: ;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品的中重铬酸钾的纯度(设整个过程中其它杂质不参与反应) 。