高考化学第一次质量检查试题
化学试卷
(完卷时间:90分钟;满分:100分)
一.选择题(本题共25小题,每小题2分,共50分,只有一个正确选项。)
1.即将在北京举行的2008年奥运会提出了“科技奥运、人文奥运、绿色奥运”的口号。为了使北京奥运会办成绿色奥运会,下列做法不可取的是 ( )
①开发新能源,减少矿物燃料的燃烧 ②关闭所有的化工企业 ③提倡使用一次性发泡塑料餐具和塑料袋 ④开发、生产无汞电池 ⑤机动车安装尾气净化器
A.①②③ B.③④⑤ C.①④ D.②③
2.下列各项中表达正确的是……………………………………………………………( )
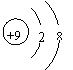 | |||
A.F—的结构示意图: B.乙炔的分子模型示意图:
C.NaCl的电子式:![]() D.乙酸的结构简式:C2H4O2
D.乙酸的结构简式:C2H4O2
|
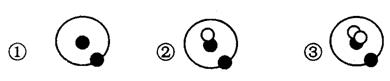
其中●表示质子或电子,O表示中子,则下列有关①②③的叙述正确的是 ( )
A.①②③互为同位素 B.①②③互有同素异形体
C.①②③是三种化学性质不同的粒子 D.①②③具有相同的质量数
4.若NA为阿伏加德罗常数,下列说法中正确的是
A.常温常压下,11.2LN2和NO的混合气体所含的原子数为NA
B.1 mol C8H18分子中,共价键总数为25NA
C.在1molSiO2晶体中含 Si-O键的数目为2NA
D.含0.1 mol H2O2的水溶液跟MnO2充分作用,反应过程中转移的电子总数为0.2NA
|
A.C3F8 的摩尔质量是188 B.全氟丙烷的电子式为:
C.相同压强下,沸点:C3F8<C3H8 D.全氟丙烷分子中既有极性键又有非极性键
6.将40℃的饱和硫酸铜溶液升温至50℃,或者温度仍保持在40℃而加入少量无水硫酸铜, 在这两种情况下均保持不变的是 ( )
A.硫酸铜的溶解度 B.溶液中溶质的质量分数
C.溶液的质量 D.溶液Cu2+中的数目
7.某一无色溶液,若向其中加入足量饱和氯水,溶液呈橙黄色;再向橙黄色溶液中滴加BaCl2溶液,产生白色沉淀;若向原溶液中加入铝粉,有气体放出,该溶液可能大量存在的一组离子是 ( )
A.K+、H+、NO3-、Na+ B.H+、Br-、SO42-、Ca+
C.SO42-、Br-、OH-、Fe3+ D.OH-、Br-、SO32-、K+
8.八角茴香含有一种抗亚洲禽流感病毒的重要成分莽草酸,莽草酸是目前世界上被证明是对抗禽流感的唯一良方——达菲的原材料。它的球棍结构模型如右图:
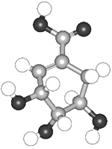 分子式中只含C、H、O元素,下列关于莽草酸的说法正确的是( )
分子式中只含C、H、O元素,下列关于莽草酸的说法正确的是( )
A.该化合物可以使溴水褪色,分子式为C7H10O5,
B.该化合物既具有酸性,又具有碱性
C.该化合物既可发生消去反应,也可被催化氧化生成醛
D.该化合物的分子中处于同一平面的原子只有4个
9.101kPa时,2g辛烷完全燃烧生成二氧化碳气体和液态水,放出96.81kJ热量,则下列表
示辛烷燃烧热的热化学方程式正确的是 ( )
A.2C8H18(1)+25O2(g)=16CO2(g)+18H2O(1);△H=-96.81kJ·mol-1
B.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1);△H=+5518kJ·mol-1
C.2C8H18(1)+25O2(g)=16CO2(g)+18H2O(1);△H=-11036kJ·mol-1
D.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1);△H=-5518kJ·mol-1
10.下列离子方程式正确的是 ( )
A.醋酸与小苏打溶液反应:H+ + HCO3- = CO2↑+ H2O
B.电解氯化镁溶液:2Cl- + 2H2O H2↑+ Cl2↑+ 2OH-
C.少量二氧化硫气体通入到Ca(ClO)2溶液中:
SO2 + H2O + Ca2+ + 2ClO- = CaSO3↓+ 2HClO
D.硫酸氢铵溶液中加入少量的氢氧化钠溶液:H+ + OH-= H2O
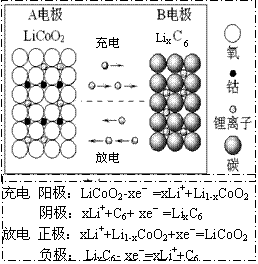 11.锂离子电池主要利用碳的还原和氧化进行工作,比传统的镉镍电池、氢镍电池性能更优越(如右图)。则下列叙述正确的是( )
11.锂离子电池主要利用碳的还原和氧化进行工作,比传统的镉镍电池、氢镍电池性能更优越(如右图)。则下列叙述正确的是( )
① 充电过程中,B极被氧化
![]() ② 该电池充放电的总反应式为:
② 该电池充放电的总反应式为:
LiCoO2+C6 Li1-xCoO2+LixC6
③ 放电时A极是负极,Li发生还原反应
④ 放电时B极是负极,C6X-发生氧化反应
A.①② B.①③ C.②③ D.②④
12.现有溶液中溶质的物质的量浓度均为0.01 mol·L-1的四种溶液:
①盐酸,②硫酸,③醋酸,④NaOH,下列说法正确的是 ( )
A.pH由小到大的顺序是①< ②< ③< ④
B.溶液中水电离出的H+浓度由小到大的顺序是②<①<④<③
C.取一定体积的④溶液,分别和①、②、③溶液完全中和,消耗①、②、③溶液的体积由小到大的顺序是②<①<③
D.取a体积的①溶液和b体积的④溶液混合后,溶液的pH为3,则a:b约为11:9
13.在一定的条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1molCr3+反应所需PbO2的物质的量为………………………………………………………………………( )
A.3.0mol B.1.5mol C.1.0mol D.0.75mol
|
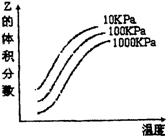
图中横坐标表示温度,纵坐标表示平衡混合气体中Z
的体积分数。下列叙述正确的是 ( )
![]() A.X + Y 2Z反应的逆反应的△H>0
A.X + Y 2Z反应的逆反应的△H>0
B.X、Y、Z均为气态
C.X和Y中只有一种是气态,Z为气态
D.降低温度Y的转化率升高
15.等体积等浓度的KOH溶液和HAc溶液混和后,混和液中有关离子的浓度应满足下列关系的是………………………………………………………………………………………( )
A.c(Ac-) >c(K+)>c(OH-)>c(H+) B.c(K+)>c(Ac-)>c(H+)>c(OH-)
C.c(K+)=c(Ac-)>c(OH-)>c(H+) D.c(K+)+c(H+) =c(OH-)+c(Ac-)
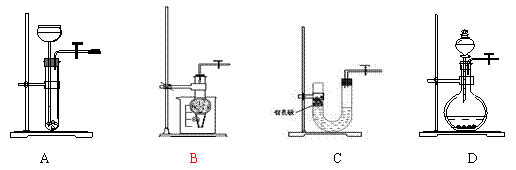 16.以下气体发生装置中,与启普发生器一样具有随开随停功能的是………………………………………………………………………………………( )
16.以下气体发生装置中,与启普发生器一样具有随开随停功能的是………………………………………………………………………………………( )
17.下表中,对陈述I、II的正确性及两者间是否具有因果关系的判断都正确的是 ( )
| 选项 | 陈述I | 陈述II | 判断 |
| A | 工业生产硫酸用水吸收SO3 | SO3可与水反应 | I对,Ⅱ对;有 |
| B | Cl2和SO2混合后可用于漂白纸浆 | Cl2和SO2都有较好的漂白作用 | I对,Ⅱ错,无 |
| C | 金属钠具有强还原性 | 钠在自然界里只能以化合态存在 | I对,Ⅱ对;无 |
| D | 石墨常用作电解池的电极 | 石墨的化学性质稳定且导电性好 | I对,Ⅱ对;有 |
18.下列除去括号内杂质的有关操作方法不正确的是 ( )
A.淀粉胶体溶液(葡萄糖):渗析
B.乙醇(乙酸):加KOH溶液,分液
C.甲醛溶液(甲酸):加NaOH溶液,蒸馏
D.肥皂液(甘油):加食盐搅拌(即盐析)后,过滤
19.有两种短周期元素,最外层电子数之和为9,质子数之和为13。关于这两种元素的说不正确的是 ( )
A.如果一种元素是金属元素,则另一种元素一定是稀有元素
B.如果一种元素的单质通常情况下是气体,则另一种元素的单质通常情况下是固体
C.如果一种元素的氢化物是三角锥形分子,则另一种元素的气态氢化物一定是正四面
体形分子
D.如果一种元素的最高正价是+3,则另一种元素的单质有两种常见的同素异形体
20.往HI溶液中滴加淀粉溶液无任何现象,但加入某物质后溶液立即变蓝,该物质可能是
( )
①氯水 ②Na2SO3溶液 ③KNO3溶液 ④FeCl3溶液 ⑤Na2S溶液
A.①②③④⑤ B.①③④ C.①④ D.①③
21.铝、铍(Be)及其化合物具有相似的物理、化学性质,如其氯化物分子内键型相同,故其氯化物晶体的熔点都较低。已知反应:BeCl2+Na2BeO2+2H2O==2NaCl+2Be(OH)2↓能完全进行,则下列推断中不正确的是 ( )
A.Na2BeO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为BeO
B.BeCl2溶液的pH<7,将其蒸干并灼烧后得到的残留物可能是BeO
C.Be(OH)2既能溶于盐酸,又能溶于NaOH溶液
D.虽然BeCl2的水溶液导电性强,但熔融态的BeCl2却不能被电解
22.有以下七种饱和溶液:①Ba(NO3)2;②Ca(OH)2;③Ca(ClO)2:④CaCl2;⑤Na2CO3;⑥NaAlO2;⑦NH3和NaC1,分别持续通入CO2,最终能得到沉淀或析出晶体的是( )
A.②④⑥ B.①③⑥ C.⑤⑥⑦ D.②③⑥
23.下列有关叙述正确的是 ( )
A.铁在点燃或灼热的条件下能与氯气反应生成氯化物,所以不能用钢瓶来储运液氯
B.电解质的导电性和金属晶体的导电性都随温度的升高而降低
C.“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高
D.碱金属单质性质活泼,易和O2、H2O反应,所以通常都保存在煤油中
24.金属钼的卡宾化合物可以作为非常有效的烯烃复分解反应的催化剂。工业上冶炼钼的化学原理为①2MoS2+7O2![]() 2MoO3+4SO2;②MoO3+2NH3·H2O=(NH4)2MoO4+H2O;
2MoO3+4SO2;②MoO3+2NH3·H2O=(NH4)2MoO4+H2O;
③(NH4)2MoO4+2HCl=H2MoO4↓+2NH4C1;④H2MoO4 ![]() MoO3+H2O;
MoO3+H2O;
⑤用还原剂将MoO3还原成金属钼。
则下列说法正确的是 ( )
A.MoS2煅烧产生的尾气可直接排空
B.MoO3不溶于氢氧化钠溶液
C.H2MoO4是一种强酸
D.利用H2、CO和铝分别还原等量的MoO3,消耗还原剂的物质的量之比为3∶3∶2
25.将10.5克的Mg、Al、Fe的混合物溶解在200.0mL足量的稀硝酸中,当金属完全溶解后,收集到标况下6.16升的气体,在反应后的溶液中加入5.0 moL/L,的NaOH溶液185.0mL时沉淀的质量达到最大,则稀硝酸的浓度为 ( )
A.1.375mol/L B.4.625mol/L C.6.0mol/L D.无法计算
长乐一中2006-2007学年第二学期第一次高三质量检查
化学试卷
班级 座号 姓名 成绩
一、选择题答案卷
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
|
| 答案 |
| ||||||||||||
| 题号 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 |
| 答案 |
二、填空题
26.(12分)物质的转化关系如下图所示(有的反应可能在水溶液中进行).其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化。
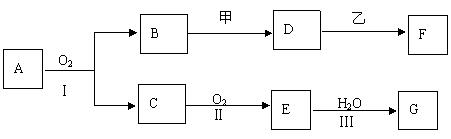 |
|
①工业上反应Ⅰ在 中进行,反应Ⅲ在 (均填设备名称)中进行。
②由两种单质直接化合得到甲的反应条件是 .
③反应Ⅰ的化学方程式是 。
(2)若甲为淡黄色固体,D、F的溶液均呈碱性,用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成.则
①甲物质中含有的化学键有 。
②D的溶液与乙反应的离子方程式是 。
③若1.7g A与O2反应生成气态的B和C时放出22.67kJ热量,写出该反应的热化学方程式: .
27.(8分)A、B、C、D、E均为短周期元素,且原子序数逐渐增大。A、D最外层电子数相等且能形成离子化合物,A与B的质子数之和等于C的质子数,A+与C2-的核外电子数之和等于D+离子的核外电子数,B原子与D+离子的核外电子数之和等于E原子的核外是电子数。
(1)B的元素符号为 ;由A、C、E三种元素组成的化合物甲具有漂白性,其电子式为 。
(2)A、C元素可组成原子个数比为1 :1的化合物乙,将E单质通入乙的水溶液中,生成一种强酸,并有气体放出,反应的化学方程式为 。
(3)A、B、C、E中的任意三种元素可组成多种化合物,请写出两种水溶液呈酸性的化合物,其中一种促进水的电离,另一种抑制水的电离 。
(4)A与B化合形成10电子化合物丙,A与E化合形成18电子化合物丁;常温下,pH=11的丙溶液与pH = 3的丁溶液等体积混合后溶液的pH 7(填“>”“<”“=”),溶液中离子浓度由大到小的顺序为 。
28.(8分)在一容积为2L且容积不变的密闭容器中加入适量碳粉和0.2molH2O。在800 °C条件下,经20s后达到如下化学平衡:C(s) +H2O(g) ![]() CO(g) + H2(g);H= -Q(Q>0)。已知达到平衡(I)时,CO为0.12mol。试回答:
CO(g) + H2(g);H= -Q(Q>0)。已知达到平衡(I)时,CO为0.12mol。试回答:
(1)其他条件不变,若加入少量碳,则平衡移动情况是: ;
(2)若用υ(H2O)表示该反应前20s内的平均速率,则υ(H2O)= ;
(3)若在上述平衡混合物中加入少量Na2O固体,并在此温度下再次达到新的平衡(II),则平衡时H2的物质的量 (填“增大”、“减小”、“不变”)。理由是:
。
(4)若向上述平衡(I)的混合物中再充入a mol H2( a < 0.12 ),在相同条件下达到新的平衡(III),此时,CO的物质的量n的取值范围是 。
29.(6分)针对齐齐哈尔第二制药有限公司(以下简称齐二药)生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭一事,药品安全问题引起人们的关注。“亮菌甲素”结构简式如右图,是黄色或橙黄色结晶粉末,几乎不溶于水,辅料丙二醇(C3H8O2)溶成针剂用于临床。该药为利胆解痉药,适用于急性胆囊炎、慢性胆囊炎急性发作及慢性浅表性胃炎等。
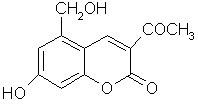
(1) 写出“亮菌甲素”的分子式_______________________
(2) 该物质每摩尔最多能和_______________mol H2发生加成.
(3) 写出“亮菌甲素”和NaOH溶液完全反应化学反应式
30.(9分)2004年是俄国化学家马尔柯失尼柯夫(V·V·Markovnikov,1838—1904)
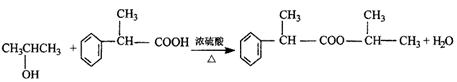
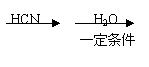
逝世100周年。马尔柯失尼柯夫提出碳碳双键的加成规则而闻名于世,该规则是指不对称的烯烃与HX或HCN加成时,氢总是加到含氢较多的双键碳原子上。
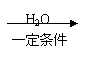 已知:CH3CH2CN
CH3CH2COOH。
已知:CH3CH2CN
CH3CH2COOH。
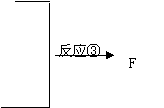
以下是某有机物F的合成路线,请填写下列空白。
 | |||
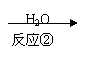 | |||
 CH3CH=CH2
A
B
CH3CH=CH2
A
B
| |||
 | |||
—CH=CH2 C D
(1)写出下列物质的结构简式A ,
C 。
(2)反应①的反应类型是 ,反应②的反应类型是 。
C 。
(2)反应①的反应类型是 ,反应②的反应类型是 。
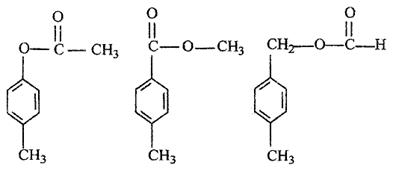
(3)写出③的化学方程式 。
(4)写出与D互为同分异构体、结构中含有苯环且苯环上含有一个甲基(苯环上的到代基处于对位)的酯类的结构简式)
。
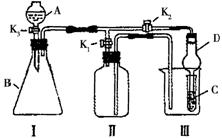 31.(7分)某兴趣小组同学共同设置了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质。请回答下列问题:
31.(7分)某兴趣小组同学共同设置了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质。请回答下列问题:
(1)利用装置I制取气体,生成气体的反应应具备的条件是______________________________________;
(2)利用Ⅰ、Ⅱ装置制取气体(K2关闭,K1打开)。
甲同学认为:利用Ⅱ装置可以收集H2、NH3等气体,但不能收集O2和NO等气体.其理由是:
_____________________________________________________________________________
_____________________________________________________________________________;
乙同学认为:利用Ⅱ装置作简易改进(不改变仪器装置),也可收集O2和NO等气体,但不能收集NO2气体,改进的方法是_______________________,利用Ⅱ装置再作简易改进(不改变仪器装置),也可收集NO2气体,改进的方法是__________________________;
(3)利用I、Ⅲ装置验证物质的性质(K2打开,K1关闭)。
如设计实验证明氧化性:KMnO4>Cl2>Br2.则在A中加浓盐酸,B中加___________,
C中加______________,观察到C中的现象是_____________________________。
化学试卷答案
一、选择题答案卷
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
|
| 答案 | D | A | A | B | D | B | D | A | D | D | D | D |
|
| 题号 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 |
| 答案 | B | C | D | B | D | B | A | B | A | C | C | D | C |
二、填空题
26.(共12分)
(1)①沸腾炉(1分) 吸收塔(1分)
②点燃或光照(2分)

![]() ③4FeS2+11O2 2Fe2O3+8SO2(2分)
③4FeS2+11O2 2Fe2O3+8SO2(2分)
(2)①离子键,共价键(2分)
②2A1+2OH-+2H2O=2A1O-2+3H2↑(2分)
③4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-906.8kJ·mol-1(2分)
27.(共8分)
(1)N ![]() (各1分)
(各1分)
![]() (2)Cl2 + H2O2 2HCl + O2↑或HClO + H2O2
= HCl + O2↑+ H2O(2分)
(2)Cl2 + H2O2 2HCl + O2↑或HClO + H2O2
= HCl + O2↑+ H2O(2分)
(3)NH4NO3 HNO3 (各1分)(4)>(1分)
C(NH4+)>C(Cl-)>C(OH-)>C(H+)(2分)
28.(8分)
(1) 不移动(2分)
(2)0.003mol/L·S (2分)
(3)减小(1分),Na2O与水反应,使水蒸气浓度降低,平衡向左移动(1分)。
(4)(0.12—a)< n < 0.12 (2分)
29.(6分)
(1)C12H10O5 (2分)
(2)5mol (2分)
(3) 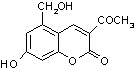 +3NaOH
+3NaOH ![]()
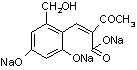 +2H2O (2分)
+2H2O (2分)
![]() 30.(9分)
30.(9分)
![]()
![]() (1)CH3CHCH3,
—CH—CH3 (每空1分,共2分)
(1)CH3CHCH3,
—CH—CH3 (每空1分,共2分)
(2)加成反应,水解反应(或取代反应)(每空1分,共2分)
(3)(2分)
|
(4)(每个1分,共3分,多写倒扣分)
|
31.(7分)
(1)固十液反应(或液+液反应) 反应不需加热(1分)
(2)氧气的密度比空气大,NO与空气的密度相差不大,同时N0能与氧气反应(1分) 将Ⅱ装置中加满水(1分) 将Ⅱ装置中加满难挥发的有机溶剂(1分)
(3)KMnO4固体;NaBr溶液;溶液呈橙色(每空1分,3分)