高考化学规范练习八
第Ⅰ卷(选择题 共64分)
一、选择题:(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1、2005年3月29日京沪高速淮安段发生一起特大交通事故,一辆载有液氯的铁罐车因轮胎爆炸造成大量液氯泄漏,给当地居民的生活和环境造成严重污染。下列有关说法合理的是
A、液氯泄漏将当地大片庄稼熏黄,这是由于Cl2的漂白性所致
B、泄漏的液氯应该用大量碱液中和
C、液氯泄漏后立即挥发成氯气而扩散到空气中,所以事故现场不必进行特别的处理
D、这次事故说明液氯不能用铁罐盛装
2、可持续发展是我国的既定方针。但随着现代工业不断发展,环境污染愈来愈影响人类社会的可持续发展。下列有关环境污染及防治的说法正确的是
A、日常使用的含磷洗涤剂会对水体造成污染,使水的物理、化学性质发生变化
B、《关于消耗臭氧层物质的蒙特利尔议定书》等国际公约的主要内容是要求各国减少并逐步停止氮氧化物等的生产和使用,以保护臭氧层
C、不使用矿石燃料是减少大气污染的唯一方法
D、我国目前计入空气污染指数(Air Pollution Index,简称API)的项目暂定为:二氧化硫、二氧化氮和可吸入颗粒物等
3. “耐高温长寿命抗氧化陶瓷基复合材料应用技术”获2004年度国家技术发明奖一等奖。该复合材料的强度比钢还大,在航空航天器中用来替代金属材料,可节约20%~30%的燃料。下列关于该材料的叙述中不正确的是
A.该材料属于新型无机非金属材料 B.该材料的化学性质非常稳定
C.与金属一样有较好的传热性能 D.可以替代金属做耐高温结构材料
4.超临界流体(Supercritical Fluid)是物质介于气态和液态之间的一种新的状态。超临界二氧化碳可作为溶剂、发泡剂取代某些有机溶剂、氟利昂等。下列有关说法中不正确的是
A.超临界二氧化碳与其气态或液态之间的转化是物理变化
B.超临界二氧化碳的形成,引起二氧化碳化学性质的改变
C.用超临界二氧化碳替代氟利昂可减轻对臭氧层的破坏
D.超临界二氧化碳可用于中药、香料中有效成分的提取
5.下列叙述正确的是
A.无论哪一种晶体中,只要存在阳离子就一定存在阴离子
B.二氧化硅是原子间通过非极性共价键形成的原子晶体
C.冰是水分子间通过氢键作用有规则排列成的分子晶体
D.熔融的氯化钠能导电是因为其粒子间存在离子键
6.设NA表示阿伏加德罗常数值,下列说法中正确的是( )
A.1mol某气体的体积为22.4L,该气体的状况不一定是标准状况
B.1 mol苯分子中含有的碳碳双键数为3NA
C.1molCl2参加化学反应获得的电子数都是2NA
D.将1molNO2气体在降温后颜色变浅,但其所含的分子数仍然为NA
7、在给定的条件下,下列加点的物质在化学反应中能被完全消耗的是
A、用浓盐酸与足量的二氧化锰共热制氯气
B、标准状况下,将1g铝片投入20mL18mol/L的硫酸中
C、向100mL3mol/L的硝酸中加入5.6g铁
D、在5×107Pa、500℃和铁触媒催化剂的条件下,用氮气和氢气合成氨
8、某溶液中含有CH3COO-、SO42-、SO32-、HCO3-、CO32-等五种离子。将过量的Na2O2固体加入其中后,仍能大量存在的离子是
A、CH3COO-、SO42-、CO32- B、SO42-、SO32-、CO32-
C、SO32-、HCO3- D、CH3COO-、SO42-、HCO3-
二、选择题(本题包括8小题,每小题4分,共32分;每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为O分,若正确答案包括两个选项,只选一个且正确得2分,多选、错选均不得分)
 9.2005年禽流感在全球蔓延,百姓谈“禽”色变。目前通过从香料八角中提取的莽草酸制得的达菲是抗禽流感病毒特效药物。下列有关描述正确的是
9.2005年禽流感在全球蔓延,百姓谈“禽”色变。目前通过从香料八角中提取的莽草酸制得的达菲是抗禽流感病毒特效药物。下列有关描述正确的是
A.高温、紫外线都能使禽流感病毒失去生理活性
B.莽草酸既能与H2发生加成,又能与FeCl3溶液反应显紫色
C.莽草酸、达菲都能使溴水或酸性KMnO4溶液褪色
D.1mol达菲与NaOH溶液反应,消耗NaOH的物质的量最多为4mol
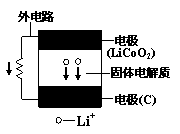 10.某新型二次锂离子电池结构如右图,电池内部是固体电解质,充电、放电时允许Li+在其间通过(图中电池内部“→”表示放电时Li+的迁移方向)。充电、放电时总反应可表示为:
10.某新型二次锂离子电池结构如右图,电池内部是固体电解质,充电、放电时允许Li+在其间通过(图中电池内部“→”表示放电时Li+的迁移方向)。充电、放电时总反应可表示为:
LiCoO2+6C ![]() Li1-xCoO2+LixC6
Li1-xCoO2+LixC6
下列说法正确的是
A.外电路上的“→”,表示放电时的电流方向
B.充电时阴极电极反应:LixC6-xe-=6C+xLi+
C.放电时负极电极反应:LiCoO2-xe-=Li1-xCoO2+xLi+
D.外电路有0.1mole-通过,发生迁移的Li+的质量为0.7g
11.用物质的量都是0.1molHCN和NaCN混合后配成1L溶液, 已知溶液中:
c(CN-)<c(Na+), 则下列关系式正确的是为
A.c(OH-)<c(H+) B.c(HCN)<c(CN-)
C.c(OH-)+c(CN-)=0.1mol/L D.c(CN-)+c(HCN)=0.2mol/L
12.下列离子方程式正确的是
A.澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+=Ca2++2H2O
B.氯气与水的反应 Cl2+H2O=2H++ClO-+Cl-
C.铜片插入硝酸银溶液中 Cu+2Ag+=Cu2++2Ag
D.碳酸氢铵溶液与足量烧碱溶液反应 HCO3-+OH-=CO32-+H2O
13.某密闭容器中发生如下反应:X(g)+3Y(g)![]() 2Z(g);ΔH<0
2Z(g);ΔH<0
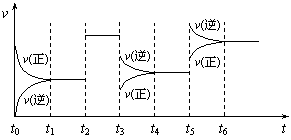 |
上图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
A.t2时加入了催化剂 B.t3时降低了温度
C.t5时增大了压强 D.t4~t5时间内转化率最低
![]()
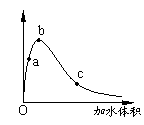 14.一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示,下列说法正确的是
14.一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示,下列说法正确的是
A.a、b、c三点溶液的pH:c<a<b
B.a、b、c三点醋酸的电离程度:a<b<c
C.用湿润的pH试纸测量a处溶液的pH,测量结果偏小
D.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<b
15.某温度下,在一容积可变的容器里,反应2A(g) ![]() B(g) + 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol、4mol。在保持温度和压强不变的条件下,下列说法正确的是
B(g) + 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol、4mol。在保持温度和压强不变的条件下,下列说法正确的是
A.充入1mol稀有气体氦(He),平衡将向正反应方向移动
B.充入A、B、C各1mol,平衡将向正反应方向移动
C.将A、B、C各物质的量都减半,C的百分含量不变
D.加入一定量的A气体达平衡后,C的百分含量一定增加
16.一定条件下CuS与稀HNO3发生反应,所得还原产物为NO,氧化产物为SO42—。现将0.06molCuS加入到50mL4.2mol/LHNO3中,充分反应之后,忽略溶液体积变化,下列说法正确的是
A.被还原的硝酸为0.16mol B.反应后溶液中仍有硝酸剩余
C.反应后溶液的pH=1 D.CuS未全部参加反应
第Ⅱ卷(非选择题 共86分)
三、(本题包括2小题,共22分)
17.(6分)某未知溶液X中可能含有K+、Fe2+、NH4+、Cl-。检验其中是否含有K+,通常有如下两套实验方案。
方案一:焰色反应法
用洁净的玻璃棒蘸取未知液X置于酒精灯外焰上灼烧,观察到火焰呈黄色,则证明其中不含K+。对上述实验过程中的错误和疏漏之处加以纠正、补充:
、 。
方案二:亚硝酸钴钠法
在CH3COOH酸化的溶液中,K+与亚硝酸钴钠[Na3Co(NO2)6]反应生成黄色沉淀[K2NaCo(NO2)6],该原理可用于K+的检验。注意:NH4+也能与Na3Co(NO2)6生成黄色沉淀,会干扰K+离子的检验。
请你利用上述反应原理设计一个实验方案,检验未知溶液X中是否含有K+。
18.(16分)某研究性学习小组的同学为在实验室再现二氧化硫催化氧化的过程,并制取少量三氧化硫晶体,设计了如图所示的装置。已知三氧化硫遇水生成硫酸并放出大量热,容易形成酸雾。试回答:
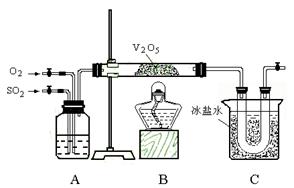
(1)已知6.4 g 二氧化硫被氧气氧化成气态三氧化硫,放出9.83 kJ热量。反应的热化学方程式为________________________________。
(2)A装置可用来观察二氧化硫和氧气的进气量。实验时使A中氧气导管冒出的气泡与二氧化硫导管冒出的气泡速率相近,其目的是___________________________,A中的药品是__________________________。
(3)检查完装置的气密性且加入药品后,开始进行实验。此时首先应该进行的操作是________________________________;在实验过程中不能持续加热的理由是____________________________________。
(4)若用a g铜跟足量浓硫酸反应制二氧化硫,实验结束时得到b g 三氧化硫,该实验中二氧化硫的转化率不小于____________。
(5)老师说该实验装置设计不完整,你认为还缺少 装置,请你协助该研究小组设计出所缺装置_______________________________________(用简要文字回答)。
四.(本题包括2小题,共18分)
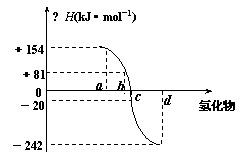 19.(6分)已知:在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H)。右图为氧族元素氢化物a、b、c、d的生成热数据示意图。试回答下列问题:
19.(6分)已知:在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H)。右图为氧族元素氢化物a、b、c、d的生成热数据示意图。试回答下列问题:
⑴写出氧族元素中含有18e-的两种氢化物的电子式 。
⑵请你归纳:非金属元素氢化物的稳定性与氢化物的反应热△H的关系
。
⑶写出硒化氢在热力学标准态下,发生分解反应的热化学反应方程式: 。
20.(12分)下图表示各物质之间的转化关系,其中A、B、C、G为单质。②为工业生产中常见反应,E是一种具有漂白作用的盐,Y易潮解,M是一种两性化合物,L是一种白色沉淀。
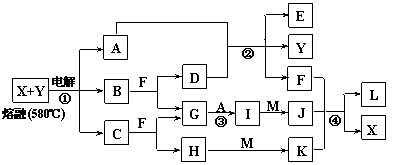
试回答下列有关问题:
⑴M的化学式 ,Y在实验室中的用途 (列举一例)。
⑵X的熔点为801℃,实际工业冶炼中常常加入一定量的Y共熔,猜想工业上这样做的目的: 。工业生产中,还常常利用电解X和F的混合物制取 。
⑶反应②的化学方程式是_______________________ ______________________。
⑷反应④的离子反应方程式是 。
五、(本题包括1小题,共10分)
21.(10分)下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | | ||||||
| 2 | ‚ | ƒ | „ | … | |||
| 3 | † | ‡ | ˆ | ‰ |
(1)上述元素中,单质可以导电的有: 。(填写编号)
(2)⑦和⑤构成的固态化合物是 晶体。若该晶体中含n mol⑦,则其中所含极性共价键为 mol。
(3)列举事实用离子方程式说明⑨的非金属性强于⑧: 。
(4)除同族元素外,某些不同族元素的性质也有一定的相似性,如元素③与元素⑥的氢氧化物有相似的性质。试写出元素③的氢氧化物与NaOH溶液反应的化学方程式
六.本题包括2小题,共18分
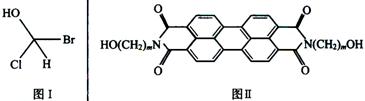 22.(8分)已知:①在有机物结构里,只要有一个碳原子连接四个互不相同的原子或原子团,(如图Ⅰ)这类物质就具有光学活性;②军事上的“地表伪装”是使军事保护设施的外观色彩红外反射与环境吻合,HAST是70年代开发的新型红外伪装还原染料,其化学结构式如图Ⅱ,该染料为橄榄色或黑色。
22.(8分)已知:①在有机物结构里,只要有一个碳原子连接四个互不相同的原子或原子团,(如图Ⅰ)这类物质就具有光学活性;②军事上的“地表伪装”是使军事保护设施的外观色彩红外反射与环境吻合,HAST是70年代开发的新型红外伪装还原染料,其化学结构式如图Ⅱ,该染料为橄榄色或黑色。
请回答:
(1)1摩尔该物质与足量金属钠反应,产生氢气的物质的量是________。
(2)当m=5时,碳原子上一个氢原子被氯取代生成的一氯代物可能有_______种同分异构体。在这些氯代物中,具有光学活性的物质有________种。
(3)当m=1时,该物质的分子式为_______________。
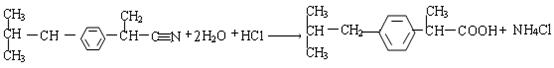
23.(10分)芬必得是一种高效的消炎药物,其主要成分为布洛芬,它有多种合成路线,下面是一种合成方法。
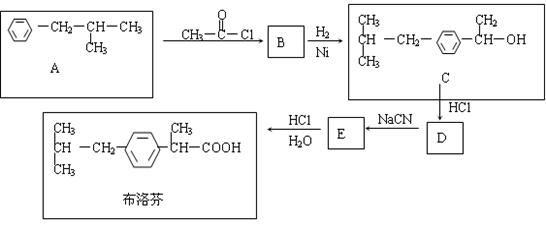
已知:卤代烃有如下反应:R-Cl+NaCN![]() R-C
R-C![]() N+
N+![]() 回答下列问题,
回答下列问题,
(1)写出有机物B、D的结构简式:
B ;D 。
(2)写出反应A![]() B和B
B和B![]() C的反应类型
、
(可供选择的反应类型有:取代,加成,消去,加聚,缩聚)
C的反应类型
、
(可供选择的反应类型有:取代,加成,消去,加聚,缩聚)
(3)有机物C和苯酚的关系是 (选填字母)
A、互为同分异构体 B、互为同系物
C、均属于芳香醇类 D、均属于芳香族化合物
(4)与A具有相同的分子式,且苯环上只有一个取代基的有机物共有四种,写出除A外的其余三种的结构简式。
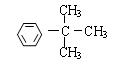
; ; 。
(5)写出E![]() 布洛芬反应的化学方程式(要求配平,有机物要用结构简式表示)
布洛芬反应的化学方程式(要求配平,有机物要用结构简式表示)
七、(本题包括两小题,共18分)
24、(8分)有硫酸钠和碳酸镁的混合物,用40mL 盐酸完全溶解后,在标准状况下收集到0.448L二氧化碳。向反应后的溶液中加入含有0.025mol氢氧化钡的溶液,可得到5.82g沉淀,此时溶液的pH=12,体积为200mL。试求:
(1)原混合物中MgCO3的质量
(2)得到的沉淀中硫酸钡的质量
(3)盐酸的物质的量浓度
25.(10分)某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为45.3g的该结晶水合物,分别制成溶液。向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24L该气体(标准状况);最后白色沉淀逐渐减少并最终消失。另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6 g。
请回答以下问题:
⑴ 该结晶水合物中含有的两种阳离子是________和________,阴离子是_________。
⑵ 试通过计算确定该结晶水合物的化学式。
⑶假设过程中向该溶液中加入的NaOH溶液的物质的量浓度为5mol·L-1,请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。
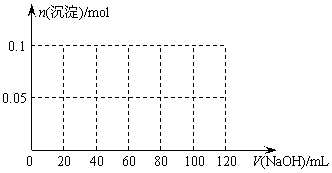
24.氢气还原氧化铜的反应不完全时,便得到Cu、Cu2O、CuO的固体混合物。化学兴趣小组同学为探究上述固体的成分进行了如下操作和实验:
(1)取一定质量的均匀固体混合物A,将其分成两等份。
(2)取其中—份用足量的氢气还原,测得反应后固体质量减少3.20g。
(3)另一份加入500mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体 2.24L。
请回答以下问题:
(1)A中,n(Cu)+n(Cu2O)= 。
(2)A中,n(CuO)的取值范围是 。
(3)试计算所用稀硝酸的物质的量浓度。
24、(1) n(Cu)+n(Cu2O)=0.300mol (2)0.1mol<n(CuO)<0.4mol
(3)(5分)设其中一份中n(Cu)= x mol,n(Cu2O)= y mol,n(CuO)= z mol,
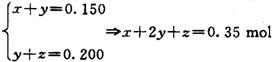
依得失电子守恒和氧元素守恒,有:
亦即反应后生成的硝酸铜的物质的量为0.350mol
则500mL稀硝酸中,n(HNO3)=0.350mol×2+0.100mol=0.800mol)
于是:c(HNO3)=0.800mol/0.500L=1.6mol/L
参考答案
1.B2.D3.C4.B5.C6.A7.C8.A9.AC10.CD11.D12.C13.A14.BC15.AC16.AB
17.(6分)应使用铂丝或无锈铁丝蘸取溶液(2分) 应透过蓝色钴玻璃观察(2分)
向未知溶液X中加入稍过量的NaOH溶液并加热;静置、冷却后取上层清液少许;用醋酸酸化后再加入亚硝酸钴钠,观察是否有黄色沉淀生成。(或者取未知液X蒸干并灼烧,将所得固体溶于水,过滤;取少量滤液,用醋酸酸化后再加入亚硝酸钴钠,观察是否有黄色沉淀生成。)(2分)
18.(1)SO2(g)+![]() O2(g)= SO3(g);ΔH=-98.3kJ/mol (2)提高二氧化硫的转化率 浓H2SO4 (3)给催化剂加热 防止温度过高,降低SO2转化率及催化剂活性
O2(g)= SO3(g);ΔH=-98.3kJ/mol (2)提高二氧化硫的转化率 浓H2SO4 (3)给催化剂加热 防止温度过高,降低SO2转化率及催化剂活性
(4)![]() 或
或![]() ×100%
(5)二氧化硫的尾气处理 将尾气通入盛有浓硫酸的洗气瓶后,再通入盛有氢氧化钠溶液的洗气瓶(或通入盛有足量碱石灰的干燥管等,只要保证SO2和SO3不污染环境,SO3不与空气中的水接触的合理方案均给分)(每空2分,共16分)
×100%
(5)二氧化硫的尾气处理 将尾气通入盛有浓硫酸的洗气瓶后,再通入盛有氢氧化钠溶液的洗气瓶(或通入盛有足量碱石灰的干燥管等,只要保证SO2和SO3不污染环境,SO3不与空气中的水接触的合理方案均给分)(每空2分,共16分)
19.(6分)⑴![]()
⑵非金属元素氢化物越稳定,△H越小,反之亦然
⑶H2Se(g)=Se(s)+H2(g);△H=-81kJ/mol(每空2分,共6分)
20.(12分)⑴Al2O3 用作干燥剂 ⑵降低X、Y熔化时的温度,节约能源 Cl2、H2和NaOH
⑶2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
⑷Al3++3AlO2-+6H2O=4Al(OH)3↓(每空2分,共12分)
21.(1)②③⑥⑦(2)原子4n (3)Cl2+S2-=2Cl-+S
(4)Be(OH)2+2NaOH = Na2BeO2+2H2O
22.(l)1mol (2)7 5 (3)C26H14O6N2
23.(1)
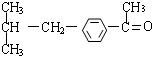
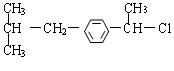
(2)取代 加成
(3) D
(4)
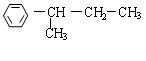
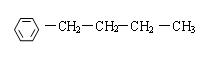
(5)
24、(8分)
(1)m(MgCO3)= ×84 = 1.68 g(2分)
(2)m(BaSO4)= 5.82 - ×58 = 4.66g(2分)
(3)由电荷守恒,反应后溶液中 n(Na+) + 2 n(Ba2+) = n(Cl-) + n(OH-)
可求得 n(Cl-) = 0.048mol(2分) c(HCl)=1.2 mol·L-1(2分)
(其它解法只要合理均可得分)
25.⑴NH4+ Al3+ SO42- (3分)
⑵n(SO42—)=![]() =0.2mol
=0.2mol
n(NH4+)=![]() =0.1 mol
=0.1 mol
根据离子化合物中阴、阳离子电荷平衡的原理:n(NH4+)+3n(Al3+)=2n(SO42—)可得:
n(Al3+)=![]() (2×0.2mol-0.1 mol)=0.1 mol
(2×0.2mol-0.1 mol)=0.1 mol
n(H2O)=![]() =1.2mol
=1.2mol
该结晶水合物的化学式为NH4 Al (SO4)2·12H2O [或(NH4)2SO4·Al2(SO4)3·24H2O]
(5分)
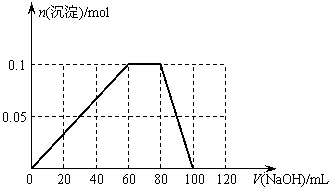 ⑶
⑶
