氮元素单质和化合物
教学目标
知识技能:通过对氮元素单质和化合物“结构—性质—应用”及“性质—存在—制备”关系的复习,认识非金属元素单质和化合物“结构—性质—应用”及“性质—存在—制备”的依存关系。
能力培养:通过对氮元素单质和化合物“结构—性质—应用”及“性质—存在—制备”关系的分析与讨论,训练学生对已有知识进行分析综合、归纳演绎的逻辑思维能力;通过对非金属元素单质和化合物“结构—性质—应用”及“性质—存在—制备”依存关系的探索,培养学生应用已有的化学概念和原理认识新事物的能力以及设计实验的能力。
科学思想:通过对氮元素单质和化合物“结构—性质—应用”及“性质—存在—制备”关系的认识,使学生更加热爱科学、相信科学和崇尚科学,感悟到科学的魅力。
科学品质:通过对非金属元素单质和化合物“结构—性质—应用”及“性质—存在—制备”依存关系的逐步认识,激发学生的学习兴趣,培养学生严谨求实的优良品质。
科学方法:通过对非金属元素单质和化合物“结构—性质—应用”及“性质—存在—制备”依存关系的研究,指导学生用模型或假说的方法进行化学学科研究,学习对事物的现象与本质进行转化以及科学抽象的研究方法。
重点、难点 认识非金属元素单质和化合物“结构—性质—应用”及“性质—存在—制备”的依存关系。培养学生分析综合、归纳演绎的逻辑思维能力。激发学生的学习兴趣,培养学生严谨求实的优良品质,使学生感悟到科学的魅力。指导学生用模型或假说的方法进行化学学科研究,学习对事物的现象与本质进行转化以及科学抽象的研究方法。
教师活动
教师活动
【复习提问】请你按下表要求填入你所知道的含有氮元素的物质的化学式:
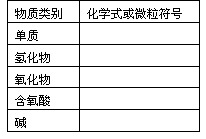
学生活动
再现、讨论后得到:
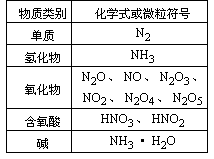

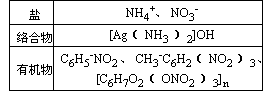
【引入】这节课我们以氮元素单质和化合物为例,复习非金属元素单质和化合物“结构—性质—应用”及“性质—存在—制备”之间的依存关系。
【板书】
一、“结构—性质—应用”的依存关系
【提问】你能否根据已有的元素化合物知识,列出上表中各物质之间的转化关系?
【要求】在建立氮元素单质化合物联系的基础上,确认物质之间的转化关系并熟练地书写能反映这些转化关系的化学方程式。
再现、讨论并逐步完善后得到:
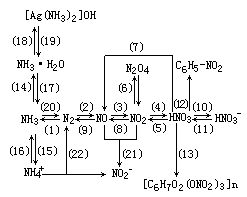
【投影】请用上述转化关系中物质结构和性质方面的知识,探讨解决下列化学问题的方法和途径:
1.氮气约占空气体积的4/5,为什么金属镁在空气中燃烧,主要生成氧化镁?
2.“等电子体”之间具有某些相似的化学性质。化学家还常用“等电子体”来预测某些物质的结构,例如:NH4+、CH4之间即为“等电子体”的关系,请你分析一下具备什么条件,方可称为“等电子体”?
(讨论时引导学生从组成、构成与结构方面进行分析)
3.当前城市空气质量恶劣的重要原因是汽车尾气的超标排放,你能否应用氮元素单质和化合物之间的转化关系,设计除去汽车尾气中的CO和氮氧化物(如NO、NO2等)的理论构想?其中包括:确定无害化过程及其产物和选择无害化试剂及反应条件等。
【思考】
(1)将有害物质转化为什么物质即可完成无害化过程?
(2)应依据什么化学原理完成无害化过程?
(3)完成无害化过程中,无害化试剂的选择原则是什么?
(4)对无害化过程反应条件的确定原则是什么?
(5)写出无害化过程的化学方程式。
思考后回答:性质方面的原因是:氧气的氧化性强于氮气;结构方面的原因是:氮分子中氮原子间具有三条共价键。
思考分析:互为“等电子体”应满足的条件是:
(1)在微粒的组成上:微粒所含原子数目相同;
(2)在微粒的构成上:微粒所含电子数目相同;
(3)在微粒的结构上:微粒中原子的空间排列方式相同。
讨论并确定:
(1)无害化过程应为:
①CO→CO2;
②NO→N2;
③NO2、N2。
(2)分析:对①应加入氧化剂;对②、③应加入还原剂。
(3)讨论:选择氧化剂和还原剂的原则:
①尾气中的其他成分;
②无毒无害、成本适度的其他物质。
(4)对反应条件进行选择:
①反应条件最好应为常温、常压。
②对常温、常压不能进行的反应,应适当地选择催化剂,使其在常温、常压下进行。
(5)经反复探讨确定下列理论构想:
①2CO+2NO ![]() 2CO2+N2;
2CO2+N2;
(选NO是因为:它是初级有害物质)
②6NO+4NH3 ![]() 6H2O+5N2;
6H2O+5N2;
③6NO2+8NH3 ![]() 12H2O+7N2。
12H2O+7N2。

4.硝酸与金属反应的还原产物与硝酸的浓度和金属的活泼性有密切的关系,可以是N2O、NO2(N2O4)等,又已知这些氮氧化物均可与铜发生反应:
![]()
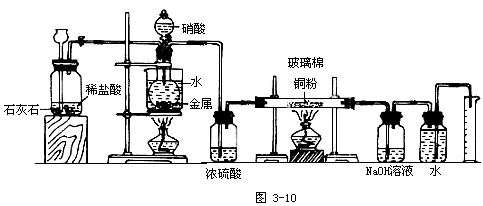
你能否设计一个可以确定硝酸与金属反应的还原产物的实验装置模型?
【设问】此装置系统应包含几个大部分?
思考回答:应该包含三个大部分——金属与硝酸反应的部分、氮氧化物与铜反应的部分和氮气体积的确定部分。
【追问】根据金属与硝酸反应物的状态及反应条件,应选择何种装置?
若反应速率太小,应采取什么对策?
应选择固-液反应的装置。
给反应容器加热。
加热应考虑什么因素?选择什么方式?
加热应防止硝酸分解;所以,加热方式应是微热,如水浴加热。
如果反应产物中含有NO,你认为此装置的设计有没有问题,应该如何完善?
如果反应产物中含有NO,会与装置中空气里的氧气发生反应,导致测定结果错误。应该在金属与硝酸反应之前排净装置中的空气。
用什么方法排净空气?怎样改进装置的设计?
可以用CO2排净装置中的空气,在金属与硝酸反应的装置前添加一个CO2发生器。
根据金属与硝酸反应的反应物的性质及反应条件,判断产物气体的成分除氮的氧化物以外还可能有什么?其对后续反应有无干扰?应如何净化?净化装置的位置是什么?
还可能有水蒸气和CO2。水蒸气的存在可能干扰氮氧化物与铜的反应(如:NO2与H2O反应生成HNO3,HNO3会和Cu反应,再生成氮氧化物);CO2的存在可能使氮气体积的测量产生误差。可以用浓硫酸干燥除去水蒸气,其装置应放在氮氧化物与铜的反应的装置之前;用NaOH溶液除去CO2,其装置放在氮气体积测量的装置之前。
选择什么装置完成氮氧化物与铜的反应?
用加热的硬质试管。
铜选择什么形态?原因何在?怎样防止铜粉被气流扬起?
用铜粉,反应接触面积大,使氮氧化物与铜的反应更为完全。在硬质试管两端填入玻璃棉。
如何测量N2的体积?
用量气装置。
师生共同探讨后确定下列实验装置模型:
【引导】通过上述化学问题的探讨,能否归纳“结构—性质—应用”的依存关系?
归纳:
![]()
【过渡】不仅“结构—性质—应用”有这样的依存关系,而且“性质—存在—制备”也有依存关系。
【板书】二、“性质—存在—制备”依存关系
【投影】请用物质结构和性质方面的知识,探讨解决下列化学问题的方法和途径:
1.空气的成分在一定时期内基本上是固定不变的。其中N2与O2含量基本稳定的实质是否相同?
(讨论中引导学生联系其它学科的知识内容)
讨论后回答:实质是不同的。N2是由于分子中三个共价键,结构稳定,导致性质稳定,通常不易与其他物质发生化学反应的缘故;O2是化学性质比较活泼的物质,其在通常状况下,也可与许多物质发生反应。而自然界的一些其他变化中又可产生O2,如光合作用等。在自然界O2的消耗速率和O2的生成速率大致相等,达成动态平衡,导致空气中O2的含量基本保持不变。
2.如果实验室想获得少量纯净的N2,有哪些可能的途径?
(提示学生用空气并不方便)。
思考后可提出三种方案:
![]()
![]()
用气体备气体,会使制得的气体不纯);
![]()
【讨论】在这些途径中,最可行的途径是哪一种?
讨论后得出结论:
![]()
铵盐。
![]()
NO2,而很少得到N2。
![]()
![]()
途径。
【追问】具体应选择什么物质之间的反应合适?
判断:
![]()
铵盐选择NH4Cl最保险(因为,如果为了提高反应速率需要加热,其受热分解的产物不复杂)。
![]()
酸盐,最简单的是NaNO2。
【追问】此反应的原料应是什么状态?
回答:应用溶液之间的反应,而不用固体之间的反应(防止在反应需要加热时铵盐分解)。
【介绍】实验室制取少量纯净的氮气,确实使用的是饱和NaNO2与NH4Cl之间的反应。此反应需加热,但反应开始后要立即移开酒精灯。请写出化学方程式(启发学生考虑此反应是放热反应)。
【设问】请从N2的结构和性质方面解释此反应为什么是放热反应?
思考并书写:
NaNO2+NH4Cl=NaCl+N2↑+2H2O+Q
【启发】通过以上化学问题的讨论与解决,你认为“性质”、“存在”、“制备”三方面有什么关系?
讨论并解释:生成N2时要形成三个共价键,所以N2的能量要低于NaNO2与NH4Cl,多余的能量以热的形式释放出来,所以,此反应为放热反应。
讨论后归纳:
![]()
【作业】北京练习册,化学总复习非金属部分的练习。
精选题
1.试应用“等电子体”的知识,写出下列微粒的“等电子体”的化学式______。
(1)N2H62+
(2)CO32-
(3)NO2+
(4)C2O42-
(5)N2
2.实验室用饱和NaNO2与NH4Cl溶液反应制取纯净的氮气,实验装置如图3-11所示:试回答:
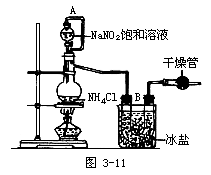
(1)装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是______(填写编号)。
A.防止NaNO2饱和溶液蒸发
B.保证实验装置不漏气
C.使NaNO2饱和溶液容易滴下
(2)B部分的作用是______。
A.冷凝
B.冷却氮气
C.缓冲氮气流
(3)加热前必须进行的一个操作步骤是______;加热片刻后,即应移去酒精灯,以防止反应物冲出,其原因是______。
(4)收集N2前必须进行的步骤是(用文字说明)______,收集最适宜的方法是(填写编号)______。
A.用排气法收集在集气瓶中
B.用排水法收集在集气瓶中
C.直接收集在排净空气的球胆或塑料袋中
3.实验室合成氨装置如右图所示:
试回答:
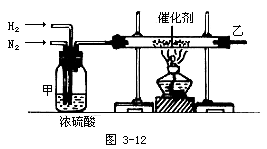
(1)装置甲的作用是:
①__________________________;
②__________________________;
③__________________________。
(2)从乙处导出的气体是______,检验产物的简单化学方法是_____________。
4.实验室用氨气还原氧化铜的方法测定铜的近似原子量,反应的化学方程式为:
3CuO+2NH3 ![]() N2+3Cu+3H2O
N2+3Cu+3H2O
(1)如果选用测定反应物CuO和生成物H2O的质量(mCuO、mH2O)的方法进行测定,请用如图3-13所示的仪器设计一个简单的实验方案,并回答下列问题:
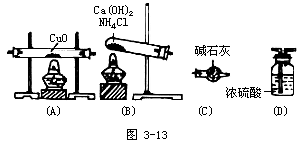
①仪器的连接顺序为______(用字母编号表示,仪器可重复使用)。(D)中浓硫酸的作用是______。实验完毕时,观察到(A)中的现象是______。
②列出计算Cu的原子量的表达式______________。
③下列情况使测定结果偏大的是______________。
A.CuO未全部还原为Cu
B.部分CuO受潮
C.CuO中混有Cu
D.部分CuO被还原为Cu2O
(2)如果仍采用上述仪器装置,其它方案可选用测定的物理量有________。
A.m(CuO)、m(Cu)
B.m(N2)、m(H2O)
C.m(Cu)、m(H2O)
D.m(H2O)、m(NH3)
答 案
1.(1)C2H6 (2)NO3-
(3)CO2 (4)N2O4 (5)CO或C22-
2.(1)C (2)A (3)检查系统的气密性;此反应为放热反应。(4)排净系统中的空气;C
3.(1)①干燥气体;②使两种气体充分混合;③观察气泡,以调节H2、N2的气流速度(注:只要求在三项中写出任意两项)。
(2)NH3、H2、N2的混合物;用蘸有浓盐酸的玻璃棒放在导管口,有白烟生成。
4.(1)①(B)(C)(A)(C)(D);吸收未反应的NH3,防止空气中的水蒸气进入(C)中;固体由黑色变为亮红色。
![]()
③A C D
(2)A C
