第3课时 物质的检验、分离和提纯(A卷)
考测点导航
1.物质的检验在中学通常有鉴定、鉴别和推断三类,检验物质包括气体、离子、有机物等。物质的检验需对物质的物理性质、化学性质、实验方法、实验现象、实验基本操作等知识综合运用才能解决,是考查学生实验能力的常见题型。解答物质检验题的方法可归纳为“取试样,加试剂,说操作,由现象,定结论”。
2、物质的鉴别
(1)不用任何试剂鉴别多种物质
①先依据外观特征,鉴别出其中的一种或几种,然后再利用它们去鉴别其他的几种物质;
②若均无明显外观特征,可考虑能否用加热或焰色反应区别开来;
③若以上两方法都不能鉴别时,可考虑两两混合法,记录混合后的反应现象,综合分析加以确定;
④若被鉴别物质为两种时,可考虑因试剂加入的顺序不同,现象不同而进行鉴别。
(2)只用一种试剂鉴别多种物质
可根据被鉴别多种物质的水溶性、密度、溶液酸碱性,利用“相反原理”确定试剂进行鉴别。
(3)任选试剂鉴别多种物质
3、混合物的分离与提纯
混合物的分离是指用物理化学方法将混合物中各组组分分开,并恢复到原状态,得到比较纯的物质。物质的提纯则只要将杂质除去即可。
(1)常见物质分离提纯的方法
①固—固混合分离型:灼烧、热分解、升华、结晶(或重结晶);
②固—液混合分离型:过滤、盐析、蒸发;
③液—液混合分离型:萃取、分液、蒸馏、渗析;
④气—气混合分离型:洗气。
对多组分的混合物的分离提纯,一般要考虑物理方法和化学方法综合运用。
(2)物质分离提纯的原则
①不能引入新的杂质,即不可“前门驱虎,后门进狼”。
②被提纯物质的量尽量不要减少,即不可“玉石俱焚”。
③实验过程和操作方法简单易行,即被提纯物质与杂质不可“难舍难分”。
典型题点击
1.(1996年上海高考题)下列各组溶液,只要用试管和胶头滴管,不用任何试剂就可以鉴别的是( )
A.KOH和Al2 (SO4)3 B.稀H2SO4和NaHCO3
C.CaCl2和Na2CO3 D.Ba(OH)2和NaHSO4
(该题是对不用任何试剂鉴别两种物质的考查。答题时由滴加顺序不同,表现的现象不同加以鉴别。)
2.(2000年全国高考题)提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法为( )
A.加入过量碳酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
B.加入过量硫酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
C.加入过量硫酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
D.加入过量碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
(此题运用已经学过的硝酸盐、硫酸盐、碳酸盐的知识灵活组成一个除杂的实验方法,考查学生评价选用的原则。答题时依据“除杂”不应引进新的杂质来分析。)
3.(2001年广东河南高考题)甲、乙、丙、丁分别是盐酸、碳酸钠、氯化钙、硝酸银4 种溶液中的一种。将它们两两混合后,观察到的现象是:①甲与乙或丙混合都产生沉淀;②丙与乙或丁混合也产生沉淀;③丁与乙混合产生无色气体。回答下面问题:
(1)写出丁与乙反应的离子方程式: 。
(2)这四种溶液分别是:甲: 、乙: 、丙: 、丁: 。
(此题是对多种物质进行推断的考查。答题时由两两混合反应的特征现象,综合分析加以确定。)
4.(2001年全国高考题)回答下面问题:
(l)分离沸点不同但又互溶的液体混合物,常用什么方法?
答 。
(2)在分液漏斗中用一种有机溶剂提取水溶液里的某物质时,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法。
答: 。
(本题考查蒸馏、分液基本实验方法的实际应用。答题时把握这两种液液分离方法的适用范围。)
新活题网站
1.为了从皂化反应后的混合物中分离出高级脂肪酸钠,正确的分离方法是( )
A.蒸馏 B.结晶 C.渗析 D.盐析
(该题主要考查物质的分离方法。答题时对物质分离的几种物理方法要注意区分。)
2.限用一种试剂即可区别Na2CO3、Na2SO3、Na2SiO3、Na2SO4、NaAlO2五种溶液。应选用的试剂可能是( )
A.盐酸 B.烧碱溶液 C.氨水 D.氯化钡溶液
(该题是对限用一种试剂鉴别多种物质考查。答题时依据“相反原理”确定试剂。)
3.下列各组溶液,不用其它试剂就可以将它们区别开的是( )
A.盐酸、氢氧化钾、硫酸钾、碳酸钾
B.硝酸银、盐酸、硝酸钠、氢氧化钠
C.氯化钡、氯化钙、硫酸钠、硝酸钾
D.氢氧化钠、碳酸钠、硫酸镁、硫酸氢钾
(此题是对不用任何试剂鉴别多种物质的考查。答题时由两两混合反应的特征现象,综合分析加以确定。)
4.只用水就能鉴别的一组物质是( )
A.苯、乙酸、四氯化碳 B.乙醇、乙醛、乙酸
C.乙醛、乙二醇、硝基苯 D.苯酚、乙醇、甘油
![]() (本题是限制条件鉴别物质的考查。答题时要依据题中特定的限制条件,利用物质的物理性质加以鉴别。)
(本题是限制条件鉴别物质的考查。答题时要依据题中特定的限制条件,利用物质的物理性质加以鉴别。)
5.化学工作者从C2H6(g)+Cl2(g) C2H5Cl(l)+HCl(g)受到启发,提出农药和有机合成工业上可获得副产品盐酸。这一设想已成为现实,试指出从上述反应产物中得到盐酸可能用到的最佳分离方案是( )
A.蒸馏法 B.水洗分液法
C.升华法 D.过滤法
 (该题是对物质分离方法的考查。选择分离方法首先要判断混合物的状态,然后进行确定。)
(该题是对物质分离方法的考查。选择分离方法首先要判断混合物的状态,然后进行确定。)
6.下表A~D各项中,在有乙与甲共存的情况下,用丙检验甲的存在,不能成功的是(不得使用加热、过滤、萃取等实验操作)
| 序号 | 甲 | 乙 | 丙 |
| A. | SO42- | SO32- | 稀盐酸、BaCl2溶液 |
| B. | I- | Cl- | AgNO3溶液 |
| C. | Fe2+ | Fe3+ | KSCN溶液 |
| D. | Al3+ | Ag+ | 稀氨水 |
(本题考查离子检验的方法。答题时依据离子的性质,排除可能的干扰。)
7.为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作:
①过滤,②加过量NaOH溶液,③加适量盐酸,④加过量Na2CO3溶液,⑤加过量BaCl2溶液。正确的操作顺序是( )
A.①④②⑤③ B.④①②⑤③
C.②⑤④①③ D.⑤②④①③
(该题是对粗盐提纯的考查。答题时要注意所加除杂试剂是过量的,泥沙和杂质离子产生的沉淀一起过滤,且不能引入新的杂质。)
8.贮气瓶中贮有有色气体,可能是由NO2、CH4、HCl、CO2、NH3、Br2(蒸气)等几种混合而成。进行如下实验:
(1)通少许于水中得无色溶液
(2)通少许于AgNO3溶液中有白色沉淀生成
(3) 通少许于澄清石灰水中,无浑浊现象
(4) 通过盛水的洗气瓶后,再通入澄清石灰水中,石灰水变浑浊。则
由(1)可判断一定存在 一定不存在 。
由(2)可判断一定存在 一定不存在 。由(3) (4)可判断一定存在 可能存在 。
(本题是对气体组成推断的考查。答题时要依据题中给定的实验现象,通过分析推理确定。)
9.昆虫能分泌信息素。下列是一种信息素的结构简式:CH3(CH2)5CH=CH(CH2)9CHO。指出该物质中的任意一种官能团,为该官能团提供一种简单的鉴别方法并简述实验现象,写出与鉴别方法有关反应的化学方程式并指出反应类别,完成下表。
| 官能团 | 鉴别方法及实验现象 | 有关反应的化学方程式 | 反应类别 |
(本题是对有机物官能团鉴别的考查。答题时要依据题中给出的有机物的结构,找出官能团,确定鉴别方法。)
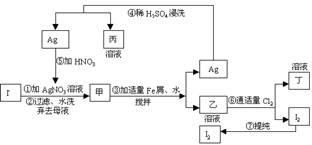
10.在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采用下面的工艺流程生产单质碘:
试回答:(1)乙、丁中溶质的分子式:乙 ,丁 。
(2)第④步操作中用稀H2SO4浸洗的目的是 (填写字母编号)a.除去未反应的NO3- b.除去未反应的I-
c.除去未反应的Fe d. 除去碱性物质
(3)第⑦步操作可供提纯的I2两种方法是 和
(不要求写具体步骤)。
(4)实验室检验I2 的方法是 。
(5)甲物质见光易变黑,其原因是(用化学方程式表示)
。
(此题以生产单质碘的工艺流程为背景,综合考查了物质的推断、检验、除杂、分离与提纯等方面的知识。答题时要根据物质的性质,利用特征反应,分析推理确定。)
11.Cu+在酸性溶液中不稳定,可发生自身氧化还原反应生成Cu2+和Cu。现有浓硫酸、浓硝酸、稀硫酸、稀硝酸、FeCl3稀溶液及pH试纸,而没有其它试剂。简述如何用最简便的实验方法来检验CuO经氢气还原所得到的红色产物中是否含有碱性氧化物Cu2O。
(该题考查学生运用新信息、调用和迁移旧知识来解决具体问题的能力,设计简单实验的能力以及文字表达能力。答题时要理解和运用提示的新知识,结合旧知识加以确认。)