第3课时 物质的检验、分离和提纯(B卷)
易错现象
1.对具体物质的性质记忆不清,造成实验现象的判断与叙述不准确。
2.物质的提纯与分离是两种不同的要求,易于混淆。用于提纯和分离的物理方法难以辨别。
3.进行物质的除杂与提纯时,步骤多、耗用药品多、难以分离、引入新的杂质等,不是最佳方案,甚至是错误方案。
4.解答物质推断题时,对题中隐含的干扰因素(如具有相同性质、产生相同现象等)难以排除。
纠错训练
1. 可用于分离或提纯物质的方法有:
(A)分馏 (B)盐折 (C)过滤 (D)重结晶 (E)升华 (F)渗析 (G)电解 (H)加热分解 (I)蒸馏
下列各组混合物的分离或提纯应选用上述哪一种方法最合适?(把选用的方法的标号填入括号内)
(1)除去Ca (OH)2溶液中悬浮的CaCO3微粒。( )
(2)除去Fe (OH)3胶体中混有的Cl-离子。( )
(3)除去乙醇中溶解的微量食盐。( )
(4)分离石油中各种不同沸点范围的成分。( )
(5)除去固体碘中混有的少量碘化钠。( )
(6)除去氧化钙中的碳酸钙。( )
![]()
![]() 2.下列结论可靠的是( )
2.下列结论可靠的是( )
A.试液 白色沉淀
![]()
![]() 沉淀不溶 结论:试液中一定含SO42-
沉淀不溶 结论:试液中一定含SO42-
![]()
![]() B.气体 无色气体
白色沉淀 结论:原气体一定是CO
B.气体 无色气体
白色沉淀 结论:原气体一定是CO
C.溶液 冒白雾
![]() 白烟 结论:原溶液一定是浓盐酸
白烟 结论:原溶液一定是浓盐酸
D.有色溶液 红色溶液 结论:原溶液中一定含Fe3+
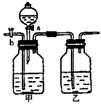 3.某同学设计用如图所示的装置将二氧化碳和一氧化碳进行分离和干燥。a、b均为活塞,试回答:(供选择的试剂:NaOH溶液、醋酸钠溶液、浓H2SO4、饱和食盐水、稀H2SO4、稀盐酸、碘水)。
3.某同学设计用如图所示的装置将二氧化碳和一氧化碳进行分离和干燥。a、b均为活塞,试回答:(供选择的试剂:NaOH溶液、醋酸钠溶液、浓H2SO4、饱和食盐水、稀H2SO4、稀盐酸、碘水)。
(1)甲瓶中应装的是 溶液,乙瓶中应装的是 溶液,分液漏斗中应装的是 溶液。
(2)当CO与CO2的混合气体通过该装置时,先分离得到的是 ,活塞操作是 ,然后得到的是 ,活塞操作是 。
检测提高
1.下列各组物质,不用试剂和仪器就能鉴别的是( )
A.浓硫酸、浓盐酸 B.碳铵、小苏打
C.甲苯、苯 D.食盐、氯化钾
2.某溶液含有较多的Na2SO4和少量的Fe2 (SO4)3。若用该溶液制取芒硝,可供选择的操作有:①加适量H2SO4溶液,②加金属Na,③结晶,④加过量NaOH溶液,⑤加强热脱结晶水,⑥过滤。正确的操作步骤是
A.②⑥③ B.④⑥①③
C.④⑥③⑤ D.②⑥①③⑤
3.为了鉴别硫酸溶液和水,设计了5种方案:
①用量筒量取相同体积的两种液体,分别置于两只相同的烧杯中,置于托盘天平两托盘上,质量较大者为硫酸溶液
②取样,分别加入无色酚酞试液,能使酚酞变色的是硫酸溶液
③以电导装置分别测试它们的导电性,导电能力强的是硫酸溶液
④在两种液体的试样中,分别加入少量铁粉,铁粉溶解且生成浅绿色溶液的是硫酸溶液
⑤取两块完全相同的小木块,分别置于两种液体中,露出体积大者是硫酸溶液
你认为上述方案中不合理的是( ) ( )
A.只有② B.只有①②
C.只有②③④ D.全部
4.ICl、IBr与卤素单质性质相似。在粗碘中含ICl和IBr,受热时I2、ICl、IBr均可升华,在粗碘中加入一种物质后,再进行升华可制得精碘,应加入的物质是( )
A.H2O B.Zn C.KI溶液 D.CH3CH2OH
5.某些单质,易溶于含同一元素的盐溶液中,如:硫易溶于硫化钾溶液中。对由CaCO3,KI,Al(OH)3, Ag2O,I2所组成的混合物,要使其每种成份逐一溶解(一次只溶解一种物质),试剂的选用及操作顺序均正确的是 ( )
A.氨水、乙醇、水、氢氧化钾、硝酸
B.四氯化碳、水、氨水、氢氧化钠、盐酸
C.水、苯、氨水、氢氧化钾、硝酸
D.水、盐酸、氢氧化钠、氨水、乙醇
6.有Na2CO3、AgNO3、BaCl2、HCl及NH4NO3五瓶无标签溶液,为鉴别它们,取四支试管分别装入一种溶液,再向上述四支试管中加入少许剩下的一种溶液,下列结论错误的是( )
A.若有三支试管出现沉淀时,则后加入的是AgNO3
B.全部没有什么现象变化时,后加入的是NH4NO3
C.一支试管出现气体,两支试管出现沉淀时,最后加入的是HCl
D.若只有两支试管出现沉淀时,则最后加入的是BaCl2溶液
7.下列各组物质,只用水不能将其鉴别出来的是( )
A.硫酸铜、碳酸钠、硫化铝三种粉末
B.甲醇、乙醛、溴苯三种液体
C.氢氧化钠、硝酸铵、氯化钠三种晶体
D.碳化钙、碳酸钙、含酚酞的碱石灰三种干燥粉末
8.下列实验能取得成功的是( )
A.用NaOH溶液和硝酸银溶液检验氯代烃中的氯元素
B.用硝酸银溶液区分二氧化氮和溴蒸气
C.用酸性高锰酸钾溶液除去二氧化碳中混有的少量二氧化硫
D.用氢气除去乙烷中混有的少量乙烯
9.化学实验室中常将溶液或试剂进行酸化,下列酸化的处理中正确的是( )
A.定性检验C2H5Cl时,将C2H5Cl和NaOH溶液混合加热后,加H2SO4酸化
B.为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液酸化
C.鉴定待测溶液中是否含有Fe2+时,用硝酸酸化
D.鉴别溶液中是否有SO42-时,在无其他阳离子干扰条件下,所加的BaCl2溶液用盐酸酸化
10.要除去(Ⅰ)栏中“甲→己”各物质中所含杂质(括号内为杂质)请从Ⅱ栏中选择所需试剂(不可重复使用),从Ⅲ栏中选择所用的方法或主要仪器,再从Ⅳ栏中选择试剂,检验杂质是否已除净(Ⅲ、Ⅳ可重复使用):
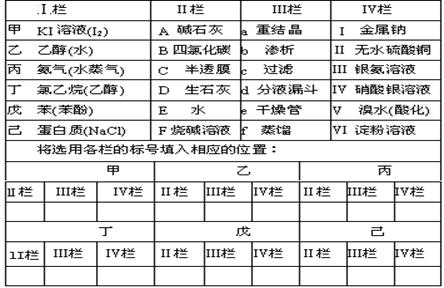 |
11.某固体混合物可能由KNO3、K2SO4、KI、KCl、NaCl、CuCl2、CaCl2、和Na2CO3中的一种或几种组成。依次进行下列五步实验,观察到的现象记录如下:
(1)混合物加水得无色透明溶液;
(2)向上述溶液中滴加BaCl2溶液,有白色沉淀生成。将该沉淀滤出,并将滤液分成两份;
(3)上述白色沉淀可完全溶于稀盐酸;
(4)将两份滤液中的一份,滴加氯水并加入CCl4,振荡后静置,CCl4层无色;
(5)将另一份滤液中加入AgNO3溶液,有白色沉淀生成。该沉淀不溶于稀硝酸。
根据以上实验,可以判断出混合物中肯定含有 ;但不能判断出是否含有 。
12.在纯碱溶液中滴入酚酞溶液变红,若在该溶液中再滴入过量的BaCl2溶液,所观察到的现象是
其原因是(以离子方程式和简要文字说明):
。
13.某课外活动小组利用蔗糖溶液、浓氨水、生石灰和硫酸四种药品,设计下列图示的方法从AgN03(含Fe3+和A13+)废液中提取Ag。
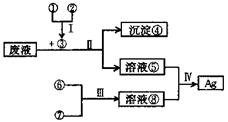 (1)写出下列物质的化学式③ ;④
(1)写出下列物质的化学式③ ;④
。
(2)在I一Ⅳ四步反应中,需要加热的有 。
(3)某同学按照上述方法实验时,最终没有回收到Ag,请你分析其主要原因,并对方法加以改进
。
(4)写出反应的化学方程式:
①+②→③: 。
溶液⑤+溶液⑧→Ag: 。
14.亚硝酸钠(NaNO2)可用做水泥施工的抗冻剂,它易溶于水,有咸味,且既有氧化性,又有还原性。在酸性溶液中它能氧化碘离子、亚铁离子,它能将人体血红蛋白里所含的亚铁离子氧化为3价铁离子,使人中毒,亚硝酸钠与酸反应生成亚硝酸,亚硝酸是不稳定的弱酸,它只存在于冷的稀溶液中,易发生如下分解反应:3HNO2=2NO↑+HNO3+H2O。请设计两种简单的实验方案,鉴别亚硝酸钠和氯化钠,可供选用的试剂如下:
a、稀H2SO4 b、稀HNO3 c、纯碱 d、氨水 e、碘化钾淀粉溶液 f、蒸馏水
(1)第一种方案(只用一种试剂)
①选用的试剂___________________________(填序号)
②观察到的现象______________________________;
(2)第二种方案:
①选用的试剂___________________________________
②观察到的现象________________________________。
15.已知硫代硫酸钠(Na2S2O3)具有①还原性:
2 Na2S2O3+I2= Na2S4O6+2 NaI;②在酸性条件下能迅速分解:Na2S2O3+2HCl=2NaCl+S↓+SO2↑+H2O;③BaS2O3难溶于水。市售硫代硫酸钠固体中常含有硫酸钠。
(1)请写出检验市售硫代硫酸钠中含硫酸钠的操作步骤、所用试剂、实验现象和结论。
A.
B.
C.
(2)利用硫代硫酸钠跟I2反应的性质可定量测定市售硫代硫酸钠的纯度。现取Wg硫代硫酸钠固体样品配制成VmL的溶液,加入指示剂,用含I2为amol/L的碘水进行滴定,耗用碘水bmL。回答下列问题:
D.该滴定实验最好是在 (填“强酸性、中性、强碱性”)溶液中进行,理由是
;
E.滴定过程中指示剂应选用 溶液。
F.样品中硫代硫酸钠纯度的表达式是 。