高考化学复习高一测试卷
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32
第I卷(选择题,共48分)
一、选择题(本题包括25小题,每小题2分,共50分。每小题只有一个选项符合题意)
1.我国的“神州六号”载人飞船已发射成功,“嫦娥”探月工程已正式启动。据科学家预测,月球的土壤中吸附着数百万吨的32He,每百吨32He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以42He的形式存在。下列说法正确的是 ( )
A.42He原子核内含有4个质子
B.32He和42He互为同位素
C.32He原子核内含有3个中子
D.42He的最外层电子数为2,所以42He具有较强的金属性
2、在下列有关晶体的叙述中错误的是 ( )
A.离子晶体中,一定存在离子键 B.原子晶体中,只存在共价键
C. 稀有气体的原子能形成分子晶体 D.金属晶体的熔沸点均很高
3.元素性质呈周期性变化的原因是 ( )
A.相对原子质量逐渐增大 B.核电荷数逐渐增大
C.核外电子排布呈周期性变化 D.元素的化合价呈周期性变化
![]() 4.下列微粒中:①
4.下列微粒中:①![]() ②
②![]() ③O2- ④,其核外电子数相同
③O2- ④,其核外电子数相同
的是 ( )
A.①②④ B.②③④
C.①②③ D.①③④
5.下列物质的分子中,不含共价键的是 ( )
A.MgF2 B.Cl2 C.HCl D.NaOH
6.在下列元素中,最高正化合价数值最大的是 ( )
A.Na B. Cl C. F D.Ar
7.下列变化中不需要破坏化学键的是 ( )
A.加热氯化铵 B.干冰升华 C.氯化钠熔化 D.氯化氢溶于水
8.元素X的原子核外M电子层上有3个电子,元素Y2- 的离子核外有18个电子,则这两种元素可形成的化合物为 ( )
A.XY2 B.X2Y C.X3Y2 D.X2Y3
9.下列物质电子式书写正确的是 ( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
10.根据下表给出的几种物质的溶沸点数据,判断下列说法中错误的是 ( )
| NaCl | MgCl2 | AlCl3 | SiCl4 | 单质B | |
| 熔点/℃ | 801 | 714 | 194 | —70 | 2300 |
| 沸点/℃ | 1465 | 1437 | 181 | 57.6 | 2550 |
A.SiCl4是分子晶体; B.单质B可能是原子晶体;
C.AlCl3加热能升华; D.NaCl 比MgCl2更易熔化。
11.下列四种说法:(1)只有一种元素组成的物质一定是纯净物(2)只有C2H6O组成的物质一定是纯净物(3)有单质参加的反应一定是氧化还原反应(4)同素异形体之间的相互转化属于化学反应,其中错误的组合是 ( )
A.只有(1)(2) B.只有(3)(4) C.只有(1)(2)(3) D.(1)(2)(3)(4)全错
12.下列各组顺序的排列不正确的是 ( )
A.原子半径:Na<Mg<Cl B.热稳定性:HCl>H2S>PH3
C.酸性强弱:H2SiO3<H2CO3<H3PO4 D. 碱性强弱:Be(OH)2 < LiOH < KOH
13.下列叙述中能肯定A金属比B金属活泼性强的是 ( )
A.A原子的最外层电子数比B原子的最外层电子数少
B.A原子的电子层数比B原子的电子层数多
C.1mol A从酸中置换H+生成的H2比1mol B从酸中置换H+生成的H2多
D.常温时,A能从水中置换出氢,而B不能
14.X和Y两元素的原子,在化学反应中都容易失去两个电子形成稳定结构,已知X的原子半径小于Y的原子半径,下列说法正确的是 ( )
A.两种原子失去电子的能力相同
B.两种原子的核外具有相同的电子层数
C. Y(OH)2的碱性比X(OH)2的碱性强
D.X的金属性比Y的金属性强
15.短周期元素M和N的离子M2+ 和N2-具有相同电子层结构,则下列说法正确的是 ( )
A.M原子比N原子多一个电子层
B.M的原子序数比N小
C.M和N原子的电子层数相等
D.M和N原子最外层电子数相等
16. 科学家根据元素周期律和原子结构理论预测,原子序数为114的元素属于第七周期ⅣA族,称为类铅元素。下面关于它的原子结构和性质预测正确的是 ( )
A.类铅元素原子的最外层电子数为6 B.其最高化合价为 +2价
C.它的金属性比铅强 D.它的原子半径比铅小
17、反应A(g)+3B(g)
![]() 2C(g)+ 2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是
2C(g)+ 2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是
A、v(C)= 0.04 mol /(L·s) B、v(B)= 0.06 mol /(L·min)
C、v(A)= 0.15 mol /(L·min) D、v(D) = 0.01 mol /(L·s)
18、对于反应M + N→P,如果温度每升高10℃,反应速率提高为原来的3倍,在10℃时完成反应的10%需要54min,将温度提高到30℃完成反应的10%需要的时间为( )
A、2min B、6min C、3min D、9min
19、下列体系加压后,对化学反应速率无影响的是( )
A、2SO2 + O2 = 2SO3 B、CO + H2O(g)= CO2 + H2
C、CO2 + H2O =H2CO3 D、H+ + OH- = H2O
20、在反应:C+CO2![]() 2CO中,可使反应速率增大的措施是(
)。
2CO中,可使反应速率增大的措施是(
)。
①增大压强 ②升高温度 ③通入CO2 ④增加碳的量 ⑤降低压强
A.①②③④ B.②③④⑤ C.①②③ D.②③④
21、C+CO2 ![]() 2CO(正反应吸热),反应速率为v1:N2+3H2
2CO(正反应吸热),反应速率为v1:N2+3H2 ![]() 2NH3(正反应放热),反应速率为v2。对于上述反应,当温度升高时,v1和v2的变化情况是
2NH3(正反应放热),反应速率为v2。对于上述反应,当温度升高时,v1和v2的变化情况是
A.同时增大 B.同时减小
C.v1增加,v2减小 D.v1减小,v2增大
22.可逆:反应:2NO2≒2NO+O2在定容密闭容器中反应,达到平衡状态的标志是( )
A、单位时间内生成nmol O2的同时生成2nmolNO
B、用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2:2:1的状态
C、混合气体的颜色不再改变的状态
D、混合气体的密度不再改变的状态
23.密闭容器中发生可逆反应:X2(g) + Y2(g)![]() 2Z(g)。已知起始时X2、Y2、Z各物质的浓度分别为0.1 mol/L、0.3mol/L、0.2mol/L,反应在一定条件下达平衡时,各物质的浓度可能是(
)
2Z(g)。已知起始时X2、Y2、Z各物质的浓度分别为0.1 mol/L、0.3mol/L、0.2mol/L,反应在一定条件下达平衡时,各物质的浓度可能是(
)
A.c(Z) = 0.3mol/L B.c(Y2) = 0.15mol/L
C.c(Y2) = 0.2mol/L D.c(Z) = 0.4mol/L
24、下列说法中可以充分说明反应: P(气)+Q(气)![]() R(气)+S(气) , 在恒温下已达平衡状态的是
( )
R(气)+S(气) , 在恒温下已达平衡状态的是
( )
A、反应容器内压强不随时间变化
B、P和S的生成速率相等
C、反应容器内P、Q、R、S四者共存
D、反应容器内总物质的量不随时间而变化
25、比较下列情况混合时,开始时的反应速率最小的是( )。
A、10mL 2mol•L-1 Na2S2O3和 10mL 1mol•L-1HCl
B、10mL 4mol•L-1 Na2S2O3和 30mL 2/3mol•L-1HCl
C、10mL 1mol•L-1 Na2S2O3和 30mL 0.5mol•L-1HCl
D、10mL 3mol•L-1 Na2S2O3和 20mL 1mol•L-1HCl
第Ⅱ卷(非选择题 共50分)
26.(5分)在①![]() Li ②
Li ②![]() N ③
N ③![]() Na ④
Na ④![]() Mg ⑤
Mg ⑤![]() Li ⑥
Li ⑥![]() C ⑦C60 ⑧NH4CNO ⑨CO(NH2)2⑩石墨 中:
C ⑦C60 ⑧NH4CNO ⑨CO(NH2)2⑩石墨 中:
(1) 和 互为同位素;(填编号,下同)
(2) 和 质量数相等,但不能互称同位素;
(3) 和 的中子数相等,但质子数不相等,所以不是同一种元素;
(4) 和 互为同素异形体, 和 互为同分异构体。
27.(5分)元素的金属性越强,形成的最高价氧化物的水化物的碱性越 ,与酸或水反应生成氢气越 。 元素的非金属性越强,形成的最高价氧化物的水化物的酸性越 ,与氢气化合生成气态氢化物越 ,生成的气态氢化物越_____。
28.(15分)下表是元素周期表的一部分,按要求填空:
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑴ | ⑵ | ||||||
| 3 | ⑶ | ⑷ | ⑸ | ⑹ | ⑺ | ⑻ | ⑼ | |
| 4 | ⑽ | ⑾ | ⑿ |
(1)写出下列元素的元素名称⑴ ⑵ ⑾ ⑿
(2)在这些元素中,最活泼的金属元素是 ,最活泼的非金属元素是 ,最不活泼的元素是 。(填元素符号)
(3)写出元素⑻的氢化物的结构式___________________
(4)在这些元素的最高价氧化物对应水化物中,酸性最强的是 ,碱性最强的是 ,呈两性的氢氧化物是 。(填化学式,下同)
(5)在⑶与⑷的单质中,化学性质较活泼的是 ,写出(3)的单质与水反应的化学方程式 ,该反应的氧化剂是_______________。
29.(8分)A、B、C、D、E五种短周期元素,它们的原子序数依次增大。B元素原子L层上的电子数为K层电子数的2倍;元素D的2价阴离子的核外电子排布与氖原子相同;E与A同主族;A和E 这两种元素与D都能形成X2Y、X2Y2型化合物。
(1) 写出元素的符号:A ;B___ ___;C ;E________。
(2) 画出D的离子结构示意图____________________________。
(3) A的X2Y型化合物的电子式是_________________________。
30、(4分)某温度时,在2L密闭容器中,X、Y、Z 3种物质的量随时间变化的曲线如图所示。由图中数据分析:
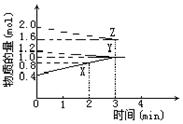
(1)该反应的化学方程式____________。
(2)反应开始至2min末,X的反应速率为_____________。
31、(6分)写出下列各热化学方程式
(1)、常温下14g CO在足量氧气中充分燃烧,放出141.3kJ热量.
(2)、1g硫粉在氧气中完全燃烧并放出9.36kJ热量
三、计算题:(本题只有1个小题,共7分)
32. 将化合物A的蒸气2mol充入0.5L 容器中加热,发生分解反应:2A +B ![]() nC,
nC,
反应到3min时,容器中A的物质的量浓度为0.4mol.L-1,并测得这段时间内,用C的浓度变化表示的反应速率为1.2 mol.L-1.min-1。
(1) 求化学计量数n的值。
(2) 以B的浓度变化表示该反应的反应速率。
答题卷
一选择题:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | |||||||||||||
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| 答案 |
二填空题
26、⑴ 和 ⑵ 和 ⑶ 和 ⑷ 和
⑸ 和
27、
28、⑴ ⑵ ⑾ ⑿
(2)、
(3)
⑷
⑸
29、(1) 写出元素的符号:A ;B___ ___;C ;E________。
(2) 画出D的离子结构示意图____________________________。
(3) A的X2Y型化合物的电子式是_________________________。
30、(1)该反应的化学方程式________ ___。
(2)反应开始至3min末,X的反应速率为_______ ______。
31、(1)、
(2)
32、计算题:
参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | B | D | C | C | A | B | B | D | C | D | C | A | D |
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| 答案 | C | A | C | A | B | D | C | A | C | A | B | C |
26.(1)① ⑤ (2)② ⑥ (3)③ ④ (4)⑦ ⑩ ,⑧ ⑨
27.强 容易 强 容易 稳定
28.(1)氮 氟 钙 溴
(2)K F Ar
(3)(2分)H-Cl
(3)HClO4 KOH Al(OH)3
(4)(4分)Na 2Na + 2H2O==2NaOH + H2↑ H2O
29.(1)H C N Na
(2)![]()
(3)![]()
30.2Z+Y![]() 3X 0.1mol.L-1.min-1
3X 0.1mol.L-1.min-1
31. CO (s)+ 1/2O2 (g)===CO2 (g) △ H =-282.6kJ/mol
S(s)+O2(g)===SO2(g) △H=-299.5kJ/mol
32 n=4 0.3 mol.L-1.min-1

