专题训练(氧化还原反应二)
班级________姓名________得分_________
[1].以油类为溶剂的防锈漆称为油基防锈漆,由于环保方面的原因,目前要推广使用水基防锈漆,但水基漆较易溶解O2,在干燥之前易导致金属表面产生锈斑,为此要在水基漆中加入缓蚀剂,以下可作为缓蚀剂添加的是
A.KMnO4 B.NaNO2 C.FeCl3 D.HNO3
[2].下列物质转化需要加入还原剂才能实现的是
A.SO32-→SO2 B.HCl→Cl2 C.Na→Na+ D.SO2→S
[3].下列反应所生成的气体中,含有被还原的元素是
A.炭粉和二氧化硅均匀混和后强热 B.石英和纯碱均匀混和后强热
C.铜片放入浓硫酸中加热 D.铝粉放入氢氧化钾溶液中振荡
[4].已知:2Fe+3Br2=2FeBr3 2Fe3++2I—=2Fe2++I2,现将Fe(NO3)2溶液分别滴入到以下溶液中:①H2SO4 ②HNO3 ③溴水 ④碘水,其中能使Fe2+转变成Fe3+的是
A.只有②③ B.①②③ C.②③④ D.全部
[5].下列反应中有一种物质既是氧化剂又是还原剂的是
A.2KI+Br2=2KBr+I2 B.2AgNO3![]() 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑
C.Cu2(OH)2CO3![]() 2CuO+CO2↑+H2O D.2Na2O2+2H2O=4NaOH+O2↑
2CuO+CO2↑+H2O D.2Na2O2+2H2O=4NaOH+O2↑
[6].下列反应中,水既不是氧化剂,也不是还原剂,但反应是氧化还原反应的是
A.2Na2O2+2H2O=4NaOH+O2↑ B.C+H2O![]() CO+H2
CO+H2
C.Cl2+H2O=HCl+HClO D.2F2+2H2O=4HF+O2
[7].有甲、乙、丙、丁四种金属,仅甲在自然界主要以游离态存在;丙盐的水溶液不能用丁制的容器盛放;丁与乙盐的水溶液不反应。则这四种金属的活动性由强到弱的顺序可能是
A.甲乙丙丁 B.丁乙丙甲 C.丙乙丁甲 D.乙丁丙甲
[8].在反应3BrF3+5H2O=HBrO3+Br2+9HF+O2中,若有5mol水发生氧化反应,则被还原的BrF3物质的量为
A.2mol B.5mol
C.![]() mol
D.
mol
D.![]() mol
mol
[9].单质A能从盐溶液中置换出单质B,则下列说法不正确的是
A.A、B都是金属时,A一定比B的金属活动性强
B.当A、B都是非金属时,A一定比B的非金属活动性强
C.当A是金属时,B可能是金属,也可能是非金属
D.当A是非金属时,B可能是非金属,也可能是金属
[10].下列叙述中正确的是
A.阳离子只有氧化性,阴离子只有还原性
B.含氧酸可作氧化剂而无氧酸则不能
C.失电子难的原子获得电子的能力就强
D.氯气分子可作氧化剂,但也可被其他氧化剂所氧化
[11].下列说法中正确的是
A.强氧化剂和弱还原剂易发生氧化还原反应
B.实验室制氯气的反应中,氯离子通过还原反应生成氯气
C.由HgCl2生成Hg2Cl2时,汞元素被还原了
D.I-、Br-、Cl-的还原性依次减弱,氧化性依次增强
[12].C1SO3H称为氯磺酸,是一种强酸。对于反应:ClSO3H+HCOOH=CO+HCl+H2SO4有如下判断,其中较合理的是
A.此反应属于氧化还原反应 B.此反应不属于氧化还原反应
C.反应后溶液的pH值变小 D.反应后溶液的pH值增大
[13].在一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1mol Cr3+反应所需PbO2的物质的量为
A.3.0mol B.1.5mol C.1.0mol D.0.75mol
[14].R2O8n-离子在一定条件下可以把Mn2+离子氧化为MnO4-,若反应后R2O8n-离子变为RO42-离子,又知反应中氧化剂与还原剂的物质的量之比为5:2,则n值是
A.4 B.3 C.2 D.1
[15].已知A2O![]() 可将B2-氧化为B单质,A2O
可将B2-氧化为B单质,A2O![]() 则被还原为A3+,又知100mL的0.3mol/L的A2O
则被还原为A3+,又知100mL的0.3mol/L的A2O![]() 与150mL的0.6mol/L B2-恰好完全反应,则A2O
与150mL的0.6mol/L B2-恰好完全反应,则A2O![]() 中的n值为
中的n值为
A.4 B.5 C.6 D.7
[16].已知Cu2S与某浓度的硝酸反应时,生成硝酸铜和硫酸,若反应中Cu2S与HNO3的物质的量之比为2:13,则该反应的还原产物为
A.N2O B.NO C.NO2 D.N2O3
[17].在KI和KIO3混合溶液中通入H2S发生反应后,生成碘、硫酸钾和水,在此反应中被氧化的碘元素与被还原的碘元素的物质的量之比为
A.5:1 B.1:1 C.1:3 D.1:5
[18].臭氧可以使湿润的淀粉碘化钾试纸变蓝,化学方程式为:KI+O3+H2O→KOH+I2 +O2(未配平),下列叙述正确的是
A.O3在反应中被还原为O2 B.该反应的还原产物为I2
C.1mol O3在反应中得到2mol电子 D.反应中氧化产物与还原产物物质的量之比为1:3
[19].实验室可通过以下反应来制取碘:2NO+O2=2NO2;2H++2I-+NO2=NO+I2+H2O。在这一过程中,每制取1mol I2时,所消耗氧化剂的质量是
A.16g B.28g C.32g D.46g
[20].根据下表下列叙述中正确的是
| 序号 | 氧化剂 | 还原剂 | 其它反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | FeCl3 | ||
| ② | KMnO4 | H2O2 | H2SO4 | O2 | MnSO4 |
| ③ | KClO3 | HCl(浓) | Cl2 | Cl2 | |
| ④ | KMnO4 | HCl(浓) | Cl2 | MnCl2 |
A.表中第①组反应的氧化产物一定只有FeCl3(实为Fe3+)
B.氧化性比较:KMnO4>Cl2>Fe3+>Br2>Fe2+
C.还原性比较:H2O2>Mn2+>Cl-
D.④的离子方程式配平后,H+的化学计量数为16
[21].在铁与铜的混和物中,加入不足量的稀硝酸,充分反应后剩余金属m1g,再向其中加入一定量的稀硫酸,充分振荡后,剩余金属m2g,m1与m2的关系是
A.m1一定大于m2 B.m1可能等于m2
C.m1一定等于m2 D.m1可能大于m2
[22].有A、B、C、D四种金属,将A、B用导线连接后浸入稀H2SO4中,A上放出氢气,B逐渐溶解生成B2+;电解含A2+和C2+的混合溶液时,阴极上先析出C;将D放入含B2+的硝酸溶液中,D表面有B析出,同时生成D2+。则这四种金属阳离子的氧化性由强到弱的顺序是:
。
[23].KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,其变化可表述为
____KClO3+____HCl(浓)=____KCl+____ClO2↑+____Cl2↑+____H2O
(1) 请配平上述化学方程式。
(2) 浓盐酸在反应中显示出来的性质是________(填编号)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3) 产生0.1mol Cl2,则转移的电子的物质的量为________mol。
(4) 氧化剂是________,还原剂是________;氧化产物是________,还原产物是________。
[24].某化学反应的反应物和产物为:KMnO4 + KI + H2SO4 → MnSO4 + I2 + KIO3 + K2SO4 + H2O
(1) 该反应的氧化剂是
(2) 如果该反应方程式中I2和KIO3的系数都是5
①KMnO4的系数是
②在给出的化学式上标出电子转移的方向和数目: KMnO4 + KI + H2SO4 →
(3) 如果没有对该方程式中的某些系数作限定,可能的配平系数有许多组。原因是_____________
 ____________________________________________________________。
____________________________________________________________。
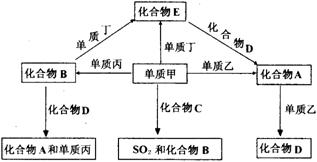
[25].A、B、C、D、E是中学化学中常见的五种化合物,它们分别由两种元素组成。甲、乙、丙、丁是单质,甲、丙、A、C、D常温下均为气体,B是液体,E是黑色固体,这些单质和化合物之间存在如下关系(反应条件均无注明):
(1) 写出下列物质的分子式:甲 、B 。
(2) 在以上有关转化的反应中充当还原剂的物质有 (填写化学式)。
(3) 写出化合物A的电子式 。
(4) 写出单质丁跟化合物B反应生成化合物E的化学方程式:______________________________。
[26].当140g铁粉跟213g氯气充分反应后,加入适量的水,完全溶解后无残余固体,加入稀释至2L。
(1) 求溶液中氯化铁的物质的量浓度。
(2) 若要求溶液中只含溶质氯化铁,还需在此溶液通入标准状况下的氯气多少升?
[27].黄铜矿(主要成分CuFeS2)是提取铜的主要原料
(1) 取12.5g黄铜矿样品,经测定含3.60g硫(杂质不含硫),矿样中CuFeS2含量为_______。
(2) 已知:2CuFeS2+4O2![]() Cu2S+3SO2+2FeO(炉渣)
Cu2S+3SO2+2FeO(炉渣)
产物Cu2S在1200℃高温下继续反应:2Cu2S+3O2→2Cu2O+2SO2 2Cu2O+Cu2S→6Cu+SO2
假定各步反应都完全,完成下列计算:
①由6mol CuFeS2生成6mol Cu,求消耗O2的物质的量。
②6mol CuFeS2和14.25mol O2反应,理论上可得到多少摩尔铜?
③6mol CuFeS2和15.75 mol O2反应,理论上可得到多少摩尔铜?
[1] B
[2] D
[3] CD
[4] B
[5] BD
[6] AC
[7] D
[8] B
[9] D
[10] D
[11] C
[12] BC
[13] B
[14] C R ↓(8-![]() -6)×2×5 Mn ↑5×2
-6)×2×5 Mn ↑5×2
[15] D A ↓(n-1-3)×2×1 B ↑2×3
[16] A Cu ↑1×2×2 S ↑8×2
N ↓(5-x)×(13-2×2×2) ![]() x=1
x=1
[17] D S ↑8x I ↑y I ↓5z 8x+y=5z、y+z=2x(K守恒)![]() y:z=1:5
y:z=1:5
[18] C
[19] A
[20] D
[21] A 原溶液中有NO3-存在,当加入稀硫酸时,酸性增加,剩余的金属将继续与溶液反应而使最后剩余的金属质量减小
[22] C2+>A2+>B2+>D2+
[23] (1)2,4=2,2,1,2; (2)②; (3)0.2 (4)KClO3 ;HCl;Cl2;ClO2
[24] (1)KMnO4
(2)① 8 【配平后系数依次为8、15、17、8、5、5、9、17】
②![]()
(3)该反应式含两种氧化产物,两者的比例和氧化剂的用量都可以发生变化
【有两种氧化产物,分别对应两个不同的系数,比例不同时,两者的量就不同,所以有无数组】
[25] (1)O2、H2O
(2)CO、H2、Fe、H2S、C (3)![]()
(4)3Fe+4H2O![]() Fe3O4+4H2
Fe3O4+4H2
[26] (1)2Fe+3Cl2=2FeCl3 Fe+2FeCl3=3FeCl2
2 3 2 0.5 1 1.5 C(FeCl3)=0.50mol/L
(2)只含FeCl3 Cl―共7.5mol还需1.5molCl― 即0.75mol Cl2![]() 16.8L
16.8L
[27] (1)12.5×x×![]() =3.6 x=82.8%
=3.6 x=82.8%
(2)①2CuFeS2~4O2~Cu2S Cu2S+O2→2Cu+SO2
6 12 3 3 3 n(O2)=15mol
②O2不足量 2Cu2S+3O2→2Cu2O+2SO2 2Cu2O+Cu2S→6Cu+SO2
1.5 2.25 1.5 1.5 过量 4.5 n(Cu)=4.5mol
③O2过量 2Cu2S+3O2→2Cu2O+2SO2 2Cu2O+Cu2S→6Cu+SO2
2.5 3.75 2.5 过量 0.5 3 n(Cu)=3mol