氧族元素
教学目标
知识技能:通过硫及其化合物转化关系的教学,使学生掌握H2S、SO2、H2SO4的性质、制法和用途;通过实验设计的分析与讨论,使学生对硫及其化合物知识网络化、系统化。
能力培养:以硫及其化合物的性质为载体,以实验设计为核心,训练学生对已有知识进行分析综合、归纳演绎的思维能力以及解决实际问题的能力。
科学思想:通过学生自己对实验方案的设计与讨论,培养学生严谨求实的科学态度。
科学品质:通过以学生为主体的探究式教学途径,激发学生的学习兴趣,尝试成功的喜悦,使学生更加喜爱化学。
科学方法:通过实验设计的讨论与分析,使学生领会化学科学研究的一般方法。
重点、难点 硫及其化合物的相互转化关系的实验设计与评价。硫及其化合物各代表物性质的综合运用。
教学过程设计
教师活动
【引言】上节课我们复习了卤族元素的知识,下面我们复习氧族元素。在复习本部分内容时,建议以掌握S、H2S、SO2、H2SO4代表物的性质为核心,用氧化还原的观点为指导思想。
学生活动
倾听、形成基本的复习思路。
【板书】二、氧族元素
【提问】请按下表要求填入你所知道的含有硫元素的物质的化学式:
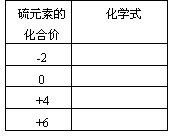
再现、讨论后得到:
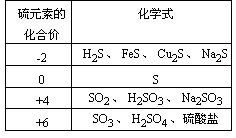
【提问】请根据所学的元素化合物知识,列出上面表格中的各物质之间的转化关系
讨论逐步完善后得到:
【板书】1.硫及其重要化合物间相互转化关系
【投影】
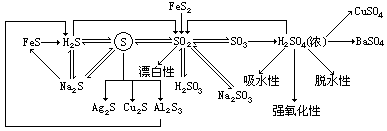
要求学生叙述各转化关系的化学方程式。
【板书】2.硫的重要化合物性质的实验设计
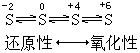
结合上面的硫元素的知识网络图做好进行实验设计的心理准备。
【板书】(1)SO2、H2S的制备及性质的实验设计
【投影】请设计一套实验装置生成SO2并证明SO2有氧化性、还原性和漂白性。
【提问】
①该装置应包括几部分?
②通过怎样的实验证明SO2有氧化性?写出反应的化学方程式。将观察到怎样的现象。
③请确定气体发生装置及所需药品。写出化学方程式。
④制H2S时不使用浓硫酸的原因?
⑤如何证明SO2有还原性?将观察到怎样的实验现象?写出化学方程式。
⑥如果证明SO2有漂白性?将观察到怎样的实验现象?
⑦尾气能否排入大气?应如何处理?
⑧装置的各组成部分如何连接最合理?
讨论、设计实验方案。
思考并回答:
①气体发生装置、证明还原性的装置、证明漂白性的装置、证明氧化性的装置、尾气吸收装置。
②使SO2与H2S反应。
2H2S+SO2=3S↓+2H2O,将观察到有淡黄色固体物质生成。
③
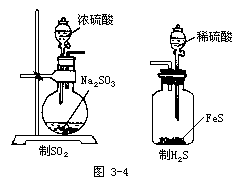
Na2SO3+H2SO4=Na2SO4+SO2↑+H2O
FeS+H2SO4=FeSO4+H2S↑
④浓硫酸可将-2价S元素氧化。
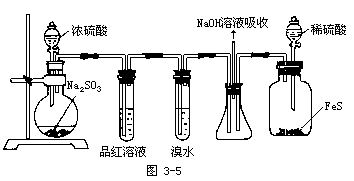
⑤使SO2通过装有溴水或酸性KMnO4溶液的洗气瓶。溶液将褪色。
Br2+SO2+2H2O=2HBr+H2SO4
⑥使SO2气体通过装有品红溶液的洗气瓶或与湿润的有色布条接触,品红溶液或布条将褪色。
⑦因SO2和H2S均污染环境,所以不能排入大气,可用碱液吸收。
⑧充分讨论后最终得出下列装置图:(见图3-5)
【投影】SO2氧化性、还原性、漂白性的验证:
【练习】将等体积的SO2和Cl2的混合气体通入品红溶液中,品红溶液是否褪色?为什么?
思考、讨论并解答:不褪色,原因是发生了如下反应:
SO2+Cl2+2H2O=2HCl+H2SO4
【板书】

自我总结与概括。
【板书】(2)浓硫酸性质的实验设计
【提问】浓硫酸有哪些特殊性质?举例说明。(要求学生口述有关反应的化学方程式)。
回忆、再现浓硫酸的特殊性质。思考并回答:①吸水性——浓硫酸在空气中放置吸水而增重,浓硫酸可做气体干燥剂。②脱水性——浓硫酸使蔗糖炭化,浓硫酸使乙醇脱水转化为乙烯。③强氧化性——浓硫酸与金属Cu、非金属C等反应。
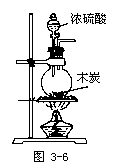
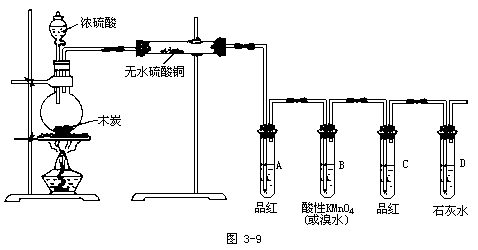
【投影】请设计一套实验装置图,用来演示浓硫酸与木炭共热的反应及检验其生成的产物。
【提问】
①写出浓硫酸与木炭反应的化学方程式。选择该反应的发生装置。
讨论、设计实验方案。
讨论、思考并确定:
①2H2SO4(浓)+C ![]() 2SO2↑+CO2↑+2H2O,依据反应物的状态和反应条件,选择如下实验装置:
2SO2↑+CO2↑+2H2O,依据反应物的状态和反应条件,选择如下实验装置:
②应先检验何种产物?选择实验装置。
②应先检验水,选择如下装置:
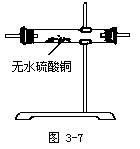
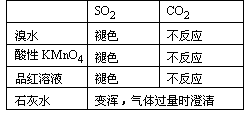
③填写下面的表格:
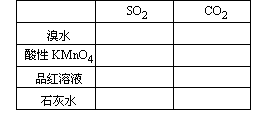
③
据上确定如何检验SO2和CO2,设计出实验装置图并说明实验现象及得出的结论。
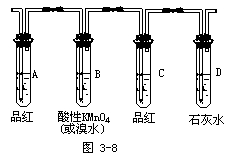
回答:A中的品红溶液褪色,则证明了SO2的存在。B中的酸性KMnO4溶液或溴水用于吸收SO2,实验过程中颜色将变浅。C中的品红溶液用于证实SO2是否除净。当C中品红不褪色,D中石灰水变浑则证明了CO2的存在。
师生共同归纳后得出下面的实验装置图:
【投影】浓硫酸与木炭反应的实验设计:
【板书】

【提问】含硫元素的阴离子主要有哪些?
思考、回忆并归纳出:S2-、SO32-、S2O32-、SO42-。
【板书】
(3)S2-、SO32-、S2O32-、SO42-检验的实验设计
【提问】各种离子应如何检验?将检验方案填写在下面的表格内:
讨论、总结出各种离子的检验方案,与教师共同完成表格。
【投影】几种含硫离子的检验:

【提问】在某溶液中加入BaCl2溶液和稀硝酸,有白色沉淀产生,原溶液中一定有SO42-离子吗?为什么?
思考讨论在教师的引导下得出:原溶液中不一定含SO42-,原因是:
①Ag+与BaCl2产生的AgCl同样不溶于稀硝酸。
②若原溶液中含有SO32-,则加入BaCl2溶液时产生BaSO3沉淀,该沉淀遇稀硝酸会被氧化成BaSO4,仍然是白色沉淀。
【过渡】由此可见Ag+、SO32-对SO42-的检验有干扰。那么,应如何正确的检验SO42-呢?
讨论、发表不同见解。最终得出正确的检验方法是:先加稀盐酸排除Ag+、SO32-离子的干扰,再加BaCl2溶液,有白色沉淀产生,则证明原溶液含SO42-。
理解与记忆。
【板书】S2-、SO32-、S2O32-离子的检验用酸,SO42-离子的检验是先加稀盐酸,再加BaCl2溶液。
【投影】硫和氯是同周期的主族元素,通过哪些事实可以证明氯的非金属性强于硫?请从原子结构的角度给予解释。
讨论、回忆归纳得出:
①Cl2与Fe、Cu反应生成FeCl3、CuCl2,而S与Fe、Cu反应生成FeS、Cu2S。
②Cl2与H2见光可发生爆炸性反应,H2可在Cl2中燃烧,H2与Cl2
极易化合,HCl很稳定。S蒸气与H2加热才化合,H2S不稳定。
③Cl2通入H2S溶液中会置换出S,即Cl2+H2S=S↓+2HCl。
④酸性:HClO4(最强酸)>H2SO4(强酸)。
引导学生从原子结构的角度解释这些事实并得出下面结论:
【板书】原子结构→非金属性(氧化性):Cl>S
精选题
一、选择题
1.将下列各种液体分别与溴水混合并振荡,静置后分成两层,溴水层几乎无色的是 ( )
A.氯水
B.NaOH溶液
C.苯
D.碘化钾溶液
2.在NaBr与Nal的混合液中,通入过量的Cl2,把溶液蒸干后灼烧,最后残留的物质是 ( )
A.NaCl、Br2、I2
B.NaCl、NaBr、I2
C.NaCl、I2
D. NaCI3.除去下列污物的方法正确的是 ( )
A.做过碘升华实验的试管用酒精或CS2洗涤
B.附有硫的试管可用热NaOH溶液洗涤
C.附有AgCl固体的试管用稀硝酸洗涤
D.附有CuS的试管用稀盐酸洗涤
4.对盐酸的下列描述中,正确的是 ( )
A.有酸性、有氧化性、无还原性
B.有酸性、有氧化性、有还原性
C.浓盐酸在空气中冒白烟
D.是一种无氧化性酸,所有不具有氧化性
5.下列反应或事实能够说明氯的非金属性比硫强的是 ( )
A.CuCl2+H2S=CuS↓+2HCl
B.Cl2+Na2S=2NaCl+S↓
C.硫在常温下是固体,Cl2通常是气体
D.盐酸是强酸,亚硫酸是中强酸
6.在反应:5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O中,被氧化的氯元素与被还原的氯元素的质量比是 ( )
A.5∶1 B.1∶1 C.4∶1 D.3∶1
7.已知某溶液中,Cl-、Br-、I-的物质的量之比为1∶2∶3,现要使溶液中Cl-、Br-、I-的物质的量之比为3∶2∶1,则通入的Cl2的物质的量与原溶液中I-的物质的量之比为 ( )
A.1∶2 B.2∶1 C.3∶1 D.1∶3
8.氯仿(CHCl3)可以作为麻醉剂,常因保管不善被空气氧化,生成剧毒物质光气(COCl2):2CHCl3+O2→2HCl+2COCl2,为防止出现医疗事故,使用前要检验其是否变质,应选用的试剂是 ( )
A.NaOH溶液
B.溴水
C.酚酞试液
D.AgNO3溶液
9.下列物质中,不能用硫蒸气与金属直接化合得到的是
( )
A.Cu2S B.Fe2S3 C.FeS D.Na2S
10.除去SO2中的少量HCl气体应选用 ( )
A.NaOH溶液
B.CuSO4溶液
C.Na2S溶液
D.饱和NaHSO3溶液
11.H2S通入下列溶液中不产生浑浊的有:①溴水,②亚硫酸,③FeSO4溶液,④FeCl3溶液,⑤CuSO4溶液 ( )
A.①、②、③
B.①、②、③、④、⑤
C.③
D.④
12.铁粉和硫粉的混合物41g,隔绝空气充分加热后,将所得固体溶于足量的稀硫酸中,可得到标准状况下的气体11.2L,则原混合物中铁粉的质量是 ( )
A.5.6g B.2.8g
C.28g D.11.2g
13.一种盐a和酸b反应可放出有刺激性气味的气体c,c与NaOH溶液反应生成a,a可被氧化最终生成d,d溶于水可生成b。则a和b分别是 ( )
A.Na2S和HCl
B.Na2S和H2SO4
C.Na2SO3和H2SO4
D.Na2SO3和HCl
14.向50mL 18mol/L的硫酸中加入足量的铜片加热,充分反应后,被还原的硫酸是 ( )
A.小于0.45mol
B.0.45mol
C.介于0.45mol和0.90mol之间
D.大于0.90mol
15.常温下,向20L真空容器中通入a mol H2S和b mol SO2(a和b都是不大于5的正整数),反应完毕后,容器内气体可能达到的最大密度约是 ( )
A.14.4 g/L B.24.5g/L
C.8g/L D.5.1g/L
二、非选择题
16.某无色溶液可能含有下列钠盐中的几种:(A)NaCl,(B)Na2S,(C)Na2SO3,(D)Na2S2O3,(E)Na2SO4,(F)Na2CO3在此溶液中加入适量的稀硫酸,有浅黄色沉淀析出,同时有气体产生,此气体有臭鸡蛋气味,可使澄清石灰水变浑浊,不能使品红溶液褪色。根据上述实验现象回答下列问题:
(1)不能使品红溶液褪色,说明该气体中不含______(填化学式)。
(2)此无色溶液中至少存在哪几种钠盐?请写出全部可能的情况(填写相应的字母)。
第一种情况是______,第二种情况是______,第三种情况是______,第四种情况是______。(可不填满,也可补填)。
17.某亚硫酸钠试剂,已部分被氧化,为确定其纯度,要进行如下实验:①称取W1g样品,②将样品溶解,③给溶液加入稍过量的用盐酸酸化的BaCl2溶液,④过滤、洗涤、干燥沉淀,称其质量为W2g。回答:
(1)BaCl2要用盐酸酸化的原因是____________。
(2)BaCl2溶液要稍过量的原因是__________________。
(3)判断操作③是否完成的方法是___________________。
(4)判定沉淀是否洗涤干净的方法是___________________。
(5)Na2SO3纯度的表达式为:Na2SO3%=________________。
18.已知硫粉和亚硫酸钠共热可制得硫代硫酸钠,现以硫化亚铁为主要原料,按下图所示,制取硫代硫酸钠。图中A、B、C、D是硫单质或硫的化合物,其它不含硫的产物已被略去,各步反应可添加必要的试剂。
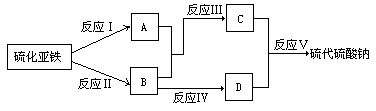
填写下列空白;
(1)反应I的化学方程式为_______________________。
(2)物质B的化学式为________,物质D的化学式为__________。
19.将5.000g NaCl、NaBr、CaCl2的混合物溶于水中,通入Cl2充分反应后将溶液蒸干并灼烧,灼烧后残留物的质量为4.914g,若将此残留物再溶于水,并加入足量的Na2CO3溶液,所得沉淀经干燥后质量为0.270g。求此混合物中各化合物的质量分数。
20.1.0 L H2S气体和a L空气混合后点燃,若反应前后气体的温度和压强都相同(0℃,1.01×105Pa),讨论当a的取值范围不同时,燃烧后气体的总体积V(用含a的表达式表示,假设空气中氮气和氧气的体积比为4∶1,其它成分忽略不计)。
答 案
一、选择题
1.C 2.D 3.A、B 4.B 5.B
6.A 7.D 8.D 9.B 10.D
11.C 12.C 13.B、C 14.A 15.A
二、非选择题
16.(1)SO2 (2)F、B、C F、B、D
17.(1)防止Na2SO3与BaCl2反应生成BaSO3沉淀。(2)保证SO42-全部沉淀。
(3)充分反应后,静置,向上层清液中继续滴加BaCl2溶液,若不再有沉淀生成,表示所加BaCl2溶液已过量。
(4)取洗涤沉淀所得滤液,加入稀硫酸,若无沉淀产生,表面沉淀已洗涤干净。
(5)(1—142W2/233W1)×100%
18.(1)FeS+H2SO4(稀)=FeSO4+H2S↑
(2)SO2 Na2SO3
19.w(NaCl)=90% w(NaBr)=4.0% w(CaCl2)=6.0%
20.若 a≤2.5 V=(1+2a/5)L
若 a≥7.5 V=(a-0.5)L
若 2.5≤a≤7.5 V=(a-0.5)L