高考化学学业水平测试卷
考试说明:
1.全卷满分为100分,考试时间为75分钟.
2.可能用到的元素的相对原子质量: H-1,C-12,O-16,N-14,Ca-40, Mg-24 , S-32,
Fe-56, Cl-35.5,Na-23, K-39, Cu-64
第Ⅰ卷(选择题 共69分)
选择题的答案请填在第II卷的表格中.
一、选择题(本题包括17小题,每小题3分,共51分.每小题只有一个选项符合题意)
1.人类探测月球发现,在月球的土壤中含有较丰富的质量数为3的氦,它可以作为未来核聚变的重要原料之一.氦的该种同位素应表示为
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
2.胶体区别于其他分散系的本质特征是
A.胶体的分散质能通过滤纸空隙,而浊液的分散质不能 B.产生丁达尔现象
C.分散质粒子直径在1nm~100nm之间 D.胶体在一定条件下能稳定存在
3.下列关于硫及含硫化合物的叙述正确的是
A.SO2的漂白原理与次氯酸相同
B.硫在空气中燃烧生成大量SO3
C.浓硫酸可以干燥H2、NH3、CO2等气体
D.常温下铝遇浓硫酸钝化,因此可用铝槽储运浓硫酸
4.下列颜色不属于因化学反应而产生的现象的是
A.无色试剂瓶中的浓硝酸呈黄色 B.久置的KI溶液呈黄色
C.新制氯水久置后变为无色 D.在普通玻璃导管口点燃纯净氢气时,火焰呈黄色
5.用NA表示阿伏加德罗常数,下列叙述正确的是
A.标准状况下,22.4LH2O含有的水分子数为NA
B.常温常压下,0.62g Na2O含有的Na+离子数为0.02 NA
C.通常状况下,11.2LCO2的分子数为0.5NA
D.物质的量浓度为0.5mol·L-1的MgCl2溶液中,含有Cl-个数为NA
6.某无色溶液在滴加石蕊试液时呈红色,在此溶液中能大量共存的离子组是
A.K+ 、MnO4-、Na+、Cl- B.K+、Na+、NO3-、CO32-
C.Na+、H+、NO3-、SO42- D.Fe3+、Na+、Cl-、SO42-
7.厨房中的化学知识很多,下面是有关厨房中的常见操作或者常见现象,其中不属于氧化还原反应的是
A.烧菜用过的铁锅,经放置常出现红棕色斑迹
B.用煤气灶燃烧沼气(主要成分为甲烷:CH4)为炒菜提供热量)
C.牛奶久置变质腐败
D.用醋酸除去水垢[主要成分是CaCO3、Mg (OH)2]
8.制备单质硅时,主要化学反应如下:
①![]() ②
②![]() ③
③![]()
下列对上述三个反应的叙述中,不正确的是
A. ①③为置换反应
B. ①②③均为氧化还原反应
C. ②为化合反应
D. 三个反应的反应物中硅元素均被氧化
9.在下列有关实验的叙述中,正确的是
A.用烧杯或烧瓶给液态物质加热时,不用垫石棉网
B.用乙醇和乙酸做原料可以制得乙酸乙酯
C.在用托盘天平称量固体药品时,药品直接放在右盘上
D.如果未知溶液中滴加BaCl2溶液有白色沉淀生成,证明原溶液中一定含有SO42—离子
10.下列实验操作中的仪器需要插入液面下的是
A.制备Fe(OH)2,用胶头滴管将氢氧化钠溶液滴入FeSO4溶液中
B.制备乙酸乙酯时,吸收乙酸乙酯的导管应伸入饱和碳酸钠溶液夜面以下
C.制蒸馏水时所用的蒸馏装置中,控制温度所用的温度计
D.制备Al(OH)3,用胶头滴管将过量氨水溶液滴入AlCl3溶液中
11.有关氨气的实验较多,下面对这些实验的实验原理的分析中,正确的是
A.NH3·H2O的热不稳定性可以解释实验室中用加热氨水的方法制取氨气
B.氨气的还原性可以解释氨气与氯化氢的反应实验
C.铵盐的水溶性大是实验室中用NH4Cl和Ca(OH)2的混合物制取氨气的原因
D.氨溶解于水可使酚酞试剂变为红色是因为溶解于水显弱碱性
12.下列各组中化合物的性质比较,不正确的是
A.酸性:HClO4>HBrO4>HIO4 B.碱性:NaOH>Mg(OH)2>Al(OH)3
C.稳定性:PH3>H2S> HCl D.非金属性:F>O>S
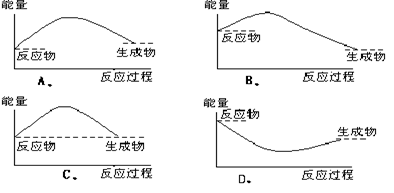 |
13.下列各图中,表示正反应是吸热反应的图是
14. 锂电池是一代新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池. 某种锂电池的总反应式是Li+MnO2 = LiMnO2.下列说法正确的是
A. Li是负极,电极反应为Li-e-=Li+
B. Li是正极,电极反应为Li+e-=Li-
C. MnO2是负极,电极反应为MnO2+e-=MnO2-
D. 锂电池能量高的原因是它所含电子多
15.反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率ν(X)(反应物的消耗速率或产物的生成速率)可表示为
4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率ν(X)(反应物的消耗速率或产物的生成速率)可表示为
A.ν(NH3)=0.010mol/L·S B.ν(O2)=0.0010mol/L·S
C.ν(NO)==0.0010mol/L·S D.ν(H2O)=0.045mol/L·S
16.1999年报道:爆炸性的高能N5+ 阳离子被美国加州爱德华空军基地空军研究室研究的高能材料的化学家Karl O. Christe与他的同事W.W Wilson合成.关于N5+的说法正确的是:
A.该微粒中的质子数为34 B.该微粒的电子数是34
C.该微粒由5个氮分子构成 D.它是一种由5个氮原子构成的单质分子
17.下列关于有机物的说法正确的是
A.甲烷易发生加成反应 B.常温下乙烯易发生取代反应
C.乙酸乙酯是高分子化合物 D.乙醇催化氧化生成乙醛
二、选择题(本题包括6小题,每小题3分,共18分.每小题只有一个选项符合题意)
18.在浓硫酸试剂瓶的标签上应印有下列警示标记中的
A. B.
B. C.
C. D.
D.
19.市场上出售的一种叫做果味钾的补钾药,其主要成分是柠檬酸钾(C6H5K3O7·H2O).下列有关对柠檬酸钾的说法正确的是
A.该物质每个分子中含有25个原子
B.该物质中碳、氢、钾、氧元素间的质量比是6∶7∶3∶8
C.该物质是由原子直接构成的
D.该物质是由碳、氢、钾、氧四种元素组成的
20.国际互联网上报道:“目前世界上有近20亿人患有缺铁性贫血”.我国政府现已启动“酱油补铁工程”.这里的铁指的是
A.铁元素 B.铁单质 C.四氧化三铁 D.硫酸铁
21.下列叙述不正确的是
A.用银氨溶液检验某病人是否患糖尿病 B.在植物油中滴入溴水,溴水褪色
C.在鸡蛋白溶液中滴入浓HNO3,微热会产生黄色物质 D.酶不属于蛋白质
22.下列有关维生素C的说法中正确的是
A.维生素C难溶于水 B.食品中添加维生素C不利于身体健康
C.维生素C能使酸性高锰酸钾溶液褪色 D.含维生素C的食物宜在高温下烹调
23.随着化学工业的发展,各种化学合成材料已走进我们寻常百姓家,下列关于生活中常用材料的认识,正确的是
A.尼龙、羊毛和棉花都是天然纤维
B.现在生产的各种塑料在自然条件下都不可降解
C.由酚醛树脂制成的插座破裂后可以热修补
D.装食品用的聚乙烯塑料袋可以通过加热进行封口
第Ⅱ卷(非选择题 共31分)
请将选择题的答案填在下表中.
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | ||||||||||||
| 题号 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | |
| 答案 |
三、(本题包括2小题,共10分)
24.(5分)随着生活水平的提高,人们越来越关注自身的健康.以下是探讨化学物质与人体健康的有关问题:
(1).发育出现障碍,患营养缺乏症,这主要是由于摄取_________(填“蛋白质”、“脂肪”或“维生素”)不足引起的.
(2).微量元素与人体健康密切相关,若膳食结构不合理,摄入某种微量元素不足,就会引起某些疾病,例如身材矮小,腰背弯曲可能是由于缺________,_________元素是合成甲状腺激素的重要原料;人体铁元素摄入量不足可能会导致_________.
(3).人体摄入过多的食物时,会引起胃酸分泌过多,胃酸的pH下降,使人体感到不适,此时应服用消酸剂,双羟基铝酸钠就是一种常用的消酸剂,其化学式为NaAl(OH)2CO3,由于Al3+在人体内难以代谢,含量过高可导致老年痴呆症等疾病,为防止人体摄入过量铝元素,请提一条合理的建议_________________ ___.
25.(5分)(1).小明在整理房间时,清理出如下物品:A.废作业本B.生锈铁钉C.坏日光灯管 D.电池.属于可回收垃圾的是 (填序号).
(2).铁器件不仅容易受到环境中化学物质的侵蚀而发生化学腐蚀,在潮湿的空气中还能发生
腐蚀.
请你根据钢铁锈蚀不同原理,提出防止钢铁锈蚀的两条合理措施.
四、(本题包括4小题,共15分)
26. (5分)(1).写出下列物质的结构简式.
甘氨酸 甘油
(2).请用系统命名法命名下列有机化合物.
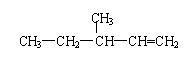
(3).完成下列化学方程式(有机物写结构简式).
①.苯的磺化反应 ___________
②.丙烯聚合成聚丙烯
27.(4分)有机物A的分子式为C4H8O2,A在酸性条件下与水反应,生成分子内均含有2个碳原子的有机物B和C;B在加热和铜催化下被氧化为D, D能发生银镜反应.
请回答下列问题:
(1)写出A和C的结构简式:A ;C .
(2)写出下列反应的化学方程式:
D与新制的Cu(OH)2悬浊液反应:
.
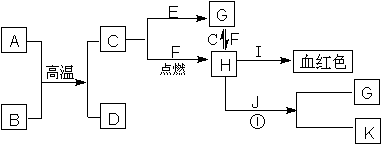
28.(4分)已知:A、C、J为日常生活中常见的金属单质,其中A、C均呈银白色,J呈紫红色.A是地壳中含量最高的金属元素,B是一种红棕色金属氧化物.它们之间的转化关系如下图.反应①在工业上可用于制作电路板.请回答下列问题:
(1).写出C和I的化学式: 、
(2).写出反应①的离子方程式:
29.(2分)元素在周期表中的位置,反映了元素的原子结构和元素的性质.右图是元素周期表的一部分.
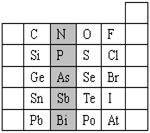 (1).根据元素周期律,请你预测:H3AsO4、H3PO4
的酸性强弱:
(1).根据元素周期律,请你预测:H3AsO4、H3PO4
的酸性强弱:
H3AsO4 H3PO4.(用“>”、“<”或“=”表示)
(2).在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断在相同条件下Se与H2反应的限度(选填“更大”、“更小”或“相同”) .
五、计算题(共6分)
30.(分)将200mL稀硝酸与足量的铜粉在微热的条件下发生反应,经测定,生成了1.12LNO(标准状况).试计算
(1).参加反应的铜的质量.
(2).该硝酸溶液中HNO3的物质的的量浓度.
(3).现用12.5mol/L的浓硝酸来配制500mL该稀硝酸.可供选择的仪器有:①玻璃棒②烧瓶③烧杯④胶体滴管⑤量筒⑥托盘天平⑦药匙.上述仪器中,配制时不需要使用的仪器有___________________(填代号),还缺少的一种仪器是________________.
参 考 答 案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | B | C | D | D | B | B | D | D | B | A | D | C |
| 题号 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | |
| 答案 | A | A | B | B | D | D | D | D | D | C | D |
24.(1)蛋白质 (2)钙、碘、缺铁性贫血(3)使用碳酸氢钠作为消酸剂 (每空各1分)
25.(1) A B (2分) (2) 电化学(1分), 烤蓝 涂油漆 (2分)
26.略(每空各1分)
27.(1)A.CH3COOCH2CH3 (1分) 、 C.CH3COOH (1分)
(2) ![]()
CH3CHO +2Cu(OH)2 Cu2O↓+CH3COOH +2H2O (2分)
28.(1) Fe (1分)、 KSCN (1分) (2)2Fe3++Cu=Cu2++2Fe2+ (2分)
29. < (1分) (2) 更小(1分)
30.(1)4.8g (2分) (2)1 mol/L (2分) (3) ②⑥⑦ (1分) 500mL容量瓶(1分)
