![]() 中学学科网学海泛舟系列资料
中学学科网学海泛舟系列资料![]()
![]() WWW.ZXXK.COM 上中学学科网,下精品学科资料
WWW.ZXXK.COM 上中学学科网,下精品学科资料
高考化学学业水平测试模拟卷
说明:
1.本卷分Ⅰ、Ⅱ卷。Ⅰ卷为选择题,请把正确答案填涂在答题卡上;Ⅱ卷答案写在答题纸的相应位置。交卷时只交答题卡和答题纸。
2.考试时间:75分钟。
3.本卷总分:100分。
4.本卷可能使用的相对原子质量:H—1 O—16 Na—23 Cl—35.5 Br—80
Ⅰ卷(共68分)
一、选择题(本大题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意)
1.下列单质中,通常用来制造半导体材料的是
A. 铝 B. 铁 C. 晶体硅 D.金刚石
2.下列物质不能和水反应的是
A.NH3 B.Cu C.CaO D.SO2
3.下列化学用语书写正确的是
A.氯原子的结构示意图:![]()
B.作为相对原子质量测定标准的碳核素:614C
C.氯化镁的电子式:![]()
D.用电子式表示氯化氢分子的形成过程:![]()
4.下列化合物中,既有离子键又有共价键的是
A.NH4Cl B.MgO C.C2H6 D.CO2
5.下列有机物在空气中燃烧,产生明亮并带有浓烟火焰的物质是
A.CH4 B. CH2==CH2 C. ![]() D. CH3CH2OH
D. CH3CH2OH
6. 分类法是一种行之有效、简单易行的科学方法,人们在认识事物时可以采取多种分类方法。下列关于“Na2SiO3”的分类不正确的是
A.离子化合物 B.电解质 C.钠盐 D.碱性氧化物
7. 下列酸和金属铝作用能产生氢气的是
A.浓硫酸 B.稀硫酸 C.浓硝酸 D.稀硝酸
8.下列实验现象描述正确的是
A.氯化氢与氨气相遇,有大量的白雾生成
B.用铂丝蘸取硫酸钠溶液,灼烧火焰呈黄色
C.氯化亚铁溶液与无色的KSCN溶液混合,溶液呈红色
D.SO2通入品红溶液,红色褪去,再加热,红色不再重现
9.对于2NaBr + Cl2 == 2NaCl + Br2反应,下列说法不正确的是
A.该反应既是置换反应,又是氧化还原反应
B.Cl2是氧化剂,发生还原反应
C.若有1.6gBr2生成,反应过程中转移了0.02NA个电子
D.钠元素在反应中价态不变,所以NaBr既不是氧化剂,又不是还原剂
10.下列离子方程式中,正确的是
A.在AlCl3溶液中加入过量氨水:Al3+ + 3NH3·H2O == Al(OH)3↓ + 3NH4+
B.在CuSO4溶液中加入过量Ba(OH)2溶液:Ba2+ + SO42- == BaSO4↓
C.氯气通入NaOH溶液中:Cl2 + OH- == Cl- + ClO- + H2O
D.氯化钠投入水中:O2- +H2O- == 2OH-
11.从节约原料和防止环境污染因素考虑,用铜制取硝酸铜,方法最佳的是
A.Cu ![]() Cu(NO3)2
B.Cu
Cu(NO3)2
B.Cu ![]() Cu(NO3)2
Cu(NO3)2
C.Cu ![]() CuCl2
CuCl2 ![]() Cu(NO3)2 D.Cu
Cu(NO3)2 D.Cu ![]() CuO
CuO ![]() Cu(NO3)2
Cu(NO3)2
12.X、Y、Z都是第三周期元素,核电荷数依次增大,X的氧化物对应水化物强碱,Z的原子半径最小。据此判断下列说法不正确的是
A.X是第ⅠA元素,Z是第ⅦA元素
B.X、Y、Z三种元素的最高化合价逐渐减小
C.Z的最高价氧化物对应的水化物是强酸
D.X、Z形成的化合物是离子化合物
13.下列说法正确的是
A.在化学反应中,化学能只可以转化为热能
B.合成氨工业中使用铁作催化剂以改变该反应的限度
C.SO2和O2合成SO3的反应中,增大压强,该反应速率减小
D.化学键的断裂和形成是化学反应中能量变化的主要原因
| 黄瓜汁 | 新鲜 | 久置 |
| 滴数 | 12 | 20 |
14.分别向盛有淀粉碘溶液的两烧杯中滴加新鲜黄瓜汁和久置黄瓜汁,黄瓜汁中含有的维生素C能使淀粉碘溶液褪色,实验结果见右表。下列说法不正确的是
A.维生素C具有还原性,能将碘单质还原为I—离子
B.实验时两烧杯中的淀粉碘溶液的浓度、体积必须相等
C.新鲜黄瓜汁比久置黄瓜汁中维生素C含量低
D.维生素C缺乏的病人要多吃新鲜的蔬菜和水果
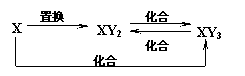 15.元素X的单质及X与Y形成的化合物能按如下图所示的关系发生转化。则X为
15.元素X的单质及X与Y形成的化合物能按如下图所示的关系发生转化。则X为
A.Fe B.Cu C.S D.C
16下列除去杂质的方法正确的是
| 物质 | 杂质 | 试剂 | 主要操作 | |
| A | SiO2 | Fe2O3 | 盐酸 | 过滤 |
| B | CO2 | CO | O2 | 点燃 |
| C | FeCl2溶液 | FeCl3 | Cu | 分液 |
| D | CH3CH2OH | H2O | Na | 蒸馏 |
二、选择题(本大题包括5小题,每小题4分,共20分。每小题只有一个选项符合题意)
17.糖类、油脂、蛋白质、维生素食物中的常见有机物。下列有关说法中,正确的是
A.糖类的主要成分是高级脂酸的甘油酯
B.油脂在人体中发生水解的产物是氨基酸
C.蛋白质主要由C、H、O、N四种元素组成
D.维生素A能维持血管和肌肉的正常功能
18.下面是4位同学对“化学与健康”这一话题发表的见解中,正确的是
 |  |





![]()
A B C D
19.新型镁合金被大量应用于制成笔记本电脑外壳、竞赛自行车框架等,这说明镁合金具有的优异性能是
①熔点低 ②硬度大 ③延展性好 ④导电性强 ⑤密度小 ⑥耐腐蚀
A.①②③ B.②③④ C.①③⑥ D.②⑤⑥
20.目前,已发现的居室空气污染物达300多种。其中有一种来自人造地板、家具以及装修粘合剂,长期接触低剂量的该物质,可引起过敏性皮炎、免疫功能异常。该污染物是
A.HCHO B.CO C.Rn D.CH3CH2CH2CH3
21.水是人类生存和发展的宝贵自然资源。下列有关水资源保护的说法中,不正确的是
A.重金属离子对人体有剧毒,可采用沉淀反应除去之
B.化肥中含有植物营养素,可大量使用以改善水环境
C.轧钢厂排出的含盐酸的废水,可用熟石灰中和处理
D.天然水中的细小悬浮颗粒,可用明矾等混凝剂净化
Ⅱ卷(共32分)
三、(本大题包括2小题。共10分)
22.(4分)材料是人类赖以生存的重要物质基础,而化学是材料科学发展的基础。材料种类很多,通常可分为金属材料、无机非金属材料(包括硅酸盐材料)、高分子合成材料及复合材料。
⑴生活中的玻璃、陶瓷、水泥属于上述材料中的 ,其生产原料不需要使用石灰石的是 。塑料制品给人类生活带来很多方便,但塑料制品造成的“白色污染”已成为社会的一大公害,请你提出一项防治“白色污染”的有效措施: 。
⑵金属腐蚀会造成巨大的经济损失,钢铁在潮湿的空气中更容易被腐蚀,主要原因是钢铁里的铁和碳构成许多微小的 ,发生电化学腐蚀。
23.(6分)抗酸药物的种类很多,其有效成分一般都是碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝和氢氧化镁等化学物质。
⑴抗酸药物具有抗酸作用的原因是 。
⑵某品牌抗酸药的主要成分有糖衣、碳酸镁、氢氧化铝、淀粉。
①写出该抗酸药发挥功效时的离子方程式:
、 。
②淀粉在抗酸药中作填充剂、粘合剂,淀粉在人体内酶的催化作用下发生水解反应,最终转化为(写分子式) 。
四、(本大题包括3小题。共22分)
24.(11分)我国化工专家侯德榜发明的侯氏制碱法的化学原理是将二氧化碳通入氨水的氯化钠饱和溶液中,其化学反应方程式为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。
⑴在实验室中利用上述原理从反应所得溶液中分离出碳酸氢钠晶体,应选用下列装置中的 ,该装置使用的玻璃仪器有______________________________。


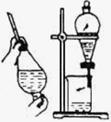
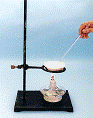
A B C D
⑵实验所得碳酸氢钠晶体中,可能含有的杂质离子有Cl—和NH4+,实验室鉴定Cl—所选用的试剂是 、 ,鉴定另一种杂质离子的方法是
。
⑶碳酸氢钠晶体受热分解可得到纯碱,其化学反应方程式为 ,请你设计一个简单的实验方案,判断碳酸氢钠晶体受热分解后所得固体中是否仍然含有碳酸氢钠: 。
25.(5分)石油通过裂化和裂解可以得到乙烯,乙烯的产量可以用来衡量一个国家石油化工发展水平。下图是由乙烯为原料生产某些化工产品的转化关系图。
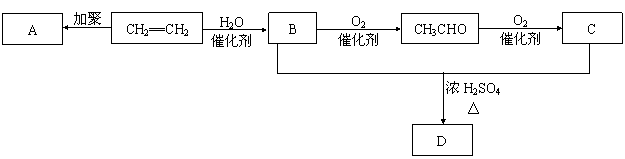
据此回答下列问题。
(1)写出乙烯的一种用途_______,指出乙烯→B的反应类型(选填取代反应或加成反应)_____________。
(2)写出A的结构简式__________________。
(3)写出B + C → D的化学反应方程式_______________________________________________________。
26.(6分)海洋约占地球表面积的71%,具有十分巨大的开发潜力。某校研究性学习小组同学对经初步净化处理的浓缩海水(主要含NaCl和MgSO4)进行研究。
(1)实验时若配制1000mL0.20mol/LNaOH溶液,计算称量固体NaOH的质量。
(2)取初步净化处理的浓缩海水100mL,加入200mL0.20mol/LNaOH溶液,恰好把其中的Mg2+完全沉淀,求浓缩海水中Mg2+的物质的量浓度为多少。
(3)研究小组同学把上述沉淀完全转化为无水MgCl2,并在熔融状态下进行电解,可得标准状况下Cl2多少升?
参考答案
一、选择题(本大题包括16小题,每小题3分,共48分。每小题只有一个正确选项)
1C 2B 3 C 4 A 5 C 6 D 7 B 8 B 9 D 10 A 11 D 12 B 13 D 14 C 15 A 16 A
二、选择题(本大题包括5小题,每小题4分,共20分。每小题只有一个正确选项)
17 C 18 B 19 D 20 A 21 B
三、(本大题包括2小题。共10分)
22.⑴无机非金属材料 陶瓷 开发研制降解塑料
⑵原电池(每空1分,共4分)
23.⑴其有效成分都能中和胃里过多的盐酸
⑵①MgCO3+2H+===Mg2++CO2↑+H2O Al(OH)3+3H+===Al3+ +3H2O ②C6H12O6
(除方程式每空2分外,其余每空1分,共6分)
四、(本大题包括3小题。共22分)
24.⑴B 烧杯、漏斗、玻璃棒(4分)
⑵AgNO3溶液 稀HNO3 取少量固体与强碱溶液混合加热,生成的气体能使湿润的红色石蕊试纸检验(每空1分,共3分)
⑶2NaHCO3![]() Na2CO3+CO2↑+H2O 取所得固体,继续加热,将生成的气体通入澄清石灰水,检验是否有CO2生成(每空2分,共4分)
Na2CO3+CO2↑+H2O 取所得固体,继续加热,将生成的气体通入澄清石灰水,检验是否有CO2生成(每空2分,共4分)
25. (1) 生产聚乙烯塑料 (1分) 加成反应 (1分) (2) ![]() (1分)
(1分)
(3) CH3CH2OH + CH3COOH![]() CH3COOCH2CH3 + H2O (2分)
CH3COOCH2CH3 + H2O (2分)
26. 解:(1) w(NaOH) = 0.20mol/L×1L × 40g/mol = 8 g (2分)
(2)MgCl2 + 2NaOH === Mg(OH)2↓ + 2NaCl
c(Mg2+)
= ![]() = 0.2mol/L
(2分)
= 0.2mol/L
(2分)
(3)MgCl2(熔融) ![]() Mg + Cl2↑
Mg + Cl2↑
V(Cl2) = 0.02mol/L×0.1L×22.4L/mol = 0.448L (2分)
答:略
注:主观性试题中,出现的合理答案均给分。
南通市2008届高考学业水平(必修科目)调研测试
双向细目表
| 模块 | 测试内容 | 题号 | 分值 | 容易 | 中等 | 较难 | |
| 必 修 1 + 必 修 2 | 概念与 理论 (18分) | 表示物质组成、结构、变化得化学用语 | 3 | 3 | 3 | ||
| 认识化学键的涵义。知道离子键和共价键的形成 | 4 | 3 | 3 | ||||
| 知道比较、分类等科学方法是化学研究和学习的常用方法。了解常见物质及变化的分类方法 | 6 | 3 | 3 | ||||
| 通过实验事实认识离子反应及其发生的条件,能正确书写常见的离子方程式 | 10 | 3 | 3 | ||||
| 知道金属、非金属在元素周期表中的位置及其性质的递变规律 | 12 | 3 | 3 | ||||
| 知道化学键的断裂和形成是化学反应中能量变化的主要原因。了解控制反应条件在生产和科学研究中的作用等 | 13 | 3 | 3 | ||||
| 元素及其化合物 (20分) | 知道晶体硅是良好的半导体材料 | 1 | 3 | 3 | |||
| NH3、Cu等物质的性质 | 2 | 3 | 3 | ||||
| 浓硫酸、硝酸的强氧化性;铝在浓硫酸、浓硝酸中的钝化现象 | 7 | 3 | 3 | ||||
| 了解钠的焰色反应。Fe3+的检验方法。认识亚硫酸的不稳定性,认识二氧化硫的漂白作用与次氯酸漂白作用的区别等 | 8 | 3 | 3 | ||||
| 知道在化工生产中遵循“绿色化学”思想的重要性。铜、氧化铜等与硝酸反应 | 11 | 3 | 3 | ||||
| 铁与氯气、酸等物质的反应。认识Fe3+和Fe2+之间的相互转化 | 15 | 3 | 3 | ||||
| 碳酸氢钠的热稳定性 | 24 | 2 | 2 | ||||
| 有机化学 (8分) | 甲烷、乙烯、苯、乙醇等的可燃性 | 5 | 3 | 3 | |||
| 了解乙烯的可燃性、加成反应、加聚反应等化学性质及主要用途。了解乙酸的酸性、酯化反应等性质及主要用途。通过简单实例了解常见高分子材料的合成反应 | 25 | 5 | 3 | 1 | 1 | ||
| 化学实验 (15分) | 能根据实验目的记录实验现象和数据,能对实验现象和数据进行分析和处理,得出正确结论 | 14 | 3 | 3 | |||
| 能说明有关实验的原理,常见物质的除杂等。 | 16 | 3 | 3 | ||||
| 能识别和绘制简单的实验仪器装置图。初步学会使用过滤、蒸发等方法对混合物进行分离和提纯。初步学会常见物质的检验。能根据试题有关要求设计、评价或改进实验方案,体验科学探究过程 | 24 | 9 | 5 | 2 | 2 | ||
| 化学计算(9分) | 了解阿伏加德罗常数的涵义。氧化还原反应概念 | 9 | 3 | 3 | |||
| 物质的量的相关计算 | 26 | 6 | 3 | 2 | 1 | ||
| 选修1 (30分) | 了解食物中的糖类、油脂、蛋白质、维生素等几种常见的有机物,知道它们对人体健康的意义。了解氨基酸、蛋白质的组成 | 17 | 4 | 4 | |||
| 认识微量元素对人体健康的重要作用。了解人体细胞中一些重要的酸碱平衡等。认识营养均衡与人体健康的关系。知道几种常见的食品添加剂的合理使用 | 18 | 4 | 4 | ||||
| 认识金属与合金在性能上的主要差异 | 19 | 4 | 4 | ||||
| 了解甲醛、一氧化碳、氡等空气污染物对人体的危害 | 20 | 4 | 4 | ||||
| 通过典型实例,了解水污染造成的危害。知道污水处理中主要的化学方法及其原理。 | 21 | 4 | 4 | ||||
| 知道常用的硅酸盐材料(水泥、玻璃和陶瓷)的主要化学成分、生产原料及其用途。了解“白色污染”的危害和防治方法。知道金属腐蚀的化学原理。 | 22 | 4 | 2 | 1 | 1 | ||
| 通过实例了解某些药物的主要成分和疗效 | 23 | 6 | 2 | 2 | 2 | ||
| 总分 | 70 | 20 | 10 | ||||
| 100 | 100 | ||||||
南通市2007年化学学业水平测试答题纸
三、(本大题包括2小题。共10分)
22. (1) _____________ _________________ ______________
(2)______________
23. (1)_____________________
(2)①____________________________________________、
_____________________________________________。
②____________________
四、(本大题包括3小题。共22分)
24.(1)________________________ _____________________________
(2)____________、____________ _______________________________________________________
(3)________________________________________-,
________________________________________________________________________________________。
25.(1)_____________; ______________________________。
(2)_______________________
(3)_____________________________________________________________________________________
26.(1)
(2)
(3)