高考化学招生考试调研测试题
化学
本试卷满分100分,考试时间90分钟
相对原子质量:H-1 C-12 N-14 O-16 Mg-24 S-32 Fe-56 Cu-64
第Ⅰ卷(共36分)
一、选择题(本题共36分,每小题3分,每小题只有一个正确选项)
1.已知H2(g)+1/2O2(g)=H2O(I)△H =-285.8KJ/mol。若将上述反应设计成一个燃料电池,该电池工作时能量转化的主要形式是( )
A.化学能转变为热能 B.热能转变为电能
C. 化学能转变为电能 D.电能转变为化学能
2.下列因果关系不正确的是( )
| 选项 | 原 因 | 结 果 |
| A | 植树造林 | 温室效应 |
| B | SO2和NO2气体大量排放 | 酸雨 |
| C | 汽车尾气的排放 | 光化学烟雾 |
| D | 含氮、磷等生活废水的大量排放 | 赤潮 |
3.下列说法不正确的是( )
A.向盛水(滴有酚酞试液)的烧杯中投入一小块钠,反应后溶液变红
B.问氢氧化铅沉淀中滴加浓氢氧化钠溶液,沉淀不溶解
C.向氯化铁溶液中滴入硫氰化钾溶液,显血红色
D.向品红溶液中通入二氧化硫气体,红色褪去
4.某试管充满气后倒立于盛水的水槽中,结果如图所示,该试管中原来所装的气体可能是
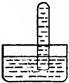 A.O2
A.O2
B.NO2
C.Cl2
D.NH3
5.下列说法不正确的是( )
A. 12C和13C互为同位素
B. O2 和O3互为同分异构体
C. 14N和15N具有相同的电子数
D. 18O和19F具有相同的中子数
6.下列离子方程式书写正确的是( )
A氢氧化钡溶液和稀硫酸反应Ba+SO42-= BaSO4↓
B.碳酸氢铵溶液和氢氧化钠溶液反应NH4++OH- = NH3·H2O
C.碳酸钡固体与稀盐酸反应 BaCO3+2H+ = Ba2+ +H2O+CO2↑
D铁粉与氯化铁溶液反应 Fe3+. +Fe = 2 Fe2+
7.下列说法不正确的是( )
A.纯碱溶液清洗油污,加热可增强其去污能力
B. 船身上镶锌块能减轻海水对船身的腐蚀,是利用了原电池原理
C. 甲烷燃烧放热,表明反应物的总能量大于生成物的总能量
D.医疗上血液透析,是利用了胶体的丁达尔效应
8.用NA 表示阿佛加德罗常数,下列说法正确的是( )
A.16gO2 中分子数为NA
B.1molHCl溶于水电离出的离子总数为NA
C1mol镁与足量酸完全反应转移的电子总数为2NA
.D.22.4L任何气体的总数为NA
9.下列解释错误的是( )
A.手不能直接接触氢氧化钠固体,是因为氢氧化钠具有强烈的腐蚀性
B.浓硝酸用棕色瓶保存,是因为硝酸不稳定,见光易分解
C.阳光照入房间可看到光柱,是因为尘埃气溶胶的丁达尔现象
D.医院透视用硫酸钡作“钡餐”,是因为硫酸钡性质稳定不溶于水可溶于酸
10.下列物质分类正确的是( )
A. Ca(OH)2难溶于水属非电解质
B.SO2能与碱反应生成盐和水属于酸性氧化物
C.NH4Cl组成中不含金属离子不属于盐
D.HCl气体溶于水电离成H+和Cl-属于离子化合物
11.在恒温恒容下发生反应:N2(g)+3H2(g)=2NH3(g);△H<0。下列判断不正确的是
A.30s内,H2的浓度改变了0.30mol/L,则平均反应速率v(NA)=0.01 mol/L·s
B.当气体总压不随时间改变时,表明该反应达到平衡状态
C.使用铁触媒可明显减少达到平衡的时间
D.降温可提高N2的转化率
12.在25℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。已知有关物质的溶度积KSP(25℃)如下:
| AgCl | Agl | Ag2S | |
| KSP(单位省略) | 1.8×10-10 | 1.5×10-16 | 1.8×10-50 |
下列论述错误的是( )
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C. AgCl固体在等物质的量浓度的NaCl、CaCl2 溶液中的溶解度相同
D. 25℃时,在饱和AgCl、Agl、Ag2S溶液中,所含Ag+的浓度不同
第Ⅱ卷(共64分)
13.(10分)已知A、B、C、D、E五种物质所含元素均在周期表的第一、二周期,
 A、C、D、E、F、G、I、J均为化合物,B在常温下为固体单质,C是大气污染物之一,H是常见的单质气体,请根据下图所示填空
A、C、D、E、F、G、I、J均为化合物,B在常温下为固体单质,C是大气污染物之一,H是常见的单质气体,请根据下图所示填空
(1)A的化学式为 ,C的化学式为 ,E和F反应生成I和H的化学方程式为 。(2)C少量时可用NaOH溶液除去,C大量时可用NH3与其在一定条件下反应,产物可直接排入大气,NH3与C物质反应的化学方程式为 ,此反应中NH3做
(氧化、还原)剂。
14.(10分)实验探究是体验知识的产生或形成过程的基本途径。下面是某同学探究实验报告的一部分,请填空:
实验名称:氯、溴、碘的氧化性强弱比较
实验药品:NaCl溶液、KBr溶液、KI溶液、氯水、溴水、四氯化碳、淀粉碘化钾试纸
| 实验步骤 | 实验结论 |
| ①NaCl溶液+氯水+1ml CCl4,振荡、静置、观察Cl4溶液 | 氧化性从强到弱的顺序:氯、溴、碘 |
| ②NaBr溶液+氯水+1ml CCl4,振荡、静置、观察Cl4溶液 | |
| ③Kl溶液+氯水+1ml CCl4,振荡、静置、观察Cl4溶液 |
(1)完成该实验需用到的仪器是 ;
(2)CCl4在实验中所起的作用是 ;
(3)在实验②中四氯化碳层颜色变化过程为 ;
(4)该同学的实验缺陷是 ,改进的办法是 。
15.(6分)(1)乙烯在空气中燃烧时火焰明亮伴有少量黑烟,甲烷燃烧时的火焰呈淡蓝色,两种气体燃烧现象不同的原因是 。
(2)25℃、101KPa时,1g甲烷气体完全燃烧生成液态水和CO2气体时放出热量55.6KJ,则甲烷燃烧的热化学方程式为 。
16. (6分)目前半导体生产展开了一场“铜芯片”革命─在硅心片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,铜的冶炼方法是先用热还原法得到粗铜,然后用电解法精制。
(1)用黄铜矿(主要成分CuFeS2)生产粗铜,其反应原理是
2 CuFeS2
+4O2 ![]() C2S+3SO2+2FeO(泸渣)
C2S+3SO2+2FeO(泸渣)
产物C2S在1200℃时继续反应
2C2S+3O2 ![]() 2Cu2O+2 SO2
2Cu2O+2 SO2
2Cu2O+C2S![]() 6Cu+SO2 ↑
6Cu+SO2 ↑
假如上述各步都能完全反应,1000t含杂质8%的黄铜矿最多可得到含铜96%的粗铜为
t.
(2)将粗铜精炼成精铜,在电解糟中,应将粗铜作 极,通常使用 (书写化学式)作电解液,电解时阴极反应式为 。
17.(12分)25℃时,在0.10mol/L的氨水中逐滴加入同浓度的盐酸直至过量(不计两者的挥发性),回答下列问题:
(1)经测定,25℃时,在0.1 L 0.1mol/L的氨水溶液中c(OH-)=1.3×10-3mol/L,此时一水合氨的电离平衡常数表达式为 。若向该氨水中滴加少量酚酞试液,溶液呈 色;若将上述浓度的氨水稀释10倍,则c(OH-) 1.3×10-4mol/L(用<、>、=填空)。
(2)当溶液PH=7时,溶液中c(NH4+) c(Cl-)(用<、>、=填空),当盐酸和
氨水溶液恰好中和时,溶液丰c(H+) c(OH-) (用<、>、=填空)。
(3)在上述实验中,该溶液PH变化趋势为 ;25℃时,在浓度均为0.1mol/L的氨水和盐酸中,由水电离出来的c(H+)之比约为 。
选考部分
以下是选答题,其中18、19、30、21题为《有机化学基础》模块题,22、23、24、25题为《物质结构与性质》模块题,26、27、28、29、30为《化学与枝术》模块题,考生只能从三个模块中任选一个作答,不得跨模块答题,否则只能以所答的第一个模块计分。
《有机化学基础》模块
18-20为选择题,每小题只有一个正确选项,每小题3分
18.下列说法错误的是( )
A.淀粉水解的最终产物是葡萄糖
B.温度越高,酶的催化率越高
C.乙醒能被弱氧化剂银氨溶液氧化
D.CO2 通入苯酚钠溶液中得到苯酚,说明苯酚的酸性比碳酸弱
19.光盘制造、微型机器制作、报纸杂志等行业都越来越多地使用到光敏高分子材料。聚乙烯醇肉桂酸酯是早期开发的一种光敏高分子材料,制得它的化学反应为:
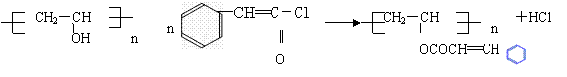 +
+
该反应的类型为( )
A.取代反应 B. 加成反应 C.消去反应 D.氧化反应
20. 红薯发酵后蒸馏得到的溶液中某提取物质A,经充分燃烧分析实验测定未知物中碳的质量分数为52.16%,氢的质量分数为13.14%,A的核磁共谱振反映出A分子内含有三种不同的氢原子,则A的结构简式为( )
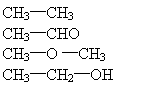 A.
A.
B.
 C.
C.
D.
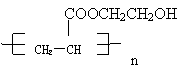
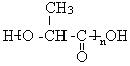
21.(11分)某制作隐形眼镜的材料 可由乳酸
( )加工处理来生产。
(1)乳酸分子中有两种官能团,名称是 、 。
(2)对乳酸进行加工处理过程为
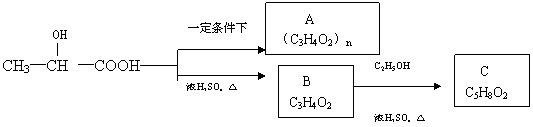
①如果加工处理时条件选择不当会得到较多的产物A,A的结构简式为
②乳酸在浓硫酸条件下加热可得B,B为制隐形眼镜材料的中间体,B与乙酸在浓硫酸条件下加热可得产物C,该反应的化学方程式为 。
③请按示例的形式写出以乳酸和石油产品(乙烯、丙烯、乙炔)为原料合成
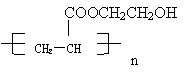
的合成线路,并注明合适的条件和必要的无机试剂
 |
(示例
《物质结构与性质》模块
22-24为选择题,每小题只有一个正确选项,每小题3分
22.已知元素X的基态原子最外层电子排布为nsn-1 npn+2 ,则X元素的原子序数为( )
A.9 B. 10 C.17 D.18
23. 某有机物(名称乙烯酮)的结构简式为:CH2=C=O,下列描述正确的是( )
A.该分子中共有2个π健、2个σ健
![]() B. 该分子属非极性分子
B. 该分子属非极性分子
C. 该分子是直线型分子
D. 该分子中2个碳原子的杂化方式是不同的
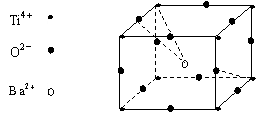 24. 经X射线分析鉴定,钛酸钡晶体属于立方晶系(如右图所示,且Ti4+、Ba2+和O2-互相接触)下列说法不正确的是( )
24. 经X射线分析鉴定,钛酸钡晶体属于立方晶系(如右图所示,且Ti4+、Ba2+和O2-互相接触)下列说法不正确的是( )
A.该晶体化学式为BaTiO3
B. 该晶体属于离子晶体,熔点较高
![]() C.与Ti4+配位的氧离子构成正四面体
C.与Ti4+配位的氧离子构成正四面体
D.与Ba2+配位的氧离子个数为12
25.(10分)现有A、B、C、D、E五种短周期元素,其原子序数依次增加,其中元素A、B、C构成的化合物称“烧碱”,D是最重要的半导体材料,它的高纯度单质是制造电脑CPU芯片的主要材料,而E的单质是一种常用于杀菌消毒的气体。有关高纯度D单质的生产流程如下:

试回答下列问题:(1)D元素在周期表中的位置为 ;指出化学式为C2B2 的物质中所含的化学健类型 、 。
(2)写出反应②的化学方程式(必须配平) ;预测化合物丙的空间构型 ,固态时丙应属于 晶体。指出化合物A2B的沸点高于乙(组成AE)的沸点的主要原因 。
(3)已知D单质的结成与金刚石类似,如图所示。
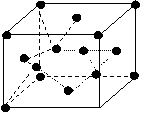 则该晶体中D单质原子数与D-D单健的数目
则该晶体中D单质原子数与D-D单健的数目
比为 ,该晶胞的边长为n(单位为cm),
摩尔质量为M(单位为g/mol),阿佛加德罗常数为
NA,则该晶体的密度为 g/cm3(用
代数式表达)。
《化学与枝术》模块
26-28为选择题,每小题只有一个正确选项,每小题3分
26. 高分子材料发展的主要趋势是高性能化,功能化、复合化、精细化和智能化,下列材料不属于功能高分子材料的是( )
A.用于生产光盘等产品的光敏高分子材料
B.用于制造CPU芯片的良好半导体材料单晶硅
C.能用于生产“尿不湿”的高吸水性树脂
D.能导电的掺杂聚乙炔
27. 下列说法正确的是( )
A.合成氨工业通过电解水大量获得原料气
B.石油的分馏不能生产煤油
C.金属冶炼依据的原理是氧化还原反应
D.离子交换法只应用于海水的淡化
28. 化学工业生产中一些常用的技术如下:
①原料气的净化②产品的分离③“三废”的处理④合成气循环⑤副产品综合利用⑥空气分离等等。
实现“煤变油”的Sasol间接液化工艺如图所示。
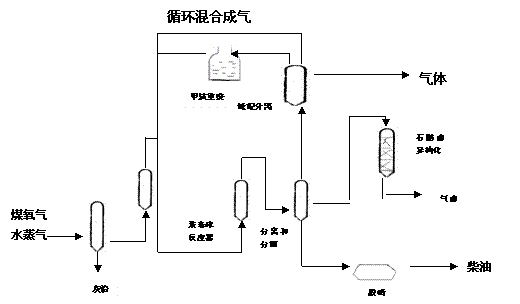
Sasol间接液化的原理是,利用蒸汽完全打破煤的原有化学结构、气化产物中H2和
CO的比例由通入O2量来控制,在除去对催化剂有毒的含硫成分后,进入“浆态床反应器”内反应后分离精制得到产品。在进入“浆态床反应器”前使用到的技术为( )
A.①④⑤ B.①③④ C.②④⑤ D.①④⑥
29.(11分)烧碱和氯气都是重要的基本化工原料,它们大多来自氯碱工业,氯碱工业的工艺流程如下图所示
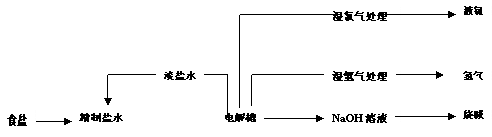 |
(1)电解饱和食盐水的总反应方程式为 ,阳极发生的电极反应为 。
(2)工业生产用的食盐水进入电解槽之前需精制,请简要说明精制的原因。
(3)目前氯碱工业主要采用的方法有三种,它们各有特点(见表)
| 方法 | 电解槽特点 | 产中中 氯化钠 含量 | 电解液中氢氧化钠含量 | 总耗能(KW.h上.t-1) | 其 他 |
| 隔膜法 | 使用石棉纤维制成的隔膜隔开阳极 | 较大 | 低 | 高 | 细微石棉吸入人的肺内有损健康,目前正被离子膜交换法取代 |
| 由独立的电解室和解汞室构成,氢气和氯气在不同室产生 | 低 | 很高 | 高 | 汞易对环境造成污染,在我国已被淘汰 | |
| 使用能选择通过离子的离子膜替代隔膜法中石棉隔膜 | 很低 | 较高 | 低 | 占地少、生产能力大、能连续生产,是氯碱工业的发展方向。 |
请比较三种方法的优缺点,指出哪些方面的主要因素不断促进着电解槽革新?
(4)氯碱工业的选址比较特殊,如果通常不会单独建氯碱化工厂,而是与农药厂、有机化工厂、制药厂、盐酸厂等建在一起,请分析这种建厂方式的原因和所带来的好处。
高等学校招生考试调研测试题
化学 参考答案与评分标准
第Ⅰ卷(共36分)
(每小题3分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | C | A | B | D | B | C | D | C | D | B | A | C |
第Ⅱ卷(共64分)
13.(10分,每空2分)
(1)HNO3 NaOH(或KOH) (写LiOH不给分)
2Na2O2 + 2CO2 == 2Na2CO3 + O2(或2K2O2 + 2CO2 == 2K2CO3 + O2)
(氧气的化学式后有箭头不扣分,配平错误扣1分)
(2)6NO2 + 8NH3 == 7N2 + 12H2O(配平错误扣1分) 还原(剂)
14.(10分,每空2分)
(1)试管、(胶头)滴管 (2分)(多写量筒不扣分)
(2)萃取剂(液)(溶剂)(2分)
(3)从无色变到橙色(橙红色、红棕色)(2分)(红色给1分)
(4)没有比较Br2和I2的氧化性强弱(2分)(答 “没有做对比实验”或“只用氯水”给1分
将溴水滴在淀粉KI试纸上,观察试纸是否变蓝色。(答“将实验③中的氯水改成溴水”也可)(2分)
15.(6分,每空2分)
(1)组成上乙烯含碳量比甲烷高;(2分)燃烧时,同体积(同物质的量)的乙烯比甲烷消耗氧气多。(2分)
(含碳量不同,耗氧量不同给满分;乙烯含碳量高,甲烷含氢量高给满分;乙烯燃烧不充分,甲烷燃烧充分给一半分;碳原子数不同给一半分)
(2)CH4(g) + 2O2(g) == CO2(g) + 2H2O(l)△H = -890kJ/mol (2分)
(系数未简化不扣分;未标状态或标错扣一分;单位错扣一分;未写负号不给分;热值错误不给分,热值可以写成-889.6;化学式错误不给分;未配平或配平错误不给分)
16.(6分)
(1)333.3t (1000/3或333、333.33给满分)(2分)
(2)阳(1分)CuSO4(1分)Cu2+ + 2e-==Cu (2分)(硫酸铜写成氯化铜或其他可溶性铜盐均可)
17.(12分)
(1)K= c(NH4+)·c(OH-)/c(NH3·H2O) (2分)(K给出正确数据计算式或只写出结果1.7×10-5给1分)
红色(1分)(淡红、浅红、粉红给0.5分)
> (1分)
(2)= > (每空2分)
(3)逐渐减小(其他叙述合理的也给分)(1分), 77∶1 (1000/13、100∶1.3、77都给分)(3分)
18.B 19.A 20.D
21.(1)羟基、羧基 (每空1分)
(2)①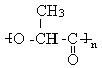 (
(![]() 、
、 、
、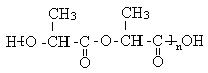 、
、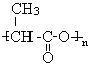 等合理的都给满分)(2分)
等合理的都给满分)(2分)
②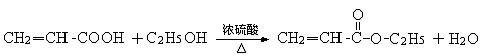 (写分子式的给1分)(2分)
(写分子式的给1分)(2分)
(3)(5分)(分5步记分,每步给1分)

(考生如果所答为先酯化再聚合也视为正确;其它合理的答案也可得分)
22. C 23. D 24. C
25.(1)第三周期ⅣA族 离子键、共价键(非极性键)(1分、2分)
(ⅣA写成汉字的也给满分;只填对周期或族序数的给0.5分)
(2)Si
+ 3HCl![]() H2
+ SiHCl3 (没配平扣1分或系数不是最简比扣0.5分) (2分)
H2
+ SiHCl3 (没配平扣1分或系数不是最简比扣0.5分) (2分)
四面体型 分子晶体 水分子间有氢键存在,破坏它需要较高能量(1分、1分、1分)
(3)1∶2 8M/a3NA (1分,2分)
26. B 27. C 28. D
29.(1)2NaCl + 2H2O![]() 2NaOH + Cl2↑ + H2↑(没条件或没箭头或没配平或配平错误扣0.5分);2Cl- == Cl2↑+2e-(每空1分)
2NaOH + Cl2↑ + H2↑(没条件或没箭头或没配平或配平错误扣0.5分);2Cl- == Cl2↑+2e-(每空1分)
(2)答:因为食盐水中含有Ca2+、Mg2+等杂质,在电解过程中产生的沉淀会堵塞离子膜,所以要除去(2分)。(只答出“杂质”两字给1分)
(3)(3分)答:比较三种方法可看出电解槽的特点决定了电解槽的革新趋势。三种方法各有优缺点:隔膜法中产品纯度较低、能耗高、对工人健康不利;汞法在能耗、环境污染两方面有问题,离子膜法电解液中氢氧化钠含量较低,但这种方法取代了目前的其他方法,说明电解液中氢氧化钠含量高不是决定因素,且产品纯度很高、总能耗低、无对工人或环境不利的因素。所以,促进电解槽革新的主要因素为:提高产品中氢氧化钠的纯度(或降低产品中氯化钠含量)、降低总能耗、有利于环境或工人的身体健康。(只要求答出有下划线的要点,每点1分)(其他表达合理也可)
(4)(4分)氯碱工业的产品中氯气和氢气为气体,运输和贮藏有相当大的困难,特别是这两种气体在运输过程中还存在很大的安全隐患。联合生产能很大程度上解决这些问题,而且节约能源、降低成本、减少安全风险,是循环经济、绿色化学的体现。(只要求答出有下划线的要点,每点1分)(其他表达合理也可)