08届高考化学复习备考试题
化 学 试 卷(六)
YCY
YCY可能用到的相对原子量:H—1 O—16 Cl—35.5 Na—23 K—39 Cu—64 Ag—108
一、选择题(每小题只有一个选项符合题意。每小题2分,共计30分。)
1.在常温常压下呈气态的化合物、降温使其固化得到的晶体属于 ( )
A.分子晶体 B.原子晶体
C.离子晶体 D.何种晶体无法判断
2.下列物质中,化学式能准确表示该物质分子组成的是 ( )
A.氯化铵(NH4Cl) B.二氧化硅(SiO2)
C.白磷(P4) D.硫酸钠(Na2SO4)
 3.镍镉(Ni-Cd)可充电电池在现代生活中有广泛的应用,它的充电放电反应按下式进
3.镍镉(Ni-Cd)可充电电池在现代生活中有广泛的应用,它的充电放电反应按下式进
行:Cd(OH)2+2Ni(OH)2 Cd+2NiO(OH)+2H2O由此可知,该电池放电时的负极
材料是 ( )
A.Cd(OH)2 B.Ni(OH)2 C.Cd D.NiO(OH)
4.多粉尘工厂如冶金、水泥等常将废气通过高压电的“电除尘器”,使粉尘基本除去,其
主要原理是 ( )
A.发生电泳,使粉尘于电极板上凝聚
B.高压电促使粉尘转化为气体
C.高压电使粉尘在空间形成沉淀而沉降
D.高压电因电场强烈有类似于过滤的作用
5.下列有关热化学方程式的说法中不正确的是 ( )
A.热化学方程式未注明温度和压强时,△H表示标准状况下的数据
B.热化学方程式中的化学计量数只代表反应物或生成物的物质的量
C.在加热或点燃条件下才能进行的化学反应既可以为放热反应,也可以为吸热反应
D.同一化学反应化学计量数不同,△H值不同。化学计量数相同而状态不同,△H值
也不同
6.在电解水制取H2和O2Y时,为了增强导电性,常常加入一些电解质,最好选用下列物质
中的 ( )
A.NaOH B.HCl C.NaCl D.CuSO4
7.下列每组物质发生状态变化所克服的粒子间的相互作用属于同种类型的是 ( )
A.食盐和蔗糖熔化 B.钠和硫熔化
C.碘和干冰升华 D.二氧化硅和氧化钠熔化
8.下列物质为固态时,必定是分子晶体的是 ( )
A.酸性氧化物 B.非金属单质 C.碱性氧化物 D.含氧酸
9.下列叙述正确的是 ( )
A.直径介于1nm~10nm之间的策粒称为胶体
B.NaCl溶于水和酒精都形成溶液
|
D.胶体粒子很小,可以透过半透膜
10.下列关于硫酸工业的叙述正确的是( )
A.SO2转化为SO3时采用常压是因为增大压强不会提高SO2的转化率
B.右图为硫酸工业流程中的一个设备,该设备就是热交换器
C.SO2在该设备中转化成SO3,再在吸收塔内用水吸收制成浓硫酸
D.燃烧硫黄制得的炉气所含杂质较少,不需要经过净化和干燥处理
11.在外界提供相同电量的条件下,Cu2+或Ag+分别按Cu2++2e→Cu或Ag++e—→Ag在电极
上放电,若析出铜的质量为1.92g,则析出银的质量为 ( )
A.1.62g B.6.48g C.3.24g D.12.96g
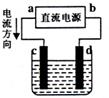
|
则下列有关判断正确的是( )
A.a为负极,b为正极
B.a为阳极,b为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
13.用惰性电极电解下列物质水溶液一段时间后,再加入一定质量的另一种物质(括号内),溶液能与原来溶液完全一样的是 ( )
A.CuCl2(CuO) B.NaOH(NaOH)
C.NaCl(HCl) D.CuSO4(Cu(OH)2)
14.用惰性电极实现电解,下列说法正确的是 ( )
A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变
B.电解稀氢氧化钠溶液,要消耗OH—,故溶液pH减小
C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1:2
D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1
15.关于晶体的下列说法正确的是 ( )
A.在晶体中只要有阴离子就一定有阳离子
B.在晶体中只要有阳离子就一定有阴离子
C.原子晶体的熔点一定比金属晶体的高
D.稀有气体原子序数越大,沸点越低
二、选择题(每小题只有一个选项符合题意。每小题3分,共计15分。)
16.目前,科学界拟合成一种“二重构造”的球型分子,即把“足球型”的C60(富勒烯)溶进“足球型”的Si60分子中,外面的硅原子以共价键结合。下列关于这种分子的说法中不正确的是 ( )
A.是一种新型化合物 B.晶体属于分子晶体
C.是两种单质组成的混合物 D.相对分子质量为2400
17.强酸和强碱的英才稀溶液的中和热可表示为 ( )
H+(aq)+OH—(aq)=H2O(l);△H=-57.3kJ·mol—1
已知:①CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l);△H=-Q1kJ·mol—1
②1/2 H2SO4(浓)+NaOH(aq)=1/2 Na2SO4(aq)+H2O(l);△H=-Q2kJ·mol—1
③HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(l);△H=-Q3 kJ·mol—1
上述反应均在溶液中进行,则Q1、Q2、Q3的关系正确的是 ( )
A.Q1=Q2=Q3 B.Q2>Q1>Q3 C.Q2>Q3>Q1 D.Q2=Q3>Q1
18.三氯化氮(NCl3)在常温下是一种淡黄色液体,其分子呈三角锥形,以下关于NCl3的叙述正确的是 ( )
A.NCl3晶体为原子晶体 B.分子中N—Cl键是非极性共价键
C.NCl3是一种含极性键的极性分子 D.N—Cl键能大,故NCl3沸点高
19.铁棒作阳极,石墨作阴极,电解滴有酚酞的食盐溶液,可能出现的现象是 ( )
A.铁棒附近变红 B.电解液中有沉淀生成
C.石墨棒上放出O2 D.石墨棒上放出Cl2
20.能够使反应Cu+2H2O=Cu(OH)2↓+H2发生,且Cu(OH)2能立即在电极上析出的是
( )
A.铜片作原电池的负极,碳棒作原电池的正极。氯化钠溶液作电解质溶液
B.用铜片作阴阳极,电解硫酸钠的水溶液
C.用铜片作阴阳极,电解氢氧化钠的水溶液
D.用铜片作阴阳极,电解硫酸铜的水溶液
第Ⅱ卷(共计55分)
三、填空题(55分)
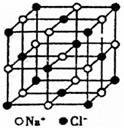
|
(1)晶体中每个Cl—同时吸引着 个Na+,每个Na+同时吸引着
个Cl—,每个Na+同时吸引着 个Na+。
(2)每个NaCl晶胞中平均有 个Na+ 个Cl—
(3)一定温度下,用X射线衍射法测得晶胞的边长为a cm,求该温度下NaCl晶体的密度?
22.(8分)根据国家环保局的统一规定,目前进行常规大气监测的项目是:二氧化硫、氮
氧化物、悬浮颗粒物三种大气污染物。
(1)空气中二氧化硫主要来源于
A.森林遭到乱砍滥伐,破坏了生态平衡
B.汽车排出的尾气
C.工业上大量燃烧含硫的燃料
D.大气中二氧化碳含量增多
(2)在下列情况中可能引起大气污染的是
①煤的燃烧 ②工业废气任意排放
③燃烧鞭炮 ④飞机、汽车尾气的排放
A.①② B.②④ C.①②③ D.①②③④
(3)二氧化硫是工业制硫酸中的必要物质,我国目前多用燃烧黄铁矿(FeS2)的方法来制取二氧化硫,这个反应常在 (填设备)内进行;该反应的化学方程式为 。
23.(10分)化学反应过程中发生物质变化的同时,常常伴有能量的变化。这种能量的变化常以热能的形式表现出来,叫做反应热。由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等等。
(1)下列△H表示物质燃烧热的是 ;表示物质中和热的是 ;
(填△H1,△H2和△H3等)
A.2H2(g)+O2(g)=2H2O(l);△H1
B.C(s)+1/2O2(g)=CO(g);△H2
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H3
D.C(s)+O2(g)=CO2(g);△H4
E.C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l);△H5
F.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H6
G.2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l);△H7
H.CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l);△H8
(2)在101kPa时,4.0g硫粉在氧气中完全燃烧生成SO2,放出37kJ的热量,S的燃烧热为 ,S燃烧的热化学方程式为 。
24.(12分)氢氧化钠是一种用途广泛的重要化工原料。工业上主要通过电解饱和氯化钠溶液的方法获得氢氧化钠。我国一般采用离子交换膜法制烧碱
(1)写出电解饱和氯化钠溶液时的电极反应和总化学反应方程式
阳极:
阴极:
总反应式:
(2)离子交换膜电解槽一般采用金属钛做阳极,碳钢网做阴极,阳离子交换膜把电解槽隔成阴极室和阳极室,阳离子交换膜的作用是
(3)电解之前食盐水需要精制,目的是除去粗盐中的Ca2+、Mg2+、SO42—等杂质离子。使用的试剂有:a. Na2CO3溶液,b. Ba(OH)2溶液,c. 稀盐酸。
其合理的加入顺序为 (填试剂序号)。
(4)如果在10L的离子交换膜电解槽中,1 min在阳极上可产生11.2L标准状况下的Cl2,这时溶液的pH是 (假设此温度下水的离子积Kw=1×10—14且溶液体积不变)
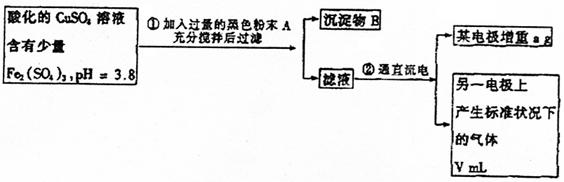
25.(11分)已知pH为4~5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生拟
用电解CuSO4溶液的方法测定铜的相对原子质量。其实验流程如下图所示:
|
试回答下列问题:
(1)步骤①所加入的A的化学式及加入A的作用是( )
a. Fe2O3;抑制Fe3+水解
b. CuO;与H+反应,调节溶液pH在4~5间使Fe3+完全水解
c. CuO;与Fe(SO4)3发生氧化还原反应
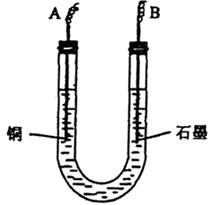
(2)步骤②中所用部分仪器如图所示:则A应接直流电源的 极。B电极上发生的电极反应式为 。
|
(3)下列实验操作属不必要的是 (填字母)
A.称量电解前电极的质量
B.电解后电极在烘干前,必须用蒸馏水冲洗
C.刮下电解后电极上的铜,并清洗、称量
D.低温烘干电极后称量
E.再次低温烘干后称量至恒重
(4)电解后向溶液中加入石蕊试液,观察到的现象是 。
(5)铜的相对原子质量的计算式为 。
(6)步骤②的变化中,从能量转化的角度看是 能转化为 能。
参考答案
1—5 ACCAA 6—10 ACDCD 11—15 BCCDA 16—20 CCCBC
21.(14分)(1)6,6,12 (2)4,4(以上每空2分)
(3)(4分)58.5×4/(NA·a3)
|
(3)沸腾炉:4FeS2+11O2 2Fe2O3+8SO2
23.(10分)(1)△H4、△H5;(2分) △H6;△H8 (2分)
(2)296kJ/mol(2分) S(s)+O2(g) SO2(g);△H=-296kJ/mol(4分)
24.(12分)(每空2分)
(1)阳极:2Cl—-2e—=Cl2
阴极:2H++2e—=H2↑或2H2O+2e—=H2↑+2OH—
总化学反应方程式:2NaCl+2H2O=2NaOH+H2↑+Cl2↑(条件:电解)
(2)阻碍气体和阴离子通过,防止H2和Cl2反应,Cl2与生成的NaOH反应。
(3)abc (4)13
25.(11分)(1)b(2分)
(2)负:(1分)4OH—-4e—=2H2O+O2↑(2分)
(3)C (4)溶液变为红色(1分)
(5)![]() (2分) (6)电;化学(各1分)
(2分) (6)电;化学(各1分)