第四章 化学与可持续发展
第一讲 开发利用金属矿物和海水资源
复习重点:了解化学方法在金属矿物开发(主要是金属冶炼)及海水资源开发中的作用。
复习难点:学生在掌握金属冶炼的一般原理基础上,了解适用于不同金属的冶炼方法。
知识梳理
一、金属的冶炼:金属冶炼是工业上将金属从含有金属元素的矿石中还原出来的生产过程。金属的活动性不同,可以采用不同的冶炼方法。总的说来,金属的性质越稳定,越容易将其从化合物中还原出来。金属冶炼的方法主要有:
1、热分解法:对于___金属,可以直接用_____方法将金属从其化合物中还原出来,例如:
_HgO![]() ____________;_Ag2O
____________;_Ag2O![]() ____________。
____________。
2、热还原法:在金属活动性顺序表中处于___位置的金属,通常是用还原剂(__、__、__、___等)将金属从其化合物中还原出来,例如:
Fe2O3+ CO ![]() __________;WO3+ H2
__________;WO3+ H2
![]() ________;
________;
ZnO+ C![]() ____________;MgO+ C
____________;MgO+ C ![]() __________;
__________;
Fe2O3+ Al ![]() __________;Fe+CuSO4=___________。
__________;Fe+CuSO4=___________。
3、电解法
活泼金属较难用还原剂还原,通常采用电解熔融的金属化合物的方法冶炼活泼金属,例如:
2NaCl(熔融) ![]() 2Na+Cl2↑;MgCl2(熔融)
2Na+Cl2↑;MgCl2(熔融)
![]() ______;
______;
2Al2O3 ![]() ______。
______。
一些对纯度要求较高的不活泼金属也可以采用电解其盐溶液的方法来进行冶炼,例如:
2CuSO4+2H2O
![]() 2Cu+2H2SO4+O2↑
2Cu+2H2SO4+O2↑
4、有些金属可以利用氧气从其硫化物中冶炼出来,例如:
Cu2S+O2 ![]() ____________。
____________。
二、海水资源的开发利用
1、海水资源的开发的方案
(1)从海水中提取淡水——海水淡化,海水淡化的方法主要有___法、____法、__法等。(2)海水制盐(3)从海水中提取_、_、_、_等化工产品(4)从海水中获取____作为核能开发的重要原料(5)从海水中获取其他物质和能量。
2.从海水中提取物质的方法
海水中含有的各种元素的特点:种类多,总储量大,富集程度低。因此,从海水中提取物质需要解决物质的富集的问题。例如:
(1)从海水中提取溴的主要工艺流程
①用蒸馏法将海水浓缩。用硫酸将浓缩的海水酸化。
②向酸化的海水中通入适量的氯气,使___转化为___:2NaBr+Cl2=Br2+2NaCl
③向含溴单质的水溶液中通入空气和水蒸汽,将溴单质吹入盛有二氧化硫溶液的吸收塔内以达到__的目的:_Br2+_SO2+_H2O=_________。
④向吸收塔内的溶液中通入适量的氯气:__________________。
⑤用四氯化碳(或苯)萃取吸收塔内的溶液中的溴单质。
(2)进行从海带中提取碘实验的反应原理及应注意的问题
①反应原理:海带中的碘元素主要以I-的形式存在,提取时用适当的氧化剂将其氧化成I2,再萃取出来。如用H2O2做氧化剂,反应的离子方程式是:___________。
②实验注意事项
海带不要用水洗,以免洗去海带中的碘;用干海带从而易于燃烧;灼烧海带的地方要注意通风。
疑难点拨
一、金属冶炼与金属活动性顺序表
根据金属离子得电子能力不同而采用不同的方法。
| 金属的活动顺序: | K Ca Na Mg Al | Zn Fe Sn Pb(H)Cu | Hg Ag Pt Au |
| 金属原子失电子能力 | 强 → 弱 | ||
| 金属离子得电子能力 | 弱 → 强 | ||
| 主要冶炼方法 | 电解法 | 热还原法 | 热分解法 |
1、电解法:(熔融):活泼金属(K~Al)的冶炼常采用电解它的熔盐或氧化物的方法。
2、还原剂法(高温):金属活动性顺序表中Zn~Cu之间的金属冶炼常采用此法。常用的还原剂有H2(CuO→Cu)、C(ZnO→Zn)、Na(TiCl4→Ti)、Al(Cr2O3→Cr)、CO(Fe2O3→Fe)等。
3、加热法:用于冶炼不活泼金属Hg、Ag
2HgO![]() 2Hg+O2↑,HgS+O2
2Hg+O2↑,HgS+O2![]() Hg+SO2,Ag2S+O2
Hg+SO2,Ag2S+O2![]() 2Ag+SO2
2Ag+SO2
4、湿法:Fe+CuSO4=FeSO4+Cu↓
5、物理法:Au、Pt在自然界中主要以游离态存在,利用密度。
二、溴的制取
1、工业制溴(以海水为原料)
Ⅰ、通Cl2气将化合态的溴氧化成单质溴:Cl2 + 2 Br- === 2 Cl- + Br2
Ⅱ、以硫酸酸化,NaBr与NaBrO3发生反应,结果化合态的溴转化为溴单质
5Br- + BrO3- + 6H+ ═══ 3Br2 + 3H2O
2、实验室制溴一般用NaBr、浓H2SO4、MnO2共热,即:
2NaBr
+ 2H2SO4(浓) + MnO2 ![]() Na2SO4 + MnSO4
+ Br2 + 2H2O
Na2SO4 + MnSO4
+ Br2 + 2H2O
典例剖析
【例1】冶炼金属一般有下列四种方法:①焦炭法;②水煤气(或氢气,或一氧化碳)法;③活泼金属置换法;④电解法。四种方法在工业上均有应用。古代有(Ⅰ)火烧孔雀石炼铜;(Ⅱ)湿法炼铜;现代有(Ⅲ)铝热法炼铬;(Ⅳ)从光卤石中炼镁,对它们的冶炼方法的分析不正确的是
A、(Ⅰ)用① B、(Ⅱ)用② C、(Ⅲ)用③ D、(Ⅳ)用④
解析:对于(Ⅰ)、(Ⅱ)、(Ⅲ)、(Ⅳ)发生的反应分别是
(Ⅰ)![]()
![]()
![]()
![]()
![]()
![]() ,符合①
,符合①
(Ⅱ)![]() ,适合于③
,适合于③
(Ⅲ)![]()
![]()
![]() ,适合于③
,适合于③
(Ⅳ)先从光卤石中提取MgCl2
,再电解MgCl2 ,MgCl2
![]() Mg+Cl2↑,符合④。
Mg+Cl2↑,符合④。
综上分析,本题答案为B。
【例2】海水是取之不尽的化工原料资源,从海水中可提取各种化工原料。下图是工业上对海水的几项综合利用的示意图:

试回答下列问题:
1、粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用试剂为:A 盐酸;B BaCl2溶液;C NaOH溶液;D Na2CO3溶液。加入试剂的顺序是 。
2、电解饱和食盐水时,与电源正极相连的电极上发生的反应为
。
与电源负极线连的电极附近溶液pH (变大、不变、变小)。若1mol电子的电量为96500C,则用电流强度为100A的稳恒电流持续电解3分13秒,则在两极上共可收集到气体 mL(S.T.P)。若保证电解后饱和食盐水的浓度不变,则可采取的方法是
。
3、由MgCl2·6H2O晶体脱水制无水MgCl2时,MgCl2·6H2O晶体在 气氛中加热脱水,该气体的作用是 。
4、电解无水MgCl2所得的镁蒸气可以在下列 气体中冷却。
A H2 B N2 C CO2 D O2
解析:
1、B C D A或C B D A
该小题属离子除杂题。除杂原则是在除去Ca2+、Mg2+、SO42-时,不能带入杂质离子。所以,解此题的关键是把握好加入离子的顺序:①Ba2+必须在CO32-之前加入;②CO32-、OH-必须在H+之前加入,所以B、C不分先后,而D、A本身既分前后,又必须放在B、C之后才能满足条件。
2、2Cl--2e→Cl2 变大 4480 措施是向电解液中通入一定量的HCl气体
电解饱和食盐水时,与正极相连的阳极发生的反应是2Cl--2e—→Cl2,与负极相连的阴极发生的反应是:2H++2e—→H2。H+不断消耗,使得溶液中[OH-]增大,pH变大。电解中外溢的是Cl2、H2,所以要确保原溶液浓度不变,只能向体系中通入一定量的HCl气体以补足损失的H、Cl原子。易错处是加入盐酸,使溶液浓度变小。
3、HCl
抑制水解平衡MgCl2+H2O ![]() Mg(OH)Cl+HCl正向进行
Mg(OH)Cl+HCl正向进行
4、A
【例3】(2004年全国高考)粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20g A全部溶于0.15 L 6.0mol·L-1盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12L(标况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色;
请填空:
(1)①中引发铝热反应的实验操作是 。产物中的单质B是 。
(2)②中所发生反应的反应的化学方程式是 。
(3)③中所发生的各反应的离子方程式是 。
(4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为 ,c(Fe2+)为 。
解析:MgO不能与铝发生置换反应,所以①发生的反应是Fe2O3+2Al
![]() 2Fe+Al2O3
2Fe+Al2O3
②中发生的反应是Fe2O3+6HCl=2FeCl3+3H2O,MgO+2HCl=MgCl2+H2O
③中发生的反应是Fe+2FeCl3=3FeCl2,Fe+2HCl=FeCl2+H2↑
④中加入KSCN溶液不变色,说明Fe3+完全被还原为Fe2+,溶液D为MgCl2、FeCl2的混合液。根据题
意假设20g A中MgO和Fe2O3的物质的量均为x,则:40g·mol-1 x+160 g·mol-1 x=20g,解得x=0.1mol。
溶液中Mg2+的物质的量等于MgO的物质的量,c(Mg2≠)=![]() =0.67 mol·L-1
=0.67 mol·L-1
反应后原加入的盐酸中的Cl-全部转移到FeCl2和MgCl2中,Cl-守恒,所以溶液D中
n(Cl-)=n(Mg2+)×2+n(Fe2+)×2= 6.0mol·L-1×0.15 L=0.9mol
n(Fe2+)=![]() =0.35mol
=0.35mol
所以c(Fe2+)=![]() =2.3 mol·L-1
=2.3 mol·L-1
答案:(1)加少量KClO3,插上镁条并将其点燃;Fe(2)Fe2O3+6HCl=2FeCl3+3H2O,MgO+2HCl=MgCl2+H2O(3)Fe+2H+=Fe2++H2↑;Fe+2Fe3+=3Fe2+(4)0.67 mol·L-1;2.3 mol·L-1
【例3】某化学课外小组用海带为原料制取了少量的碘水。现有CCl4从碘水中萃取碘并用分液漏斗分离出两种溶液。其实验操作可分解为如下几步:
(A)把盛有溶液的分液漏斗放在铁架台的铁圈中;(B)把50mL碘水和15mLCCl4加入分液漏斗中,并盖好玻璃塞;(C)检验分液漏斗活塞上的玻璃塞是否漏液;(D)倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;(E)旋开活塞,用烧杯接收溶液;(F)从分液漏斗的上口倒出上层水溶液;(G)将漏斗上口的玻璃塞打开,使凹槽对准小孔;(H)静置,分层。
(1)正确的操作顺序是: _____→_____→_____→(A)→(G)→_____→(E)→(F)。(用编号字母填写)。
(2)上述(E)步骤的操作应注意:________________________________________。
上述(G)步骤操作的目的是_____________________________________________。
(3)能用CCl4萃取碘的原因是__________________________________________。
(4)下列物质,不能用作从溴水中萃取溴的溶剂是____________。
(A)苯(B)四氯化碳 (C)酒精(D)碘化钾
解答:⑴(C)(B)(D)(A)(G)(H)(E)(F) ⑵使漏斗下端管口紧靠烧杯内壁,及时关闭活塞,不让上层液体流出使漏斗内外空气相通,以保证进行E操作时漏斗里液体能顺利流出⑶CCl4与水互不相溶,而且碘在CCl4中的溶解度比在水中的大得多⑷苯及四氯化碳都是典型的有机溶剂,都能溶解溴,且都不溶于水,因而都可做溴的萃取剂,而酒精、碘化钾都溶于水,不能与水分层,所以不能做溴水的萃取剂,选(C)、(D)。
知能训练
一、选择题
1、我国古代湿法炼铜的反应原理是( )
A、![]() B、
B、![]()
C、![]() D、
D、![]()
2、人类历史上大量生产和使用铝、钛、铁、铜四种金属单质的时间顺序是( )
A、铜、铁、铝、钛 B、铁、铝、钛、铜
C、铜、铁、钛、铝 D、铁、铜、铝、钛
3、某地区一座大型钢铁厂搬迁后,附近居民将不再受到该厂生产的红棕色烟雾的困扰。你估计这一空气污染物中可能含有( )
A、FeO粉尘 B、![]() 粉尘 C、
粉尘 C、![]() 粉尘 D、
粉尘 D、![]() 粉尘
粉尘
4.在冶金工业上,均不能用通常化学还原剂制得的一组金属是( )
A.Na、Mg、Al B.Na、K、Zn、Fe
C.Zn、Fe、Cu、Ag D.Mg、Al、Zn、Fe
5.单质A从B的盐溶液中置换出单质B,则下列说法中不正确的是( )
A.当A、B都是金属时,A一定比B的金属活动性强
B.当A、B都是非金属时,A一定比B的非金属活动性强
C.当A是金属时,B可能是金属,也可能是非金属
D.当A是非金属时,B可能是金属,也可能是非金属
6.海水中含有氯化镁,是镁的重要来源之一。从海水中提取镁,可按照如下步骤进行:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶、过滤、干燥产物;④将所得的产物熔融后电解。关于提取镁,下列说法不正确的是( )
A.此法的优点之一是原料来源丰富
B.进行①、②、③步操作的目的是从海水中提取氯化镁
C.第④步电解时会产生氯气
D.以上提取镁的过程中涉及的反应有分解反应、化合反应和复分解反应
7.化学“家庭小实验”是利用家庭日常生活用品进行化学学习和探究的活动。下列实验能利用家庭日常生活用品进行的实验是( )
①证明马铃薯中含有淀粉;②除去热水瓶中的水垢;③检验自来水是否为硬水;④淀粉溶液具有丁达尔现象
A.①②③④ B. ①③④ C. ①②③ D. ①②④
8.已知在溶液中IO3-可和I-发生反应:![]() +5I-+6H+=3I2+3H2O,根据此反应,可用试纸和一些生活中常见的物质进行实验,证明在食盐中存在
+5I-+6H+=3I2+3H2O,根据此反应,可用试纸和一些生活中常见的物质进行实验,证明在食盐中存在![]() 。可供选用的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀粉试纸;④淀粉;⑤食糖;⑥食醋;⑦白酒。进行上述实验时必须使用的物质是( )
。可供选用的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀粉试纸;④淀粉;⑤食糖;⑥食醋;⑦白酒。进行上述实验时必须使用的物质是( )
A.①③ B.③⑥ C.②④⑥ D.①②④⑤⑦
9、在炼铁和炼钢的过程中都有碳参加反应,下列有关碳参加反应的叙述错误的是( )
A、两个过程中,碳原子都是被氧化,都只起着供热源的作用
B、炼铁过程中碳被氧化,既起产生热量的作用,又起产生一氧化碳的作用
C、炼钢过程中,碳参加反应,从而达到降低含碳量的作用
D、炼钢过程中,碳作还原剂,被氧化
10、下列变化属于化学变化的是( )
A、干馏 B、分馏 C、蒸馏 D、萃取
11、下列金属中,既可以用解法,又可以用电解法制取的是( )
A、Na B、Fe C、Ag D、Cu
12、甲、乙、丙三种溶液中各有一种![]() (
(![]() 为
为![]()
![]() 或
或![]() )离子,向甲中加入淀粉溶液和氯水,溶液变为橙色,再加丙溶液,颜色无明显变化,则甲、乙、丙依次含有( )
)离子,向甲中加入淀粉溶液和氯水,溶液变为橙色,再加丙溶液,颜色无明显变化,则甲、乙、丙依次含有( )
A、![]()
![]()
![]() B、
B、![]()
![]()
![]() C、
C、![]()
![]()
![]() D、
D、![]()
![]()
![]()
13、Mg、Al两种金属分别跟同体积,同浓度的稀硫酸反应,同温同压下生成氢气的体积相同,则Mg、Al两种金属之间的量的关系一定正确的是( )
A、两个反应电子转移数目相等 B、加入Mg、Al的质量比为4:3
C、金属溶解的物质的量相等 D、加入的两种金属质量不等
二、填空题
14、在使用蒸馏烧瓶蒸发液体时,通常要放少量 ,以防止 。蒸馏烧瓶中所所盛放的液体不能超过蒸馏烧瓶容积的 ,不少于 。
15.铜在自然界多以+1价矿石存在,因为在固态特别是高温下+1价铜的化合价比+2价稳定。从辉铜矿(Cu2S)炼铜的方法之一是:将矿石高温通空气焙烧,生成两种氧化物。将焙烧过的矿石加上比它质量约少一半的未经焙烧的矿石,混合后隔绝空气再进行高温燃烧,结果得到金属铜和一种具有刺激性气味的气体。这两个反应的化学方程式为:
________________________________, __________________________。
16、海洋植物如海带、海藻中含有丰富的碘元素.碘元素以碘离子的形式存在.实验室里从海
藻中提取碘的流程如下图:
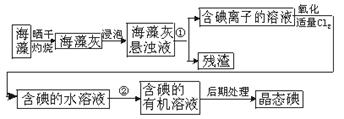
(1)指出制取碘的过程中有关的实验操作名称:
①________________________________________________________________________.
②________________________________________________________________________.
(2)提取碘的过程中.可供选择的有机试剂是_______________.
A.甲苯、酒精 B.四氯化碳、苯 C.汽油、乙酸 D.汽油、甘油
(3)为使海藻灰中碘离子转化为碘的有机溶液.实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品.尚缺少的玻璃仪器是____________.
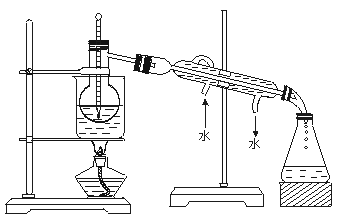
(4)从含碘的有机溶液中提取碘和回收有机溶液.还需要经过蒸馏.观察上述实验装置指出
其错误之处.并加以改正。
(5)进行上述蒸馏操作时.使用水浴的原因是________________________________.最后晶
态碘在______________里聚集。
17、“卤块”的主要成分为MgCl2(含Fe2+、Fe3+、Mn2+等杂质离子)。若以它为原料,按如下工艺流程图,即可制得“轻质氧化镁。”如果要求产品尽量不含杂质离子,而且成本较低。流程中所用试剂或pH值控制可参考下列附表确定。
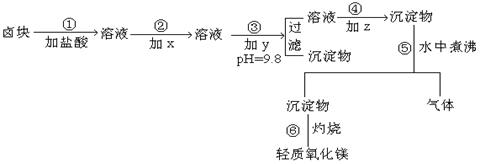
表1: 生成氢氧化物沉淀的pH值
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6* |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
*)注:Fe2+氢氧化物呈絮状,不易从溶液中除去。所以常将它氧化成为Fe3+ ,生成Fe(OH)3沉淀而去除之。
表2: 化学试剂价格表
| 试剂 | 价 格 (元/吨) |
| 漂液(含NaClO 25.2%) | 450元 |
| H2O2(30%) | 2400元 |
| NaOH(固 98%) | 2100元 |
| Na2CO3 (固 99.5%) | 600元 |
| 卤块(MgCl2 , 30%) | 310元 |
请填写出以下空白:
(1)在步骤②加入的试剂X,最佳选择应是 ,其作用是 。
(2)在步骤③加入的试剂Y应是 ;之所以要控制pH=9.8,其目的是 。
(3)在步骤⑤时发生的化学反应方程式是: 。
参考答案:
1、C2、A3、C4、A5、D6、D7、A8、B9、A10、A11、C12、A13、A
14、碎瓷片,暴沸 ,2/3 ,1/3
15、 Cu2S+O2![]() Cu2O+SO2
Cu2O+Cu2S
Cu2O+SO2
Cu2O+Cu2S![]() 6Cu+SO2↑
6Cu+SO2↑
16、(1)①过滤 ②萃取和分液(2)B (3)漏斗、分液漏斗(4)①缺石棉网 ②
温度计的水银球不应插入液体中 ③冷凝管进出水的方向颠倒。(5)使蒸馏瓶均匀受热、控制温度不过高 蒸馏烧瓶
17、(1)漂液(NaClO),其作用是将亚铁离子氧化成铁离子。
(2)在步骤③加入的试剂y应是NaOH,之所以要控制PH=9.8,其目的使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀以便过滤除去
(3)在步骤⑤时发生的化学反应方程式是:MgCO3+H2O ![]() CO2↑+
Mg(OH)2↓
CO2↑+
Mg(OH)2↓