第三章 有机化合物
第五讲 章末总结与测试
本章测试目标:
1、通过实践活动掌握甲烷的结构式和甲烷的正四面体结构,通过实验探究理解并掌握甲烷的取代反应原理。
2、掌握烷烃、同系物、同分异构体、同分异构现象等概念
3、掌握乙烯、乙炔和苯的化学性质。掌握烷烃与烯、炔烃;芳香烃与烯、炔烃的鉴别方法
4、利用模型了解乙烯和苯的结构,知道物质的结构决定了物质的性质这一基本原理。从乙烯的性质学会推导乙炔的化学性质。分析苯和烯的结构,认识到苯的性质与烯烃的在性质上有哪些异同点
5.了解认识乙醇和乙酸在日常生活、工农业生产、科学研究等方面的重要作用;
6.糖类和蛋白质的特征反应、糖类和蛋白质的检验方法;糖类、油脂和蛋白质的水解反应。
本章知识总结
1. 有机物概述
(1)有机物含义:__________________。
(2)有机物的主要特点是:溶解性:________ 热稳定性:_______可燃性:__________导电性 :_________熔点: _______ 是否电解质:____________相互反应速度:____________。
(3)有机物结构:大多数有机物分子里的碳原子跟其它原子经常以______键结合
2. 甲烷、乙烯、苯、乙醇、乙酸的结构
| 甲烷 | 乙烯 | 苯 | 乙醇 | 乙酸 | |
| 化学式 | |||||
| 电子式 | |||||
| 结构式 | |||||
| 结构简式 | |||||
| 空间结构 |
3. 甲烷、乙烯、苯、乙醇、乙酸的物理性质
| 甲烷 | 乙烯 | 苯 | 乙醇 | 乙酸 | |
| 色 | |||||
| 态 | |||||
| 味 | |||||
| 溶解性 | |||||
| 密度 |
4. 烷烃的通式及烷烃的相似性和物理性质的递变性
烷烃的通式:__________________。
烷烃物性的递变 状态:__________________。
熔沸点:__________________。
5.甲烷、乙烯、苯、乙醇、乙酸、乙醛的化学性质
| 有机物 | 官 能 团 | 化 学 性 质(写出化学方程式) |
| 甲烷 | ① ② | |
| 乙烯 | ① ② | |
| 苯 | ① ② | |
| 乙醇 | ① ② ③ | |
| 乙酸 | ① ② | |
| 乙醛 | ① |
6. 有机反应的类型
(1)取代反应
定义: 有机物分子里的某些原子或原子团被其它原子或原子团所代替的反应
特点:___________________。
①卤代反应(写出下列反应的化学方程式)
甲烷与氯气在光照下反应:___________________。 苯与溴,铁屑反应 ________________。
②硝化反应:苯与浓硝酸,浓硫酸在50~60℃共热________________。
③酯化反应:乙酸和乙醇在浓硫酸催化下反应______________。
④酯的水解反应:乙酸乙酯的酸性水解 ______________。
(2)加成反应
定义:有机分子里的不饱和碳原子跟其它原子或原子团直接结合生成别的物质的反应。特点:________________。
①与氢加成:乙烯和氢气____________。苯和氢气__________。
②与卤素加成:乙烯和氯气________________。
③与卤化氢:乙烯和氯化氢________________。
(3)其它反应类型
①氧化反应: 有机物的燃烧,及使高锰酸钾溶液褪色的反应
乙醇的燃烧________________。
乙醇的催化氧化________________。
②聚合反应:制备聚乙烯________________。
7.同系物和同分异构体
| 定义 | 分子式表示 | 特点 | 类 别 | 性 质 | |
| 同系物 | 同: 不同: | ||||
| 同分异 构体 | 同: 不同: | ||||
| 同素异 形体 | 同: 不同: | ||||
| 同位素 | 同: 不同: |
8. 糖类、油脂和蛋白质
| 有机物 | 结构特点 | 主要化学性质 | 用 途 | ||
| 糖 类 | 单糖 | 葡萄糖 | |||
| 双糖 | 蔗糖 | ||||
| 多糖 | 淀粉 | ||||
| 纤维素 | |||||
| 油脂 | |||||
| 蛋白质 | |||||
糖类、蛋白质的特征反应
| 葡萄糖 | ① ② |
| 淀粉 | |
| 蛋白质 | ① ② |
9. 有机实验---物质的鉴别
1、 溴水:①不褪色___________②褪色____________可能发生加成,氧化,取代反应。
2、 酸性高锰酸钾溶液:① 不褪色 __________ ② 褪色______。
3、 新制氢氧化铜溶液
① H+ : _________② H-C=O : __________。
4、 银氨溶液:H-C=O、 醛类。
5、 金属钠产生氢气 : ______。
注意:凡为水溶液因为溶剂水与金属钠反应放出氢气,故不可使用.
考题回顾
【例1】(2004理综Ⅲ-11)若1 mol某气态烃CxHy完全燃烧,需用3 mol O2,则 ( )
A. x=2,y=2 B. x=2,y=4 C. x=3,y=6 D. x=3,y=8
解析:按照烃燃烧的耗氧量可知:x+ =3,4x+y=12,只有当x=2,y=4,此式成立。
【例2】(2000上海32)美籍埃及人泽维尔用激光闪烁照相机拍摄到化学反应中化学键断裂和形成的过程,因而获得1999年诺贝尔化学奖。激光有很多用途,例如波长为10.3微米的红外激光能切断B(CH3)3分子中的一个B—C键,使之与HBr发生取代反应:B(CH3)3+HBr B(CH3)2Br+CH4 而利用9.6微米的红外激光却能切断两个B—C键,使之与HBr+CH4 ,而利用9.6微米的红外激光却能切断两个B—C键,并与HBr发生二元取代反应。
(1)试写出二元取代的代学方程式: ________________________________________。
(2)现用5.6g B(CH3)3和9.72g HBr正好完全反应,则生成物中除了甲烷外,其他两种产物的物质的量之比为多少?
解析:(1)B(CH3)3+2HBr B(CH3)Br2+2CH4 (2)n[B(CH3)3]= n(HBr)=
设生成B(CH3)2Br为a mol B(CH3)Br2为b mol
则: a+b=0.1 a=0.08mol
a+2b=0.12 b=0.02mol
n[B(CH3)Br]:n[B(CH3)Br2]=4:1
【例3】白酒、食醋、蔗糖、淀粉等均为家庭厨房中常用的物质,利用这些物质能完成的实验是
① 检验自来水中是否含氯离子 ② 鉴别食盐和小苏打
③ 蛋壳能否溶于酸 ④ 白酒中是否含甲醇
A. ①② B. ①④ C. ②③ D. ③④
解析:检验自来水中是否含氯离子需要硝酸银溶液和稀硝酸。鉴别食盐和小苏打可利用NaHCO3能与酸反应放出气体而食盐不能。蛋壳的成分是碳酸盐,能溶于酸并放出气体。甲醇可用氧化为甲醛来检验。上述所给物质中,食醋是酸,可用来检验②③。应选C。
【例4】(2004江苏化学)石油化工是江苏省的支柱产业之一。聚氯乙烯是用途十分广泛的石油化工产品,某化工厂曾利用下列工艺生产聚氯乙烯的单体氯乙烯:
CH2=CH2+Cl2 ® CH2Cl—CH2Cl ①
CH2Cl—CH2Cl ® CH2=CHCl+HCl ②
请回答以下问题:
(1) 已知反应中二氯乙烷的产率(产率=![]() ×100%)为98%,反应中氯乙烯和氯化氢的产率均为95%,则2.8 t乙烯可制得氯乙烯
t,同时得到副产物氯化氢
t。(计算结果保留1位小数)
×100%)为98%,反应中氯乙烯和氯化氢的产率均为95%,则2.8 t乙烯可制得氯乙烯
t,同时得到副产物氯化氢
t。(计算结果保留1位小数)
(2) 为充分利用副产物氯化氢,该工厂后来将下列反应运用于生产:
CH2=CH2+4HCl+O2 ® 2CH2Cl—CH2Cl+2H2O ③
由反应①、③获得二氯乙烷,再将二氯乙烷通过反应②得到氯乙烯和副产物氯化氢,副产物氯化氢供反应③使用,形成了新的工艺。
由于副反应的存在,生产中投入的乙烯全部被消耗时,反应①、③中二氯乙烷的产率依次为a%、c%;二氯乙烷全部被消耗时,反应②中氯化氢的产率为b%。试计算:反应①、③中乙烯的投料比为多少时,新工艺既不需要购进氯化氢为原料,又没有副产物氯化氢剩余(假设在发生的副反应中既不生成氯化氢,也不消耗氯化氢)。
解析:
(1) 5.8;3.4
(2) 设投入反应①、③的乙烯物质的量分别为x、y,则:
由反应①生成的二氯乙烷为x·a%,
由反应③生成的二氯乙烷为y·c%。
则由反应①、③共制得二氯乙烷的物质的量为(x·a%+y·c%),通过反应②可获得HCl的物质的量为(x·a%+y·c%)·b%。
据题意,反应③消耗的HCl为2y·c%,则:
2y·c%=(x·a%+y·c%)·b%
解得:![]() =
=![]()
反应中乙烯的投料比应为![]() 。
。
单元过关测试
一、选择题(本题共18个小题,每小题3分,共54分。)
1、某烷烃含200个氢原子,则该烃的分子式是A.C97H200 B.C98H200 C.C99H200 D.C100H200
2、可燃冰是天然气与水相互作用形成的晶体物质,主要存在于冻土层和海底大陆架中。
据测定每0.1m3固体“可燃冰”要释放20m3的甲烷气体,则下列说法中不正确的是( )
A.“可燃冰”释放的甲烷属于烃 B.“可燃冰”是水变油,属于化学变化
C.“可燃冰”将成为人类的后续能源 D.青藏高原可能存在巨大体积的“可燃冰”
3、青苹果汁遇碘溶液显蓝色,熟苹果能还原银氨溶液。这说明 ( )
A. 青苹果中只含淀粉不含糖类 B. 熟苹果中只含糖类不含淀粉
C. 苹果成熟时淀粉水解为单糖 D. 苹果成熟时单糖聚合成淀粉
4、等质量的下列烃完全燃烧,消耗氧气最多的是A.CH4 B.C2H6 C.C3H6 D.C6H6
5、蔬菜、水果中富含纤维素,纤维素被食入人体后在作用是 ( )
A.为人体内的化学反应提供原料 B.为维持人体生命活动提供能量
C.加强胃肠蠕动,具有通便功能
D.人体中没有水解纤维素的酶,所以纤维素在人体中没有任何作用
6、使1mol乙烯与氯气发生完全加成反应,然后使该加成反应的产物与氯气在光照条件
下发生取代反应,则两个过程中消耗氯气的总的物质的量是
A.3mol B.4mol C.5mol D.6mol
7、可以鉴别乙酸溶液、葡萄糖溶液、蔗糖溶液的试剂是 ( )
A.银氨溶液 B.新制氢氧化铜悬浊液 C.石蕊试液 D.碳酸钠溶液
8、现有一瓶乙二醇和丙三醇的混合物,已知它们的性质如下表,据此,将乙二醇和丙三醇互相分离的最佳方法是 ( )

A.萃取法 B.结晶法 C.分液法 D.分馏法
9、下列物质中能使酸性高锰酸钾溶液褪色的是
A.乙烯B.乙烷 C.乙醇 D.乙酸
10、法国化学家伊夫·肖万获2005年诺贝尔化学奖。他发现了烯烃里的碳-碳双键会被
拆散、重组,形成新分子,这种过程被命名为烯烃复分解反应 。烯烃复分解反应可形象地描述为交换舞伴。(如图所示)
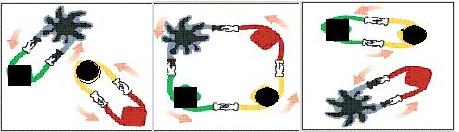
烯烃复分解反应中的催化剂是金属卡宾(如CH2==M),金属卡宾与烯烃分子相遇后,两对舞伴会暂时组合起来,手拉手跳起四人舞蹈。随后它们“交换舞伴”,组合成两个新分子,其中一个是新的烯烃分子,另一个是金属原子和它的新舞伴。后者会继续寻找下一个烯烃分子,再次“交换舞伴”。把C6H5CH2CH==CH2与CH2==M在一定条件下混合反应,下列产物不可能存在的是 ( )
A.C6H5CH2CH==M B.CH2= CH2 C.C6H5CH2 CH2 C6H5 D.C6H5CH2CH==CH CH2 C6H5
11、下列物质属于同分异构体的一组是 ( )
A.麦芽糖和蔗糖
B.![]() 与 CH3-CH2-CH2-CH3
与 CH3-CH2-CH2-CH3
C.C2H6与C3H8 D. O2与O3
12、两种气态烃组成的混合气体0.1mol,完全燃烧得0.16molCO2和3.6g水,下列说法
正确的是 ( )
A.混合气体中一定有甲烷 B.混合气体中一定是甲烷和乙烯
C.混合气体中一定没有乙烷 D.混合气体中一定有乙炔(CH≡CH)
13、1866年凯库勒提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,
但还有一些问题尚未解决,它不能解释下列事实 A.苯不能使溴水褪色
B苯能与H2发生加成反应 C.溴苯没有同分异构体 D.邻二溴苯只有一种
14、下列各选项中两种粒子所含电子数不相等的是 ( )
A.羟甲基(-CH2OH)和甲氧基(CH3O-)B.亚硝酸(HNO2)和亚硝酸根(NO2—)
C.硝基(-NO2)和二氧化氮(NO2)D.羟基(-OH)和氢氧根(OH-)
15、酯化反应是有机化学中的一类重要反应,下列对酯化反应理解不正确的是 ( )
A.酯化反应的产物只有酯 B.酯化反应可看成取代反应的一种
C.酯化反应是有限度的 D.浓硫酸可做酯化反应的催化剂
16、大气污染物氟里昂—12的化学式是CF2Cl2。下面关于氟里昂—12的说法正确的是
A.没有固定的熔沸点 B.分子中的碳原子是饱和的
C.属于正四面体的空间结构 D.是甲烷的一种同系物
17、下列各组中,不管以何种比例混合,只要总质量一定,充分燃烧后生成的二氧化碳
的量不变的是
A.乙炔(C2H2)和苯(C6H6) B.乙醇和丙醇(CH3CH2CH2OH)
C.乙醇和乙醚(C2H5OC2H5) D.甲醛( HCHO)和乙酸
18、两种气态烃以任意比例混合,在105℃时1 L该混合烃与9 L氧气混合,充分燃烧后
恢复到原状态,所得气体体积仍是10 L。下列各组混合烃中不符合此条件的是 ( )
A.CH4 C2H4 B.CH4 C3H6 C.C2H4 C3H4 D.C2H2 C3H6
二、选择题(本题共3个小题,共31分)
19、(8分)据报道,某煤矿井下采煤面瓦斯突出,发生爆炸,当场造成56人死亡,92
人生死不明。截至记者发稿时,经过全力搜救,目前又发现4名遇难矿工遗体,死亡人数增加至60人。其中,55人系窒息死亡。目前,尚有88名矿工下落不明。根据以上信息回答下列问题:
(1)写出瓦斯爆炸的化学方程式 。
(2)可燃性气体的爆炸都有一个爆炸极限,所谓爆炸极限是指可燃气体(或蒸汽或粉尘
等)与空气混合后,遇火产生爆炸的最高或最低浓度(通常以体积百分数表示)。下表是甲烷在空气和纯氧气中的爆炸极限。
| 空气中 | 纯氧气中 | |
| 甲烷的爆炸极限 | 5.0~15% | 5.0~60% |
下面是瓦斯和空气组成的混和气体中瓦斯的体积含量,从是否能够爆炸方面考虑,请判断哪些是不安全的 。
A.3% B.10% C.30% D.60%
(3)请分析人为什么在瓦斯爆炸的矿中会窒息死亡:
。
(4)由矿井中的瓦斯爆炸,根据你的化学实验经验,你可以得出什么启示?(提示:对
可燃性气体的加热、点燃操作应该注意的问题) 。
20、 (16分) “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用右图所示的装置制取乙酸乙酯。回答下列问题:
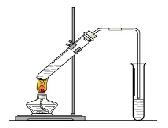
(1)写出制取乙酸乙酯的化学反应方程式 。
(2)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是: 。
(3)浓硫酸的作用是:① ;② 。
(4)饱和碳酸钠溶液的主要作用是 。
(5)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止 。
(6)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
(7)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是 。
(8)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,
就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
21、(7分)(1)无水乙酸又称冰醋酸(熔点16.6℃)。在室温较低时,无水乙酸就会凝
结成像冰一样的晶体。请简单说明在实验中若遇到这种情况时,你将如何从试剂瓶中取出无水乙酸? 。
(2)某有机物的结构简式为HOOC—CH=CHOH。
①请你写出该有机物官能团的名称: 、 、 。
②验证该有机物中含有-COOH官能团常采用的方法是 ,
产生的现象为 。
三、计算题(本题两个小题,共15分)
22、(8分)吗啡和海洛因都是严格查禁的毒品,吗啡分子含C:71.58%、H:6.67%、N:4.91%、其余为O。已知其相对分子质量不超过300。试求:
(1)啡的相对分子质量__________;
(2)吗啡的化学式 ;
已知海洛因是吗啡的二乙酸酯。试求:
(3) 洛因的相对分子质量 ;(4)海洛因的化学式 .
23、(7分)有机物A由碳、氢、氧三种元素组成。现取2.3 g A与2.8 L氧气(标准状
况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余)。将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重2.7 g,碱石灰增重2.2 g。回答下列问题:
(1)2.3 g A中所含氢原子、碳原子的物质的量各是多少?
(2)通过计算确定该有机物的分子式。
参考答案
一、选择题(本题共18个小题,每小题3分,共54分。)
1、 C 2、B 3、C 4、A 5、C 6、 C 7、 B 8、 B9、AC 10、D 11、AB 12、AC 13、AD 14、D 15、A 16、B 17、AD 18、BD
二、选择题(本题共3个小题,共31分)
19(1)![]() ;(2)B;
;(2)B;
(3)从上述瓦斯爆炸的化学方程式可以看出这是一个耗氧性的反应,爆炸时耗尽了矿井的几乎所有的氧气,所以人在其中会窒息死亡;
(4)可燃性气体的加热、点燃操作前必须进行验纯操作。
20、(1)

(2)先在试管中加入一定量的乙醇,然后边加边振荡试管将浓硫酸慢慢加入试管,最后再加入乙酸。
(3)催化作用;吸水作用
(4)中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到酯。
(5)倒吸。(6)分液。(7)防止大试管中液体暴沸而冲出导管。(8)②④⑤
20、(1)有题意知冰醋酸熔点16.6℃,因此当无水乙酸凝结成像冰一样的晶体时,自然
想到升高温度让其熔化,方法多多:将其放置温度高于16.6℃的房间,或用热毛巾握持一会儿,或将其试剂浸入温水中。(2)①羟基、羧基、碳碳双键;②用少量的新制Cu(OH)2悬浊液;沉淀溶解。
三、计算题(本题两个小题,共15分)
22、(1)285(2)C17H19NO3(3)369(4)C21H23NO5
23、⑴解:n(O2)= ![]() = 0.125 mol
m(O2)= 0.125 mol×32g·mol-1= 4 g
= 0.125 mol
m(O2)= 0.125 mol×32g·mol-1= 4 g
n(H2O)=![]() = 0.15 mol n(CO2) =
= 0.15 mol n(CO2) = ![]() = 0.05 mol
= 0.05 mol
m(CO)= 4 g +2.3 g - 2.7 g - 2.2 g = 1.4 g n(CO)=
![]() = 0.05 mol
= 0.05 mol
n(H)=2n(H2O)= 0.15 mol×2= 0.3 mol
n(C)= n(CO2) + n(CO) = 0.05 mol + 0.05 mol = 0.1 mol
答:2.3 g A中所含氢原子、碳原子的物质的量分别为0.3 mol 和0.1 mol 。
⑵解:2.3 g A中所含氧原子:
n(O)=(0.05 mol×2 +0.05 mol + 0.15 mol)—0.125 mol×2 = 0.05 mol
n(C)∶n(H)∶n(O) =0.1 mol∶0.3 mol∶0.05 mol = 2∶6∶1
则A 的最简式为 C2H6O
根据价键规则 A 的分子式为 C2H6O 。答:A 的分子式为 C2H6O 。