2005年高三化学月考(II)试卷
注意事项:
1. 答题前,考生先将自己的姓名、考试号等填写清楚。
2. 本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共150分。选择题答案填在第Ⅱ卷前面的选择题答案栏中。
3. 考试时间120分钟。
可能用到的相对原子质量:Na-23 O-16 C-12 H-1 K-39 Cl—35.5 Fe—56 Cu—64 Ba—137
第Ⅰ卷(选择题 共74分)
一、选择题(本题包括8个小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1.1998年,中国十大科技成果之一是合成纳米氮化镓,其化学式应当是 ( )
A.GaN B.Ga2N3 C.Ga3N2 D.Ga5N3
2.IP产业中一些车间要求必须做到无尘生产,工人在车间内工作时的服装需经静电除尘处理。这种处理方法应用的原理是 ( )
A.胶体的丁达尔现象 B.胶体的布朗运动
C.胶体的电泳 D.渗析
3.测一种未知溶液的PH值时,若先用蒸馏水将PH试纸湿润,对实验结果产生的影响是( )
A.偏大 B.偏小 C.偏大或偏小 D.偏大或偏小或无影响
4.已知pOH=-lg[c(OH—)],又知正常人的血液PH=7.35。则此人血液的pOH值为 ( )
A.等于7.35 B.等于6.65 C.大于7.35 D.小于6.65
5.已知硫酸铜晶体的溶解过程是吸热的。把一小块缺角的硫酸铜晶体悬挂在饱和硫酸铜溶液中,过几天发现这块晶体变得完整无缺。若上述过程在温度不变的密闭系统内进行,则上述过程的热效应是 ( )
A.吸热的 B.放热的 C.基本无热量变化 D.无法判断
6.下列说法不正确的是: ( )
①质子数相同的粒子一定属于同种元素。
②同位素的性质几乎相同。
③只由一种元素构成的物质一定是纯净物。
④元素的相对原子质量近似值为该元素原子的质量数。
A.①②③ B.②③④ C.①②④ D.①②③④
7.有一瓶新制的氯水,将其均分为甲、乙、丙三份,甲中加少量NaHCO3粉末,乙中加少量NaHSO3粉末(与甲中NaHCO3等物质的量),丙不变。则甲、乙、丙中次氯酸的浓度大小关系是 ( )
A.甲=乙>丙 B.甲>丙>乙 C.丙>甲=乙 D.乙>丙>甲
8.下列叙述中正确的是 ( )
A.含有最高价元素的化合物都是具有强氧化性。
B.难失去电子的物质一定易得到电子。
C.金属元素从化合态变为游离态一定被还原。
D.强氧化剂与强还原剂混合一定发生氧化还原反应。.
二、选择题(本小题包括10小题,第9~16题每小题4分,第17、18题每小题5分,共42分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题为0分。)
9.实验室常用一定量的锌与稀硫酸反应制取氢气。要使该反应的速率减慢,但不影响生成氢气的总量,可向稀硫酸中加入 ( )
A.CuSO4(s) B.KNO3(s) C.CH3COONa(s) D.ZnSO4 溶液
10.下列离子方程式不正确的是 ( )
A.浓烧碱溶液中加入铝箔:Al+2OH—===AlO2—+H2↑
B.硫酸亚铁溶液中通入H2S气体:Fe2++H2S===FeS↓+2H+
C.碳酸氢镁溶液中加入足量烧碱溶液:Mg2++2HCO3—+4OH—===Mg(OH)2↓+CO32—+2H2O
D.NaHSO4溶液中加入足量Ba(OH)2溶液:H++SO42—+OH—+Ba2+===BaSO4↓+H2O
11.NH3、H2S是极性分子,而CO2、BF3、CCl4则是非极性分子。根据上述事实,以及你所掌握的化学知识,可分析归纳出ABn型分子是非极性分子的经验规律是 ( )
A.ABn型分子中B不能是氢原子。
B.ABn型分子中A原子最外层电子都参与成键。
C.在ABn型分子中,键与键的夹角都相等。
D.在ABn型分子中A与任意的B原子核间距离都相等。
12.有一些科学家预言,未发现的元素中还可能有稳定的超重元素存在。如Z=114,N==184的原子,它将位于元素周期表第七周期ⅣA族。下列关于该元素的进一步的推断中肯定错误的是 ( )
A. 该元素的原子具有七个电子层
B. 该元素最高正化合价为+6
C. 该元素的单质可能是良好的半导体材料
D. 该元素不可能与氢元素形成气态氢化物
13.小苏打溶液与下列溶液混合时,有离子反应发生,但既无气体生成也无沉淀生成的是( )
A.烧碱溶液 B.偏铝酸钠溶液 C.氯化铝溶液 D.苯酚钠溶液
14.在密闭容器中,aA(g) ![]() bB(g)反应达平衡后,保持温度和压强不变,通入与反应混合物等物质的量的稀有气体,重新达到平衡时,B的浓度是原平衡时的60﹪。下列说法正确的是
( )
bB(g)反应达平衡后,保持温度和压强不变,通入与反应混合物等物质的量的稀有气体,重新达到平衡时,B的浓度是原平衡时的60﹪。下列说法正确的是
( )
A.平衡向正反应方向移动 B.A的转化率减小
C.A的物质的量增加 D.a<b
15.t℃时,将一定量的不饱和KNO3溶液分为三等份,分别加热蒸发溶液,再把温度降至t℃。已知从三份溶液中蒸发出水的质量分别为x、y、z(单位均为g),析出KNO3晶体质量相应分别是1g、2g、3g。则x、y、z的关系是 ( )
A.x:y:z =1:2:3 B.z =x +y C.z =2 y-x D.z =2y + x
16.已知在水溶液中能发生下列反应: 2KXO3+Y2===2KYO3+X2 ,若其中X、Y表示不同的卤素,下列说法不正确的是 ( )
A.该反应属于置换反应 B.非金属性:X < Y
C.氧化性:XO3—>YO3— D.X2不可能是F2
17.在一定条件下,把a molX、b molY混合,发生反应:X(g)+3Y(g) ![]() 2Z(g)达到平衡时Z的体积分数是40﹪。则a:b的范围是
( )
2Z(g)达到平衡时Z的体积分数是40﹪。则a:b的范围是
( )
A.![]() B.
B.![]()
C.![]() 1
D.
1
D.![]()
18.将氢氰酸(HCN)与其对应的钠盐NaCN等物质的量混合,并配制成溶液,若混合液中
c (Na+)>c (CN—),则下列关系错误的是 ( )
A.c (OH—)<c (H+) B.c (HCN)<c (CN—)
C.c (CN—)+c (HCN)==2c (Na+) D.c (HCN)+c (H+)==c (Na+)+c (OH—)
第Ⅱ卷(非选择题 共76分)
三、(本题包括两小题,共15分)
19.(4分)为了证明醋酸是弱电解质进行的下列实验,肯定没有意义的是 ( )
A.测定冰醋酸和液态氯化氢的导电性。
B.测定0.1mol/L CH3COOH溶液的pH值。
C.测定0.1mol/L CH3COONa溶液的pH值。
D.比较相同物质的量浓度的盐酸和醋酸分别与锌反应产生氢气的速率。
E.比较中和相同物质的量浓度,相同体积的盐酸和醋酸溶液,耗用已知浓度的NaOH溶液的体积大小。
F.比较pH值相同的盐酸和醋酸溶液稀释相同倍数时,pH值变化程度的大小。
20.(11分)用中和滴定法测定某烧碱的纯度。请根据要求回答问题:
(1)配制待测溶液。将准确称量的4.10g固体烧碱(含有少量中性易溶杂质),配制成500mL待测液。其操作过程需要用到烧杯、玻璃棒,还必须用到的仪器有__________________。
(2)用0.20mol/L的盐酸来滴定待测液。滴定操作过程中左手操作是_____________________。眼睛观察________________________________________。
(3)将三次滴定的数据处理得实验结果。三次滴定时每次都取用待测液20.00mL。三次耗用盐酸溶液分别为20.05mL、23.80mL、19.95mL。烧碱样品的纯度是________﹪。
(4)实验误差分析。(下列每格填“偏高”或“偏低”或“正常”)
①配制待测溶液时,溶液转移后,烧杯未洗涤。__________________
②滴定开始前,锥形瓶用蒸馏水洗净后未干燥。___________________
③滴定过程中,锥形瓶中有少量溶液溅出瓶外。__________________
四、(本题包括两小题,共20分)
21.(6分)2004年7月,法俄两国科学家共同宣布,在高压下,氮气会聚合生成高聚氮。在这种高聚氮的晶体中,每个氮原子都通过三个单键与其它氮原子结合并向空间发展,构成立体网状结构。已知该晶体中N—N的键能为160KJ/mol,而氮气中N≡N的键能为942KJ/mol,(键能表示形成化学键释放的能量或破坏化学键消耗的能量)。
(1)高聚氮晶体属于___________晶体。
(2)高聚氮转化为氮气时,将_______(“吸收”或“放出”)能量,当生成1molN2时,能量变化是____________KJ。
22.(14分)氮可以形成多种离子,如N3—,NH2—,N3—,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+离子的形成过程与NH4+形成过程相类似。
⑴液氨中存在着与水类似的自偶电离,产生的离子是 (填上述离子中的两种)。223K时,这两种离子浓度的乘积 1×10—14。(填“大于”、“小于”或“等于”)
⑵写出N2H5+的电子式 。
⑶写出N2H62+在足量强碱溶液中反应的离子方程式
。
⑷写出三种多原子组成的含有与N3— 电子数相同的微粒化学式 。
![]() ⑸有一种离子化学式是:N5n+,电子式是
, 。
⑸有一种离子化学式是:N5n+,电子式是
, 。
其n的值是 ,该离子的空间构形是 。(A.直线型 B.“V”型
C.“W”型,用A、B、C填空)。
五、(本题包括2小题,共24分)
23.(16分)消毒剂在日常生活、医疗、卫生、防疫中都有着重要作用。
⑴下列消毒剂的使用正确的是
A. 预防“非典”常使用过氧乙酸、“84”消毒液、漂粉精等消毒剂。
B. 医疗上常用无水酒精或含H2O2 3﹪的双氧水进行皮肤消毒。
C. 因患“禽流感”而被捕杀的家禽尸体常用生石灰处理。
D. 食品加工、消毒、防腐常使用福尔马林。
E. 在农业上,常用硫酸铜、石灰和水配制的悬浊液来消灭病虫害。
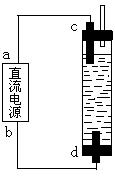 ⑵某学生制作了一种家用环保型消毒液发生器。装置如图所示:
⑵某学生制作了一种家用环保型消毒液发生器。装置如图所示:
用石墨作电极电解饱和食盐水,即可制得有较强杀菌能力的消毒液。请判断:在该装置中,b为电源的 极;
C电极上发生的电极反应式是
;
所得消毒液的主要成分是 。
⑶自来水厂常用液氯和绿矾(FeSO4•7H2O)进行消毒、净水。 绿矾所起的作用一是除去余氯;二是其氧化产物经水解后具有净水作用。请写出有关反应的离子方程式:
。
⑷现在一些大城市的自来水厂已经改用高铁酸钠(Na2FeO4)替代液氯和绿矾进行消毒净水。请简述高铁酸钠消毒、净水的原理:
。
24.(8分)据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱作电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的十倍,可连续使用1个月才充电一次。假设放电过程中甲醇完全氧化产生的CO2被充分吸收生成CO32—。
(1)该电池总反应的离子方程式是
(2)甲醇在 极发生反应,其电极反应式是
(3)若用16g甲醇氧化产生的电能电解足量的CuSO4溶液,整个过程能量的利用率为80%,则电解时将产生标准状况下的气体 L。
六、(本题包括2小题,共17分)
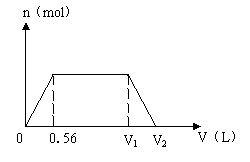 25.(8分)有一种含氢氧化钠和氢氧化钡的混和碱液的PH=14。取该溶液100mL,在标准状况下缓缓通入CO2(假设CO2发生反应时能被完全吸收),通入CO2气体的体积V(L)与生成沉淀的物质的量n(mol)之间的关系,符合下列图像:
25.(8分)有一种含氢氧化钠和氢氧化钡的混和碱液的PH=14。取该溶液100mL,在标准状况下缓缓通入CO2(假设CO2发生反应时能被完全吸收),通入CO2气体的体积V(L)与生成沉淀的物质的量n(mol)之间的关系,符合下列图像:
(1)求100mL混合碱液中含氢氧化钠的物质的量。
(2)求V1、V2的值。
26.(9分)用FeCl3溶液腐蚀敷有铜箔的绝缘板,可制成印刷线路板。发生的反应是:
2FeCl3 + Cu===2FeCl2 + CuCl2
现将一块敷有铜箔的绝缘板浸入200mL FeCl3溶液中,一段时间后取出,再加入铁粉A g(足量),充分反应后滤出固体,经洗涤,干燥后称量,残留固体质量为B g。再从滤液中取出20.00mL(上述有关反应不考虑溶液体积的变化),滴入0.60mol/L AgNO3溶液100mL,恰好将溶液中的氯离子沉淀完全。
求:⑴原FeCl3溶液的物质的量浓度。
⑵B的取值范围(用含A的代数式表示)。
⑶若A-B = 5.0,则线路板上被腐蚀的铜的质量。
2005年高三化学月考(II)试卷答案及评分标准
选择题(每题4分,17、18题各5分,共74分。有两个答案的漏选得2 分,错选不得分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| A | C | D | D | C | D | B | C | C、D |
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| A、B | B | B、C | A | A、D | D | B | D | A、B |
19、A、E 共4分。漏选得2分,错选倒扣分,本题不出现负分。
20、⑴500mL容量瓶,胶头滴管。共2分。
⑵控制酸碱滴定管活塞;锥行瓶中溶液颜色变化,判断滴定终点。共4分。
⑶97.56﹪(或97.6﹪)。共2分。
⑷①偏低 ②正常 ③偏低 共3分。
21、⑴ 原子 ⑵放出 ⑶462 每空2分,共6分。
22、⑴NH4+ NH2- 小于 共4分

⑵ (共2分)
⑶N2H62++2OH-===N2H4+2H2O (共2分)
⑷CO2 HN3 N2O 共3分。其它合理答案同样给分。
⑸ 1 (1分) B (2分) 共3分。
23、⑴A,C,E 共3分,每漏选1个扣1分,错选倒扣分,本题不得负分。
⑵正 (1分), 2H++2e-===H2↑(2分), NaClO(或ClO-) (2分) 共5分。
⑶Cl2 +2Fe2+ ===2Cl- +2Fe3+ , Fe3+ +3H2O ![]() Fe(OH)3+3H+ 共4分
Fe(OH)3+3H+ 共4分
⑷高铁酸钠具有强氧化性,故可用于消毒。 2分
高铁酸钠还原产物为Fe3+,Fe3+水解产物Fe(OH)3吸附水中悬浮杂质,具有净水作用。(2分) 共4分。
24、⑴ 2CH3OH + 3O2 + 4OH- === 2CO32- + 6H2O (共2分)
⑵负 (1分) CH3OH-6e-+8OH-===CO32-+6H2O (2分) 共3分。
⑶13.44 (3分)
25、⑴ ∵pH==14,
∴c(OH-) ==1mol/L. (1分)
n[Ba(OH)2] ==n(BaCO3)
==![]() ==0.025mol
==0.025mol
n(NaOH) ==0.1L×1mol/L-0.025mol×2==0.05mol (2分) 共3分
⑵ 通入CO2气体V1L时,生成了0.025molBaCO3沉淀。
溶液中溶质为0.05molNaHCO3。
V1==(0.025mol+0.05mol)×22.4L/mol==1.68L (3分)
通入CO2 V2L时,溶液中溶质为0.05molNaHCO3、0.025mol Ba(HCO3)2,
V2==(0.05mol+0.025mol×2)×22.4L/mol==2.24L (2分) 共5分。
26、⑴ ∵Ag++Cl-====AgCl↓
∴20mL滤液中含有Cl-为:
n(Cl-) ==n(Ag+)==0.60mol/L×0.1L==0.06mol
原FeCl3溶液中,n(FeCl3) ==![]() n(Cl-) ==0.06mol×
n(Cl-) ==0.06mol×![]() ==0..2mol
==0..2mol
C(FeCl3) ==![]() ==1mol/L
共3分。
==1mol/L
共3分。
⑵由⑴计算知:n(FeCl3) ==0.2mol
若铜尚未溶解,耗铁0.1mol,固体减重5.6g。
若最多溶解0.1mol铜后,耗铁仍为0.1mol,但有0.1mol铜生成,则固体增重:
6.4g-5.6g==0.8g,
∴B的酸值范围是:A-5.6 < B < A+0.8 共3分。
⑶由⑵计算得知,耗用铁为0.1mol,
则:5.6g-W(Cu) ==5.0g
W(Cu) ==0.6g 共3分。

|
|
|
|
|
|
| 题号 | 第Ⅰ卷 | 第Ⅱ卷 | 总分 | 结分人 | 复分人 | |||
| 一、二 | 三 | 四 | 五 | 六 | ||||
| 分数 | ||||||||
| 评卷人 | ||||||||
| 复合人 | ||||||||
 | |||||||||
| |||||||||
 | |||||||||
| |||||||||
| |||||||||