2005年高三化学月考(Ⅰ)试卷
化 学
注意事项:
1. 答题前,考生先将自己的姓名、考试证号等填写清楚,并认真核对答题卡表头及答题纸内规定填写或填涂的项目;
2. 答题应答在答题卡中规定的区域内,在草稿纸、试卷上答题无效;
3. 保持字迹工整、笔迹清楚;
4. 本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共150分,考试时间120分钟。
可能用到的相对原子质量:
Na-23.0 Cu-64.0 H-1.0 S-32.0 Cl-35.5 N-14.0
第Ⅰ卷(选择题 共74分)
一、选择题(本题包括8个小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1.为创建国家卫生城市,今年起在学校.商场等场所设置可回收垃圾箱。有些地方还专门设置了废电池回收箱,其主要目的在于 ( )
A.回收废电池的金属外壳材料
B.回收石墨电极
C.防止汞、镉、铅等重金属离子对土壤、水源的污染
D.防止废电池对大气造成光化学烟雾污染
2.下列说法正确的是 ( )
A.非金属氧化物都是酸性氧化物
B.只由一种元素组成的物质一定是纯净物
C.正盐中不可能含有氢元素
D.能电离产生H+的化合物不一定都是酸
3.下列物质不属于分散系,而是纯净物的是 ( )
A.Na2CO3·10H2O B.福尔马林 C.碘酒 D.氢氧化铁胶体
4.将足量的硅酸胶体,逐滴加入到氢氧化铁胶体中,其结果是 ( )
A.生成氢氧化铁沉淀 B.生成硅酸沉淀
C.生成氢氧化铁和硅酸沉淀 D.先生成沉淀后又逐渐溶解
5.2001年,美国的IBM公司制造出第一批纳米碳晶体管。下列有关说法正确的是
( )
A.纳米碳的化学性质很稳定
B.纳米碳是一种新型高分子化合物
C.纳米碳的导电过程发生化学变化
D.1nm = 10-10m
6.①HCO3-、OH- ②H2PO4-、PO43- ③HCO3-、AlO2- ④Fe3+、SCN-
⑤ClO-、SO32- 上述各组离子中不能在水溶液中大量共存的是 ( )
A.①② B.①③④
C.①④⑤ D.全部
7.下列分子中,每个原子最外层都是满足8电子稳定结构的是 ( )
A.HCN B.PCl5 C.NO2 D.CO2
8.质量分数为a%,物质的量浓度为c mol/L 的KOH溶液,蒸发溶剂,恢复到原来温度,若质量分数变为2a%,则物质的量浓度变为 ( )
A.等于2c mol/L B.大于2c mol/L
C.小于2c mol/L D.在c mol/L∽2c mol/L之间
二、选择题(本小题包括10小题,第9~16题每小题4分,第17、18题每小题5分,共42分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题为0分)
9.下列离子方程式书写正确的是 ( )
A.钠与水反应: Na+2H2O == Na++2OH-+H2↑
B.氯化铝溶液加过量氨水:Al3++4NH3·H2O == AlO2-+4NH 4++2H2O
C.石墨电极电解氯化镁溶液:2Cl-+2H2O ![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
D.碳酸氢镁溶液加过量氢氧化钡溶液:
Mg2++2HCO3-+2Ba2++4OH-== 2BaCO3↓+Mg(OH)2↓+2H2O
10.NA 表示阿伏加德罗常数,下列说法正确的是 ( )
A.0.1mol Na2O2与足量水反应转移的电子数为0.2 NA
B.8g石墨中含有共价键的数目为NA
C.标准状况下,1.12LCO2与SO2的混合气体中含有氧原子数为0.1NA
D.标准状况下,2.24L己烷含碳原子数目为0.6 NA
11.已知S、Cr两元素的最高价相同,试分析下列微粒中氧原子间可能存在非极性键的是 ( )
A.S2O32- B.S2O82- C.Cr2O72- D.CrO5
12.下列物质属于离子化合物,且阴、阳离子数目之比为1∶1的是 ( )
A.HCl B.H2O2 C.Na2O2 D.NH 4NO3
13.已知: 2 H2(g)+O2(g)== 2 H2O(l);△H=-571.6 kJ/mol,
CO(g)+![]() O2(g)== CO2(g);△H=-282.9 kJ/mol
O2(g)== CO2(g);△H=-282.9 kJ/mol
若H2、CO混合气完全燃烧放出113.74 kJ热量,同时生成3.6 g水,则混合气体中H2、CO分子数之比是 ( )
A.2∶1 B.1∶2
C.1∶1 D.2∶3
14.NaH是一种离子化合物,能与水反应生成氢气,也能与乙醇、液氨等反应生成氢气。
下列关于NaH的叙述正确的是 ( )
A.跟水反应时,水作氧化剂
B.NaH中阴离子半径小于Li+的半径
C.跟液氨反应除生成氢气外,还生成铵盐
D.与乙醇反应产生氢气的速率比与水反应更快
15.有A、B、C三种短周期元素,已知A元素原子最外层电子数等于其电子层数,B元素原子最外层电子数是其电子层数的2倍,C元素原子最外层电子数是其电子层数的3倍。这三种元素形成的化合物不可能是 ( )
A.A3BC4 B.A2(BC4)3 C.A2B2C2 D.A2BC4
16.X+ 、Y+ 、Z2-是三种主族元素形成的离子,X+ 与Z2-具有相同的电子层结构,Y和Z处于同一周期。下列说法正确的是 ( )
A.原子序数:X>Y>Z
B.原子半径:Y>Z>X
C.离子半径:Z2->X+>Y+
D.在不同条件下,X、Z两元素可能形成X2Z2和X 2Z两种化合物
17.等物质的量的A2、B2
在一定条件下反应:m A2(g)+
n B2(g)![]() p C(g)达到平衡时,测得C(A2)=0.9mol/L,C(B2)=0.1mol/L,C(C)=0.8mol/L,则C的化学式可能是
( )
p C(g)达到平衡时,测得C(A2)=0.9mol/L,C(B2)=0.1mol/L,C(C)=0.8mol/L,则C的化学式可能是
( )
A.A2B3 B.AB3 C.A2B4 D.A2B5
18.300K时,2SO2(g)
+ O2(g) ![]() 2SO3(g) ;△H=-196.6 kJ/mol。在一体积固定的密闭容器中通入2mol SO2、1mol O2,平衡时放出热量Q1 , SO2的转化率α1;在另一体积相同的密闭容器中通入 1mol SO2、0.5mol
O2,平衡时放出热量Q2
, SO2的转化率α2 。下列结论正确的是
( )
2SO3(g) ;△H=-196.6 kJ/mol。在一体积固定的密闭容器中通入2mol SO2、1mol O2,平衡时放出热量Q1 , SO2的转化率α1;在另一体积相同的密闭容器中通入 1mol SO2、0.5mol
O2,平衡时放出热量Q2
, SO2的转化率α2 。下列结论正确的是
( )
A.Q2< Q1<2Q2 α1<α2 B.Q1=196.6 kJ α1>α2
C.Q2 <98.3 kJ α1=α2 D.Q1>2Q2 α1>α2
第Ⅱ卷(非选择题 共76分)
三、(本题包括两小题,共19分)
|
![]()
① KClO3+ HCl == KCl+ Cl2↑+ H2O
② KClO3+ HCl == KCl+ Cl2↑+ ClO2↑+ H2O
⑵上述反应①中,电子转移的数目x= ;
上述反应②中,还原产物是 。
⑶已知ClO2是黄绿色气体,具有很强的氧化性,常被用作消毒剂。若在相同温度,相同压强下,利用反应①、②分别制得等体积的气体,两者消毒效率之比是 。
20.(9分)在标准状况下,将V LCl2通入体积为100mL,浓度是1mol/L的FeBr2溶液中。(已知氧化性:Br2>Fe3+)
⑴若V<1L,写出反应的离子方程式
。
⑵若V=2.24L,写出反应的离子方程式
。
⑶若反应后溶液中有![]() 的Br-被氧化,V= L。
的Br-被氧化,V= L。
四、(本题包括两小题,共22分)
21.(11分)A、B、C是三种分别属于不同周期的主族元素,原子半径C>A>B,A的+2价离子具有与氖原子相同的电子层结构,B元素的最高价氧化物对应水化物的酸性在所属周期中最强,C元素的族序数为A、B两元素的族序数之和。
⑴A元素位于周期表中 周期 族。
⑵写出B元素氢化物的电子式 ,该化合物具有易液化的性质,这是因为 。
⑶已知B、C两元素的氢化物相遇会产生大量白烟,写出其生成物的电子式
该化合物的晶体属于 晶体。
⑷写出A、B元素形成的化合物与足量盐酸反应的离子方程式
。
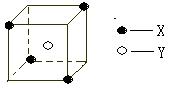 22.(11分)某离子晶体晶胞结构如图所示:
22.(11分)某离子晶体晶胞结构如图所示:
X位于立方体的顶点,Y位于立方体的中心。
⑴晶体中每个Y同时吸引着 个X,
每个X同时吸引着 个Y,
该晶体的化学式是 。
⑵晶体中每个X周围与它最接近且距离相等的X共有 个。
⑶该晶体的摩尔质量M g/mol,密度为ρg/cm3,阿伏加德罗常数为NA。晶体中两个距离最近的X之间距离为 cm。
⑷某气态分子也具有上述图形的空间结构,该分子的化学式是 , 图形中∠XYX的度数是 。该分子是以 键结合成的 分子(填“极性”“非极性”)。
五、(本题包括2小题,共21分)
23.(10分)⑴已知:Fe3O4可改写为FeO· Fe2O3,Pb3O4可改写为2PbO· PbO2。
甲同学在做铁与氯气的反应后,测得生成物的化学式是Fe3Cl8。乙同学在做铁与碘的反应时,测得生成物的化学式是Fe3I8。仿照上述形式,Fe3Cl8可改写为
Fe3I8可改写为 。乙同学在做铁与碘的反应时, 是过量的。⑵ 又已知Fe3O4还可改写成盐的形式:Fe (FeO2)2。请把下列化合物改写成盐的形式:
Pb3O4(铅酸铅) I4O9(碘酸碘)
24.(11分)
(Ⅰ)在一定温度和合适催化剂存在的条件下,把3mol N2和3mol H2通入一个一定体积的密闭容器中反应: N2(g)+
3 H2(g)![]() 2 NH3(g)达到平衡时,NH3的物质的量为w mol,N2的转化率为m,H2的转化率为n。
2 NH3(g)达到平衡时,NH3的物质的量为w mol,N2的转化率为m,H2的转化率为n。
(1)比较m、n的大小: m n (填“>”“<”或“=”)。
(2)平衡时压强与起始时压强之比 (用含w的代数式表示)。
(Ⅱ)若在与(Ⅰ)完全相同的条件下,起始时通入a mol N2,b mol H2,c mol NH3,达到平衡时NH3的物质的量仍为w mol,压强也与原平衡时相等。
(3)a的取值范围是 。
(4)若a=2.5,则b= ,c= 。
⑸ 判断:若a为某合理值,b=1.5,c=1.5,是否能建立符合题意的平衡状态?简要说明你的理由。
。
六、(本题包括2小题,共14分)
25.(6分)将2.5 molA和2.5mol B混合,盛入2 L容积的密闭容器里发生反应:
3A(g)+ B(g)![]() xC(g)+2D(g)经5s后反应达平衡。在此5s内C的平均反应速率为0.2 mol·L-1·S-1,同时生成1
mol D。试求:
xC(g)+2D(g)经5s后反应达平衡。在此5s内C的平均反应速率为0.2 mol·L-1·S-1,同时生成1
mol D。试求:
⑴达平衡时B的转化率。
⑵计算x的值。
⑶若维持温度、压强不变,平衡时容器内气体体积是多少?
26.(8分)将1.92 g 铜粉投入到10.0 mL某浓度的HNO3溶液中,充分反应后,铜粉完全溶解,产生气体的体积在标准状况下为1.12 L。
⑴原HNO3溶液是 (浓或稀)溶液。
⑵若将上述1.12 L气体用排水法收集,最后收集的气体在标准状况下的体积是
⑶若将反应后的溶液稀释到300mL,测得溶液的PH=1。求原HNO3溶液物质的量浓度。
2005年高三化学月考(Ⅰ)试卷答案及评分标准
选择题(每题4分,17、18题各5分,共74分。有两个答案的漏选得2 分,错选不得分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| C | D | A | C | A | D | D | B | D |
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| BC | BD | D | C | A | A | CD | BC | D |
19、⑴① 1,6,1,3,3; ②2,4,2,1,2,2 (共4分)
⑵ 5, ClO2 (共4分)
⑶1∶2 (共2分) (本题共10分)
20、⑴Cl2+2Fe2+ ==2Cl-+2Fe3+
⑵2Cl2+2Fe2++2Br-== 4Cl-+2Fe3++Br2
⑶1.68L (每小题3分,本题共9分)
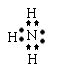 21、⑴ 3,ⅡA
(共2分)
21、⑴ 3,ⅡA
(共2分)
⑵ 氨分子间能以氢键结合 (共4分)
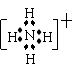
![]() ⑶
离子 (共3分)
⑶
离子 (共3分)
⑷ Mg3N2 + 8H+== 3Mg2++ 2NH4+ (共2分) (本题共11分)
22、⑴ 4, 8, XY2(或Y2X) (共3分)
⑵12 (共2分)
⑶ 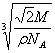 (共2分)
(共2分)
⑷XY4 ![]() 109º28´ 极性 非极性 (共4分) (本题共11分)
109º28´ 极性 非极性 (共4分) (本题共11分)
23、⑴ FeCl2·2FeCl3 3FeI2·I2 碘(或I2)
⑵ Pb2PbO4 I (IO3)3 (每空2分,本题共10分)
24、⑴ < (共2分)
⑵![]() (共2分)
(共2分)
⑶ 2≤ a ≤3 (共2分) ⑷1.5 1 (共2分)
⑸不能。由氢元素守恒a、b、c应满足2b+3c=6,故b=1.5,c=1.5时不合题意。(其它合理解答同样给分) (共3分) (本题共11分)
25、⑴20% ⑵x=4 ⑶2.4 L (每小题2分,本题共6分)
26、⑴ 浓 ⑵ 448mL (共4分)
⑶ n[Cu(NO3)2]=n (Cu)=0.03mol
n(NO2)+n(NO)=0.05mol
过量的HNO3:0.3×0.1=0.03mol
∴ n(HNO3)=0.03×2+0.05+0.03=0.14mol
c(HNO3)=![]() =14 mol/L
(本题共8分)
=14 mol/L
(本题共8分)

|
|
|
|
|
|
| 题号 | 第Ⅰ卷 | 第Ⅱ卷 | 总分 | 结分人 | 复分人 | |||
| 一、二 | 三 | 四 | 五 | 六 | ||||
| 分数 | ||||||||
| 评卷人 | ||||||||
| 复合人 | ||||||||
 | |||||||||
| |||||||||
 | |||||||||
| |||||||||
| |||||||||