08届高考化学复习备考试题
化 学 试 卷(十一)
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,全卷满分150分。考试时间120分钟。
可能用到的相对原子质量:H 1 He 4 C 12 N 14 O 16 F 19 Na 23 Mg 24 Al 27 S 32 Cl 35.5 K 39 Ca 40 Cu 64 Ag 108
第Ⅰ卷(选择题 共64分)
注意事项:
1.答第I卷前,考生务必将自己的姓名、准考证号、考试科目用铅笔涂写在答题卡上。
2.每小题选出答案后,用铅笔把答题卡对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案,答在试卷上无效。
一、单项选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
 1.下列化学用语表达正确的是
1.下列化学用语表达正确的是
A.S2—的结构示意图: B.乙炔的结构简式CHCH
![]()
![]() C.NaCl的电子式:
D.硝基苯的结构简式:
C.NaCl的电子式:
D.硝基苯的结构简式:
2.广东北江曾发生严重的水体镉污染事件,专家确定用1200吨的聚合铁{简称PFS,化学式为:[Fe2(OH)n(SO4)(3-n)/2]m,n<5,m<10}分批加入,利用PFS在水体中形成絮状物,以吸附镉离子。结合题中信息,下列说法正确的是
A.![]() Cd核素原子中的电子数为48,中子数为60
Cd核素原子中的电子数为48,中子数为60
B.含镉废电池含镉量很少,无需进行回收处理
C.PFS是铁显十2价的一种碱式硫酸盐聚合物
D.实验室可通过FeSO4溶液水解和聚合制PFS
3.下列有关说法正确的是
A.CaCl2、聚苯乙烯、HD均为化合物
B.CH2O2、C3H6O2、C4H8O2互为同系物
C.明矾、冰醋酸、硫酸钡均为电解质
D.SiO2、NaCl、S8、Cu均能表示物质分子组成
4.根据所学知识,下列有关胶体的说法中正确的是英才苑
A.将饱和的FeCl3溶液加热至沸,制得Fe(OH)3胶体
B.将磁性物质制成胶体离子作为药物的载体,可在磁场作用下送到病灶
C.化工生产上可利用丁达尔效应将油漆粒子均匀地沉积在镀件上
D.将蔗糖溶于溶解在酒精中,则可形成胶体
5.从下列事实所列出的相应结论正确的是
| 实 验 事 实 | 结 论 | |
| A | Cl2的水溶液可以导电 | Cl2是电解质 |
| B | SO2通入硝酸钡溶液出现白色沉淀 | BaSO3不溶于强酸 |
| C | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| D | 常温下白磷可自燃而氮气须在放电时才与氧气反应 | 非金属性:P>N |
6.通过复习总结,你认为下列对化学知识概括合理的是
A.氧化物不可能是还原产物,只可能是氧化产物
B.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
C.原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键
D.原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低
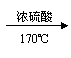
7.某含结晶水的无色透明晶体,可能是明矾或草酸晶体,为确定其成分,某校化学兴趣小组的同学设计了几种方法:①检验K+;②溶于水检验Al3+;③溶于水利用胶体性质进行检验;④溶于水用石蕊试液检验;⑤与浓硫酸混合共热,将产生的气体用澄清石灰水检验;⑥溶于水再用酸化的高锰酸钾溶液检验。你认为其中正确的组合是
A.①②③⑤⑥ B.全部 C.①②③⑥ D.①②③④⑤
8.现有t℃时质量分数为a %的KNO3溶液m g,将其分成质量比为1∶2的甲、乙两份溶液。甲溶液蒸发5 g水,恢复到原温度时析出晶体2 g;乙溶液蒸发12 g水,恢复到原温度时析出晶体5 g。则t℃时,KNO3溶解度为
![]() A.41.7 g B.50 g C.40 g D.60 g
A.41.7 g B.50 g C.40 g D.60 g
二、不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
9.下列分子中,所有原子都满足最外层为8电子结构的是
A.CO2 B.SiH4 C.SF6 D.PCl5
10.NA代表阿伏加德罗常数的值,下列说法正确的是
A.4 g重水(D2O)中所含质子数为0.2NA
B.在通常状况下,22.4 LH2和4 gHe均含有NA个分子
C.8.0 g Cu2S和CuO的混合物中约含有铜原子数为0.1NA
D.常温常压下,0.1mol铁与0.1molCl2充分反应,转移的电子数约为0.3NA
11.A、B、C均为短周期元素,A、B同周期,A、C的最低价阴离子分别为A2-、C-,英才苑
B2+与C-具有相同的电子层结构。下列叙述中正确的是
A.它们的原子序数A>B>C B.它们的离子半径A2->C->B2+
C.它们的原子半径C>B>A D.它们的最外层电子数B>A>C
12.下列各组离子,在指定的环境中一定能大量共存的是
A.在c(H+)/c(OH-)=1×1012的溶液中:I-、Cl-、HCO3—、Na+
B.在能使pH试纸变红色的溶液中:Na+、S2—、NO3—、CO32—
C.在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42—、Cl—、
D.由水电离出的c(H+)=1×10-12mol·L-1的溶液中:K+、Cl-、NO3—、Na+
13.下列反应的离子方程式正确的是
A.碳酸氢铵溶液与足量氢氧化钠溶液反应:NH4++OH-=NH3·H2O
B.向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:
2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
C.1 mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积互相均匀混合:
2AlO2-+5H+ = Al(OH)3↓+Al3++H2O
D.向硫酸亚铁溶液中加入过氧化氢溶液:2Fe2++2H++H2O2=2Fe3++2H2O
14.青石棉(cricidolite)是一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一,其化学式为:Na2Fe5Si8O22(OH)2。青石棉用稀硝酸溶液处理时,还原产物只有NO,下列说法不正确的是
A.青石棉可能是一种硅酸盐
B.青石棉中含有一定量的石英晶体
C.青石棉能和18molHNO3反应
D.青石棉的化学组成可表示为:Na2O·3FeO·Fe2O3·8SiO2·H2O
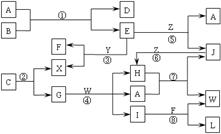
15.2004年4月30号出版的《Science》杂志报道了中国科学家郑兰荪院士首次成功合成新型稳定小富勒烯C50Cl10,外侧有10个氯原子,其形状酷似太空船。有关C50Cl10的说法正确的是
A.C50Cl10摩尔质量为955 g/mol B.C50Cl10晶体是原子晶体
C.C50Cl10分子中含有25个碳碳双键 D.C50Cl10分子中共用电子对数目为105个
16.氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:aHClO3=bO2↑+cCl2↑+dHClO4+eH2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法正确的是
A.物质HClO4的氧化性大于HClO3
B.变蓝的淀粉碘化钾试纸褪色可能发生的反应:
5C12+I2+6H2O=12H++10Cl—+2IO3—
C.若化学计量数a=8,b=3,则该反应转移电子数为20e—
D.氯酸分解所得O2和C12的物质的量之比是确定不变的
第Ⅱ卷(非选择题 共86分)
三、(本题包括2小题,共22分)
17.(6分)⑴可以验证镁、铝的金属性强弱的实验是 。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
(2)现有MgCl2溶液、AlCl3溶液、NaOH溶液、氨水、盐酸等几种物质,试设计实验方案证明镁、铝的金属性强弱。
18.(16分)电镀厂曾采用有氰电镀工艺,处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率。
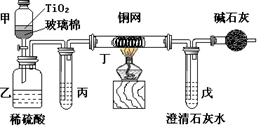
将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200 mL(其中CN-的浓度为0.05 mol·L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)甲中反应的离子方程式为 ,
乙中反应的离子方程式为 。
(2)乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等。丙中加入的除杂试剂是饱和食盐水,其作用是 ,丁在实验中的作用是 ,装有碱石灰的干燥管的作用是 。
(3)戊中盛有含Ca(OH)2 0.02mol的石灰水,若实验中戊中共生成0.82 g沉淀,则该实验中测得CN-被处理的百分率等于 。该测得值与工业实际处理的百分率相比总是偏低,简要说明可能的原因 。请提出一个能提高准确度的建议(要有可操作性,且操作简单) 。
四、(本题包括2小题,共18分)
19.(8分)同族元素的同类物质的结构、性质既有相似性,也有特殊性。回答下列问题:
(1)已知酸性FCH2COOH>CH3COOH,试推断:
①BrCH2COOH、②ClCH2COOH、③FCH2COOH的酸性由强到弱的顺序(填序号)_________________。
(2)已知AgCl可溶于稀氨水形成银氨溶液、AgBr可溶于浓氨水形成银氨溶液、AgI不溶于浓氨水,它们都不溶于水。试推断:
上述三种银盐在水中溶解度由大到小的顺序________________________。
(3)除HF外,其他卤化氢沸点随相对分子质量增大而增大,HF的沸点反常的原因是___
_________________________________________________________。
(4)已知NH4+、N4H44+的空间构型均为四面体,NH4+的结构式为
(→表示共用电子对由N原子单方面提供)。
请画出N4H44+的结构式_____________________。
20.(10分)下图表示各物质之间的转化关系。已知:
Ⅰ.A是无色液体,L是不溶于稀硝酸的白色沉淀,E、F、H、J、X、Y、Z是气体;
Ⅱ.G、X、Y、Z是单质,其它是化合物,其中Y呈黄绿色、H呈红棕色,E和F都极易溶解于水,二者相遇会有白烟生成;
|
请按要求填空:
(1)写出下列物质的化学式:B___________,C___________;
(2)上述反应中属于置换反应的是_________;不属于氧化还原反应的是__________;(填写反应代号)
(3)反应④的离子方程式为:_____________________________________________。
五、(本题包括1小题,共10分)
21.(10分)《2004年江苏省环境公报》指出:2004年全省废水排放总量为46.6亿吨,其中工业废水排放量为26.3亿吨,生活污水排放量为20.3亿吨。废水中化学需氧量(COD)排放总量为85.4万吨,其中工业废水中COD排放量为29.8万吨,占COD排放总量的34.9%;生活污水中COD排放量为55.6万吨,占COD排放总量的65.1%。氨氮排放总量为7.3万吨,石油类排放总量为1804.3吨,挥发酚排放总量为74.3吨。
回答下列问题:
(1)江苏省水污染的特征是___________________________________________________________。
(2)某校研究性学习小组拟选择“本地水污染情况分析”的课题进行探究。
①如果你参加该课题的探究,写出你的子课题名称和你选择该子课题的理由:___________________________________________________________________________ ______________________________________。
②水中的NO2-是含氮有机物分解的产物,其浓度的大小是水源污染的标志之一。检测水中的NO2-可用比色法,其步骤是:
(Ⅰ)配制标准溶液:称取0.30gNaNO2,溶于水后在容量瓶中稀释至1L得溶液A,移取5mL溶液A,稀释至1L,得溶液B。
(Ⅱ)配制标准色阶:取6只规格为10mL的比色管(即质地、大小、厚薄相同且具塞的平底试管),分别加入体积不等的溶液B,并稀释至10mL,再加入少许(约0.3g)氨基苯磺酸(![]() )粉末,实验结果如下表所示。
)粉末,实验结果如下表所示。
| 色阶序号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 加入溶液B的体积(mL) | 0.0 | 2.0 | 4.0 | 6.0 | 8.0 | 10.0 |
| 反应后溶液颜色 | 由无色变为由浅到深的樱桃红色 | |||||
(Ⅲ)检测:取10mL水样倒入比色管中,加少许氨基苯磺酸,显色后与标准色阶对比。
请填写以下空白:
a.比色法的基本依据是 ;
b.若水样显色后与色阶中的5号颜色相同,则表明水样中含NO2-含量为 mg/L。
c.用NaNO2直接配制溶液B的缺点是 。
d.如果水样显色后比6号还深,应采取的措施是 。
六、(本题包括2小题,共18分)
22.(8分)现有A、B、C、D、E五种原子序数依次增大的短周期元素。已知:A、B两种元素的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2;在元素周期表中,C是E的邻族元素;D和E的原子序数之和为30;它们两两形成的化合物有甲、乙、丙、丁四种,这四种化合物中原子个数比如下表:
| 甲 | 乙 | 丙 | 丁 | |
| 化合物中各元素原子个数比 | A∶C = 1∶1 | B∶A = 1∶2 | D∶E = 1∶3 | B∶E = 1∶4 |
回答下列问题:
(1)甲分子的电子式为 ;丁分子的空间构型为 。
(2)已知:乙分子中所有原子共平面,则实验室制取乙的化学方程式为
。
(3)丙的水溶液加热蒸干再灼烧,最后所得固体的成分是 (写化学式)
23.(10分)下表是元素周期表的前三周期,用相应的化学用语回答下列问题:
| a | b | c | d | e | |||
| f | g |
(1)g的单质能与f元素的最高价氧化物对应的水化物的溶液反应,请写出该反应的离子方程式 。
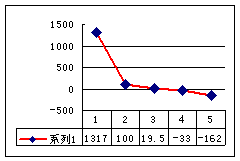
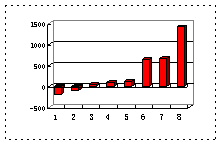
(2)第三周期8种元素按单质熔点(℃)大小顺序的柱形图(上左图),其中序列“2”代表 ,“8”代表 。
(3)a、b、c、d、e的氢化物的沸点直角坐标图(上右图),序列“5”氢化物的化学式为 ,序列“1”的氢化物的电子式: 。
七、(本题包括2小题,共18分)
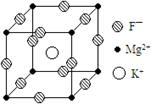 24.(10分)某种晶体的晶胞为立方体,结构如右图所示:
24.(10分)某种晶体的晶胞为立方体,结构如右图所示:
通过观察和计算,回答下列有关问题:
(1)晶体中每个Mg2+周围与它最邻近的Mg2+围成的
空 间构型是 ,每个F—周围与
它最邻近的K+有 个。
(2)若将该晶体重新切割晶胞,使Mg2+置于晶胞的体心,K+置于晶胞的顶点,F—应占据立方体的 位置。
(3)设该晶体的密度为![]() g/cm3,阿伏加德罗常数用NA表示,求算晶体中两个距离最近的Mg2+中心间距离。
g/cm3,阿伏加德罗常数用NA表示,求算晶体中两个距离最近的Mg2+中心间距离。
25.(8分)硝酸工业尾气中氮的氧化物(NO、NO2)是大气污染物,可用基于下列反应的方法治理:2NO2 + 2NaOH → NaNO3 + NaNO2 + H2O
NO + NO2 + 2NaOH →2NaNO2 + H2O;
(1)若在标准状况下有NO、NO2的混合物恰好与50mL 2.0 mol·L-1的NaOH溶液反应完全,且生成NaNO2和NaNO3的物质的量的比值为4:1,则在混合气体中NO气体的体积分数为多少?
(2)设NO、NO2的混合气体用NOx表示,用碱液吸收,生成硝酸钠及亚硝酸钠再结晶分离。
 ①试写出NOx与NaOH溶液反应的化学方程式:
①试写出NOx与NaOH溶液反应的化学方程式:
_____________________________________________
②若生产每吨硝酸钠的成本为0.16万元,生产每吨亚 硝酸钠的成本为0.27万元。目前市场出售价:硝酸钠每吨0.18万元,亚硝酸钠每吨0.28万元。则每处理22.4×109L(标准状况)含NOx(x≥1.5)0.1%(体积分数)的尾气,所得利润y(出售价减去成本价,单位:万元)与x的关系为 。
(3)根据(2)的计算结果,在以下坐标系中作出其示意图。
参考答案
一、单项选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.D 2.A 3.C 4.B 5.C 6.D 7.A 8.B
二、不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
9.A 10.C 11.AB 12.D 13.CD 14.B 15.AD 16.BC
三、(本题包括2小题,共22分)
17.(1)bc (3分)
(2)分别取适量MgCl2溶液、AlCl3溶液于两支试管中,分别向两支试管中加入适量NaOH溶液或氨水,将所得沉淀分别等分为两份,分别向一份Mg(OH)2、Al(OH)3中加入适量NaOH溶液,Mg(OH)2不溶解,Al(OH)3溶解;再分别向另一份Mg(OH)2、Al(OH)3中加入适量盐酸,全部溶解,说明Mg的金属性比Al强。(3分)
17.(1)CN-+ClO-![]() CNO-+Cl- 2CNO-+2H+ +3ClO-
CNO-+Cl- 2CNO-+2H+ +3ClO-![]() N2↑+2CO2↑+3Cl-+H2O
N2↑+2CO2↑+3Cl-+H2O
(2)除去HCl气体 去除Cl2 防止空气中CO2进入戊中影响测定准确度
(3)82% ①装置乙、丙、丁中可能滞留有CO2;②CO2产生的速度较快未与戊中的澄清石灰水充分反应 ;③Cl2、HCl在丙、丁中未吸收完全。(三点中任意答两点即可,每答对一点给1分,共2分)
建议一:不将甲中溶液一次全部加入乙中,改为分次加入,控制CO2的产生速度;
建议二:乙中瓶塞改为三孔塞,增加的那个孔中插入一根导管到液面以下,反应结束后缓缓通入除去CO2的空气,使装置中滞留的CO2尽可能多的与Ca(OH)2反应。
建议三:将戊中澄清石灰水改为浓度较大的NaOH溶液,反应结束后向戊中加入足量CaCl2后测沉淀质量。等等(三点中任意答一点即可) (每空2分,共16分)
四、(本题包括2小题,共18分)
19.(1)③②① (2)AgCl>AgBr >AgI
(3)HF分子间存在存在氢键,分之间作用力大,沸点反常的高。
(4) 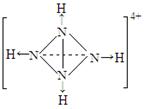 (每空2分,共8分)
(每空2分,共8分)
20.(1)Mg3N2 AgN3 (2)③ ①⑧
(3)Ag+2H++NO3-(浓)=Ag++NO2↑+H2O (每空2分,共10分)
五、(本题包括1小题,共10分)
21.(1)工业污染和生活污染混合型
(2)①我的子课题是《近五年来我市某某河某段水质状况分析及对策研究》;理由:通过近几年来某河某段水质状况的变化找出水质变化的主要原因,提出改整治的措施供环保部门参考
②a溶液颜色的深浅与浓度的大小成正比 b 1.00 c由(2)的计算可知,1L溶液B中只含NO2-1mg,不易称量,直接配制溶液B 时误差大 d将水样先稀释一定倍数后再重复实验(除c、d每空1分外,其余每空2分共10分)
|
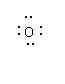 六、(本题包括2小题,共18分)
六、(本题包括2小题,共18分)
 22.(1)HO 正四面体(写四面体不计分)
22.(1)HO 正四面体(写四面体不计分)
(2)CH3CH2OH CH2=CH2↑+H2O
(未写反应条件及未注明温度或温度错误等均不计分)
(3)Al2O3 (未写化学式不计分)(每空2分,共8分)
23.(1)2OH—+2Al+2H2O=2AlO2—+3H2↑
(2)Cl2 Si ⑶ CH4 Li+[∶H]— (每空2分,共10分)
七、(本题包括2小题,共18分)
24.(1)正八面体 4 (2)面心(每空2分,共6分)
(3)每个晶胞中含F—:12×1/4 =3 K+:1 Mg2+:8×1/8 =1
该晶体的化学式为KMgF3 (2分)
晶体中两个距离最近的Mg2+中心间距离,即为立方晶胞的边长,设为a cm
则有a3 cm
3·NA
mol-1·![]() g/cm3 = 120 g /mol
g/cm3 = 120 g /mol
 a=
a=![]() cm(2分)
cm(2分)
25.(1)0.30(3分)
(2)①2NOx+2NaOH=(5-2x)NaNO2+(2x-3)NaNO3+H2O(3分)
②y=1.01x-0.825(1分)
(3)见右图。(1分)