08届高考化学复习备考试题
化 学 试 卷(十六)
YCY
可能用到的相对原子质量:H—1,C—12,N—14,O—16,Na—23,S—32,C1—35.5,
K—39,Ca—40,Fe—56,Cu—64,Zn—65,Ag—108
第Ⅰ卷
(选择题,请将符合题意的选项填有答题卷的空格里,每题只有一个正确选项,每题6分,共48分)
1.下列关于胶体的叙述不正确的是 ( )
A.分散质粒子在1nm—100nm之间的分散系称为胶体,用渗析的方法净化胶体时,使用的半透膜只能让较小的分子、离子通过
B.光线透过胶体时,胶体发生丁达尔效应,利用丁达尔效应可以区别溶液与胶体
C.布朗运动是胶体的性质之一,布朗运动的胶体稳定的次要原因
D.胶体粒子具有较大的表面积,有的能吸附阳离子或阴离子,故在电场作用下会产生电泳现象,电泳现象可证明胶体属于电解质溶液
2.在硫酸的工业制法中,下列生产操作与说明生产操作的主要原因二者都是正确的是( )
A.硫铁矿燃烧前要粉碎,因为大块的硫铁矿不能燃烧
B.SO3用98.3%的浓H2SO4吸收,目的是防止形成酸雾,以便SO3吸收完全
C.SO2氧化为SO3时需使用催化剂,因为炉气中SO2会与杂质反应
D.从沸腾炉出来的炉气需净化,因为炉气中SO2会与杂质反应
3.下列各组离子,在指定的环境中一定能大量共存的是 ( )
A.在c(H+)/c(OH-)=1×10-12的溶液中:I-、CI-、HCO3-、Na+
B.在能使pH试纸变红色的溶液中:Na+、S2-、NO3-、C122-
C.在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、C1-
D.由水电离出的c(H+)=1×10-12mol·L-1的溶液中:K+、C1-、NO3-、Na+
![]()
![]() 4.下列离子方程式正确的是 ( )
4.下列离子方程式正确的是 ( )![]() A.澄清石灰水中滴加稀硝酸:Ca(OH)2+2H+ Ca2++2H2O
A.澄清石灰水中滴加稀硝酸:Ca(OH)2+2H+ Ca2++2H2O
B.用Pt电极电解饱和氯化镁溶液:2C1-+2H2O 20H-+H2↑+C12↑
![]() C.向FeBr2溶液中通入过量氯气:2Fe2++C12 2Fe3++2C1-
C.向FeBr2溶液中通入过量氯气:2Fe2++C12 2Fe3++2C1-
D.向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液:
![]() Ca2++2HCO3- CaCO3↓+CO32-+2H2O
Ca2++2HCO3- CaCO3↓+CO32-+2H2O
5.用惰性电极电解某溶液时,发现两极只有H2和O2生成。则电解一段时间后,下列有关该溶液(与电解前同湿度)的说法中,正确的有 ( )
①该溶液的PH可能增大; ②该溶液的PH可能减小;
③该溶液的PH可能不变; ④该溶液的浓度可能增大;
⑤该溶液的浓度可能不变; ⑥该溶液的浓度可能减小;
A.三种 B.四种 C.五种 D.六种
 6.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是 ( )
6.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是 ( )
A.放电时负极反应为:![]()
B.充电时阳极反应为:![]()
C.放电时每转移3mol电子,正极有1molK2FeO4被氧化
D.放电时正极附近溶液的碱性增强
5.将3mol A和2.5mol B充入容积为2L的密闭容器中,发生如下反应:
![]() 3A(气)+B(气) nC(气)+2D(气),经测定,5min后反应达到平衡状态,生成1mol
D,
3A(气)+B(气) nC(气)+2D(气),经测定,5min后反应达到平衡状态,生成1mol
D,![]() 下列结论中正确的是 ( )
下列结论中正确的是 ( )
①平衡时B的转化率为20% ②平衡时B的浓度为1mol·L-
③经计算,n值为1 ④![]()
A.①② B.①④ C.②③ D.③④
|
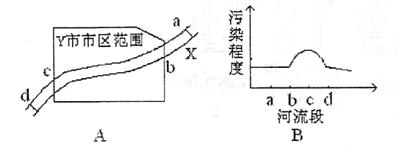
( )
A.造成X河污染的主要污染源最可能分布在bc段
B.工业生活污水、固体废弃物可能是造成X河污染的污染源
C.d处污染程度减小,可能是某些污染物的离子间发生反应生成沉淀所致
D.该城市建造硫酸厂时,综合考虑诸多因素选址在b处最合理
第Ⅱ卷
|
请填写下列空白:
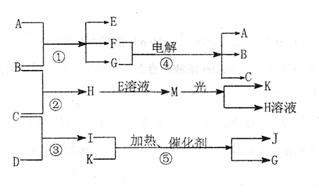
(1)写出下列物质的化学式:B ;
C ;
D ;
K ;
G ;
J 。
(2)写出下列反应的离子方程式:
①H+E(溶液)→M
。
②I溶于G
。
(3)通常状况下,若1gC气体在B气体中燃烧生成H气体时放出92.3kJ热量,则2molH气体完全分解生成C气体和B气体的热化学方程式为
|
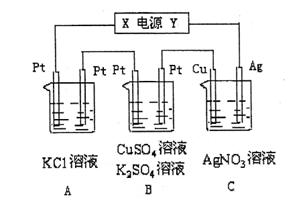
(1)电源电极X名称为 。
(2)PH变化:A ,
B ,
C 。
(3)通电5min时风吹草动共收集224mL气体(标况),溶液体积为200mL,则B中阳极的电极反应式为
。
通电前硫酸铜溶液的物质的量浓度为
。
(4)A中发生反应的化学方程式为
。
若A中KCI溶液的体积也是200mL,电解后溶液的PH=
。
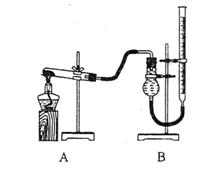
11.(12分)某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
(一)制取氧化铜
①称取2gCuSO4·5H2O研细后倒入烧杯,加10mL蒸馏水溶解
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀,然后将所得混合物转移到蒸发皿,加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤、晾干后研细备用。回答下列问题:
(1)上述实验步骤中需要使用玻璃棒的是 (填实验序号),步骤①、③中研磨固体所用仪器的名称是 ;
(2)步骤③中洗涤沉淀的操作是
|
| 实验序号 | KC1O3质量 | 其它物质质量 | 待测数据 |
| ④ | 1.2g | 无其他物质 | |
| ⑤ | 1.2g | CuO 0.5g | |
| ⑥ | 1.2g | MnO2 0.5g |
回答下列问题:
(3)上述实验中的“待测数据”指 ;
(4)若要证明实验⑤中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住B中乳胶管,拔去干燥管上单孔橡皮塞,
(5)为探究CuO的实验⑤中是否起催化作用,需补做如下实验(无需写出具体操作):
a. ;
b.CuO的化学性质有没有改变。
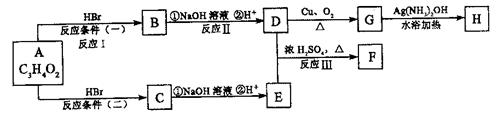
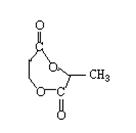
12.(16分)已知物质A显酸性,F为七原子组成的环状物,请根据以下框图回答问题:
|
(1)写出下列物质的结构简式:A: ,
G: 。
(2)反应Ⅰ、Ⅱ、Ⅲ的反应类型分别为 、 、 。
(3)写出D和E反应生成F的化学方程式: 。
(4)写出C的同分异构体属于酯类物质的结构简式:(任写两种) 、 。
参考答案
第Ⅰ卷
(选择题,每题只有一个正确选项,每题6分,共48分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| D | B | D | D | C | C | A | D |
第Ⅱ卷
9.(12分)(1)B.C12 C.H2 D.N2 K.O2 G.H2O J.NO(各1分)
![]()
![]() (2)①H++C1O-=HC1O、NH3+H2O NH3·H2O NH4++OH-(各2分)
(2)①H++C1O-=HC1O、NH3+H2O NH3·H2O NH4++OH-(各2分)
(3)2HC1(g)=H2(g)+C12(g);
△H=+184.6KJ·mol-1(2分)
10.(12分)(1)负极(2)增大,减小,不变(每空1分)
![]() (3)阳极:4OH--4e-=2H2O+O2↑ 0.025mol/L(每空2分)
(3)阳极:4OH--4e-=2H2O+O2↑ 0.025mol/L(每空2分)
(4)2KC1+2H2O H2↑+C12↑+2KOH 13(每空2分)
11.(12分)(1)①②③ 研钵
(2)沿玻璃棒向过滤器中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复2—3次
(3)时间
(4)取一根带火星的木条,伸入干燥管内,看木条是否复燃
(5)CuO的质量有没有改变(每空2分)
O
|
12.(16分)(1)CH2=CH—COOH H—C—CH2—COOH
(2)加成反应、取代反应(或水解反应)、酯化反应
 +2H2O
+2H2O
|
OH OH
O O
(4)CH2—CH2—O—C—H、CH3—CH—O—C—H
Br Br