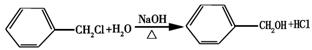
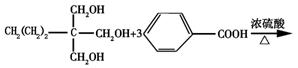
08届高考化学复习备考试题
化 学 试 卷(二)
YCY
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分,考试时间90分钟。
第I卷(选择题,共46分)
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Mg:24 Al:27 Cu:64
一、选择题(本题包括5小题,每小题2分,共10分。每小题只有一个选项符合题意)
1.以下说法正确的是 英才苑 ( )
A.纳米材料是指一种称为“纳米”的新物质制成的材料
B.绿色食品是指不含化学物质的食品
C.生物固氮是指植物通过叶面直接吸收空气中的氮气
D.光导纤维是以二氧化硅为主要原料制成的
2.据报道,近来发现了一种新的星际分子氰基辛炔,其结构简式为HC≡C—C≡C—C≡C
—C≡N对该物质的判断不正确的是 ( )
A.其分子中的原子都在一条直线上 B.能使酸性高锰酸钾溶液褪色
C.能发生加成反应 D.可由乙炔和含氮化合物加聚制得
3.约翰·芬恩(John fenn)等三位科学家因在蛋白质等大分子研究领域的杰出贡献获得了
2002年的诺贝尔化学奖。下列有关说法正确的是 ( )
A.蛋白质在紫外线的照射下会失去生理活性
B.蛋白质溶液不能产生丁达尔效应
C.蛋白质溶液中加入CuSO![]() 可产生盐析现象
可产生盐析现象
D.蚕丝、羊毛、棉花的主要成分都是蛋白质
4.以石灰石、食盐、焦炭、水和空气为主要原料,不能生产的化工产品是 ( )
A.漂白粉 B.烧碱 C.硝酸铵 D.玻璃
5.下列物质中,长久露置于空气中会发生颜色变化的是 ( )
①绿矾 ②氢氧化铁 ③氯水 ④苯酚 ⑤亚硫酸钠 ⑥过氧化钠
A.全部 B.①②③④⑥ C.只有①②③ D.只有②③④
二、选择题(本题包括12小题,每小题3分,共36分。每小题只有一个选项符合题意)
6.将40℃的饱和硫酸铜溶液升温至50℃,或者温度仍保持在40℃而加入少量无水硫酸铜,
在这两种情况下均保持不变的是 ( )
A.硫酸铜的溶解度 B.溶液中溶质的质量分数
C.溶液的质量
D.溶液中Cu![]() 的数目
的数目
7.下列各项实验操作中,正确的是 ( )
A.用氨水洗涤试管内壁上的“银镜”
B.只用溴水鉴别苯、CCH![]() 、KI溶液、Na
、KI溶液、Na![]() SO
SO![]() 溶液
溶液
C.为加快过滤速度,用玻璃棒搅拌过滤器中的食盐水
D.为迅速除去乙酸乙酯中的少量乙酸,加入足量NaOH溶液并加热
8.下列对如图所示装置实验现象的描述正确的是 ( )
| a电极 | B电极 | x溶液 | 实验现象 | |
| A | 石墨 | 石墨 | CuCl |
|
| B | Fe | 石墨 | KNO | a极质量增加,b极放出无色气体 |
| C | Fe | Cu | CuSO | a极质量增加,b极质量减少 |
| D | 石墨 | 石墨 | HCl | a、b极都放出无色气体 |
9.1 mol有机物A(分子式为C![]() H
H![]() O
O![]() )经水解得1 molB和2 molC,C经分子内脱水得D,
)经水解得1 molB和2 molC,C经分子内脱水得D,
D可发生加聚反应生成[CH![]() —CH
—CH![]() ]
]![]() ,由此可知A为 ( )
,由此可知A为 ( )
A.HOOC(CH![]() )
)![]() COOH
B.HOOC(CH
COOH
B.HOOC(CH![]() )
)![]() COOCH
COOCH![]()
C.CH![]() COO(CH
COO(CH![]() )
)![]() COOCH
COOCH![]() D.CH
D.CH![]() CH
CH![]() OOC—COOCH
OOC—COOCH![]() CH
CH![]()
10.广义的水解观认为,无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质。根据上述观点,下列说法正确的是
( )
A.CaO2的水解产物是Ca(OH)![]() 和H2O2B.NaClO的水解产物之一是HClO
和H2O2B.NaClO的水解产物之一是HClO
C.PCl3的水解产物是PH3和HClO D.Mg3N2水解生成NH3和平Mg(OH)2
11.向明矾溶液中逐滴加入Ba(OH)![]() 溶液,当SO
溶液,当SO![]() 全部沉淀时,铝元素的主要存在形式为
全部沉淀时,铝元素的主要存在形式为
( )
A.AlO![]() B.Al
B.Al![]() C.Al(OH)
C.Al(OH)![]() D.Al(OH)
D.Al(OH)![]() 和Al
和Al![]()
12.已知M![]() O
O![]() 离子可与R
离子可与R![]() 离子作用,R
离子作用,R![]() 被氧化为R单质,M
被氧化为R单质,M![]() O
O![]() 的还原产物中,M为+3价;又如c(M
的还原产物中,M为+3价;又如c(M![]() O
O![]() )=0.3 mol·L
)=0.3 mol·L![]() 的溶液100 mL可与c(R
的溶液100 mL可与c(R![]() )=0.6 mol·L
)=0.6 mol·L![]() 的溶液150 mL恰好完全反应,则n值为 ( )
的溶液150 mL恰好完全反应,则n值为 ( )
A.4 B.5 C.6 D.7
13.X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z的最外层电子数是内层电子总数的3倍。下列有关叙述正确的是( )
A.X肯定为碱金属元素
B.稳定性:Y的氢化物>Z的氢化物
C.X、Y两元素形成的化合物一定为离子晶体
D.Y、Z两元素形成的化合物熔点较低
14.某一无色溶液,若向其中加入足量饱和氯水,溶液呈橙黄色;再向橙黄色溶液中滴加BaCl![]() 溶液,产生白色沉淀;若向原溶液中加入铝粉,有气体放出,该溶液可能大量存在的一组离子是 ( )
溶液,产生白色沉淀;若向原溶液中加入铝粉,有气体放出,该溶液可能大量存在的一组离子是 ( )
A.K![]() 、H
、H![]() 、NO
、NO![]() 、Na
、Na![]() B.H
B.H![]() 、Br
、Br![]() 、SO
、SO![]() 、Na
、Na![]()
C.SO![]() 、Br
、Br![]() 、OH
、OH![]() 、Fe
、Fe![]() D.H
D.H![]() 、Br
、Br![]() 、SO
、SO![]() 、K
、K![]()
15.一定条件下,对于可逆反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为c
2Z(g),若X、Y、Z的起始浓度分别为c![]() 、c
、c![]() 、c
、c![]() (均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol·L
(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol·L![]() 、0.3 mol·L
、0.3 mol·L![]() 、0.08 mol·L
、0.08 mol·L![]() ,则下列判断不合理的是 ( )
,则下列判断不合理的是 ( )
A.c![]() :c
:c![]() =1:3 B.平衡时,Y和Z的生成速率之比为2:3
=1:3 B.平衡时,Y和Z的生成速率之比为2:3
C.X、Y的转化率相等 D.c![]() 的取值范围为0<c
的取值范围为0<c![]() <0.14 mol·L
<0.14 mol·L![]()
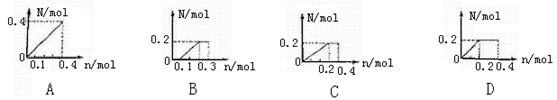
16.将0.4 mol铁粉逐渐加入到含硝酸0.8 mol的稀硝酸中,反应生成气体的物质的量N随消耗铁粉的物质的量n变化关系正确的是 ( )
|
17.下列各选项所述的两个量,前者一定大于后者的是 ( )
①F![]() 和Br
和Br![]() 的沸点 ②纯水在25℃和80℃时的pH
的沸点 ②纯水在25℃和80℃时的pH
③同温下分别在100 g水中最多能溶解的无水CuSO![]() 和CuSO
和CuSO![]() · 5H
· 5H![]() O的质量
O的质量
④25℃时,等体积的pH都等于3的盐酸和AlCl![]() 溶液中,已电离的水分子数
溶液中,已电离的水分子数
⑤在NH![]() +NO—→ N
+NO—→ N![]() +H
+H![]() O反应中,被氧化和被还原的N原子数
O反应中,被氧化和被还原的N原子数
⑥耐火材料MgO和CaO的熔点 ⑦H![]() 和H
和H![]() 的离子半径
的离子半径
A.①②④ B.②③⑤ C.②⑥⑦ D.⑤⑥⑦
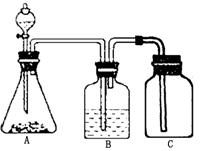 第Ⅱ卷(非选择题,共54分)
第Ⅱ卷(非选择题,共54分)
三、(本题包括2小题,共17分)
18.(5分)为确认C![]() H
H![]() OH、H
OH、H![]() CO
CO![]() 和CH
和CH![]() COOH
COOH
的酸性强弱,某学生设计了如图所示的装置,一次
实验即可达到目的(不必选其他酸性物质)。请据此实验回答:
(1)锥形瓶中装某可溶性正盐溶液,分液漏斗中所盛试剂应为_______________。
(2)装置B所盛的试剂是___________________,其作用是____________________。
(3)装置C所盛的试剂是_______________,C中反应的离子方程式_____________。
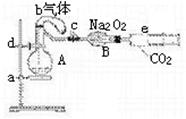
|
气(氧气占五分之一)和10 mL 1.2 mol/L硝酸的烧瓶,
b是未充气(实验开始前内部没有气体)装有0.384 g铜
粉的气球,c是夹紧了的弹簧夹,d中盛有足量的过氧化钠,
e是充有二氧化碳的注射器。整套装置经过气密性检查已合格。
(1)将气球中的铜粉小心倒入烧瓶中,充分反应后发现铜粉有
剩余(设产生的气体不溶解于溶液中),则可观察到的现象是___________________。
(2)欲提高铜与硝酸反应的速率可采用多种不同的措施,若用加入化学试剂法,下列试
剂中可以使用的是(填代号)________________________。
A.蒸馏水 B.无水醋酸钠 C.石墨 D.硝酸银(少量)
(3)将烧瓶充分振荡,所观察到的现象是____________________________;有关反应的化学方程式__________________________________________________。
(4)打开弹簧夹e,将二氧化碳推入干燥管内,使反应充分进行。将烧瓶中反应的全过程用一个总的化学方程式表示:_______________________________________。
(5)欲使所有的铜粉都溶解,至少需要推入二氧化碳_________mL(设推入的二氧化碳全部反应)。
四、(本题包括2小题,共15分)
20.(7分)已知X、Y、Z、W均为短周期元素,其原子序数依次增大。X和Y可形成常见化合物YX,一个YX![]() 分子中共有10个电子;Z单质在通常状况下为无色无味气体;W原子的最外层电子数是核外电子总数的3/4。试回答:
分子中共有10个电子;Z单质在通常状况下为无色无味气体;W原子的最外层电子数是核外电子总数的3/4。试回答:
(1)由X、Z、W三种元素可组成一种盐,该盐是常用的速效化肥,不宜与碱性肥料混合或在碱性土壤中施用,其原因是_______________________________________。
(2)由X、Y、Z、W四种元素可组成多种化合物,其中既能与盐酸又能与烧碱溶液反应的无机物是______________,有机物是___________________(各写一种)。
(3)将1.2 gY单质在足量W单质中燃烧所得的气体通入150 mL 1mol·L![]() NaOH溶液中,完全反应后溶液中离子浓度由大到小的顺序是____________________。
NaOH溶液中,完全反应后溶液中离子浓度由大到小的顺序是____________________。
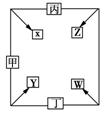 21.(8分)甲、乙、丙、丁四种单质在点燃条件下反应生成X、Y、Z、W四种化合物,其转化关系如右图所示。又如:
21.(8分)甲、乙、丙、丁四种单质在点燃条件下反应生成X、Y、Z、W四种化合物,其转化关系如右图所示。又如:
①甲、乙、丙均为前三周期元素的单质,常温下均为气态;
丁是日常生活中一种常见的金属。
②常温下X是无色液体,Y是黑色固体。
③丙在乙中燃烧发出苍白色火焰,丁在乙中燃烧生成棕黄色
的烟,W的水溶液呈黄色。
(1)丁在甲和X同时存在的条件下,可发生电化腐蚀,写出正极上的电极反应式:
_ _______________。
(2)将少量W的饱和溶液滴入热的X中,反应的化学方程式是____________________。
(3)若Z、W两溶液的pH均等于5,则两溶液中由水电离出的H![]() 的物质的量浓度之比
的物质的量浓度之比
为________________。
(4)已知5.6 L(标准状况)气体丙在甲中完全燃烧放出热量为71.45 KJ,则能正确表示丙燃烧的热化学方程式为___________________________。
五、(本题包括2小题,共14分)
22.(4分)某有机物含有C、H、O、N四种元素,下图为该有机物的球棍模型。
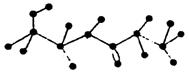 (1)该有机物的结构简式为________________。
(1)该有机物的结构简式为________________。
(2)该有机物不可能发生的化学反应有________(填序号)。
①水解 ②加聚 ③取代 ④消去 ⑤酯化 ⑥缩聚
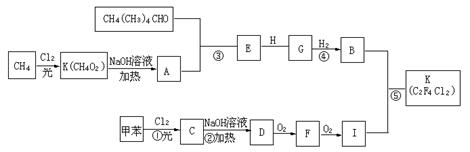
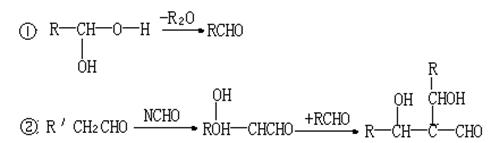
23.(10分)一种用于治疗高血脂的新药灭酯灵是按下图所示路线合成的。
|
|
已知:H的分子式为C![]() H
H![]() O
O![]() 试回答:
试回答:
(1)写出G的结构简式:____________________________。
(2)在反应②③④⑤中属于取代反应的是____________(填序号)。
(3)写出下列反应的化学方程式:
反应②__________________________________________
反应⑤__________________________________________
F与银氨溶液反应___________________________________
六、(本题包括1小题,共8分)
24.(8分)将51 g镁铝合金溶于60 mL 50mol·L![]() H
H![]() SO
SO![]() 溶液中,完全溶解后再加入65 mL10.0 mol·L
溶液中,完全溶解后再加入65 mL10.0 mol·L![]() 的NaOH溶液,得到沉淀的质量为9.7 g,继续滴加NaOH溶液时沉淀会减少。
的NaOH溶液,得到沉淀的质量为9.7 g,继续滴加NaOH溶液时沉淀会减少。
(1)当加入________mLNaOH溶液时,可使溶液在硫酸中的Mg![]() 和Al
和Al![]() 恰好完全沉淀。
恰好完全沉淀。
(2)计算合金溶于硫酸时所产生的氢气在标准状况下的休积。
参考答案
1.D 2.D 3.A 4.D 5.B 6.B 7.B 8.C 9.D 10.C 11.A 12.D 13.D 14.B 15.B 16.D 17.C
18.(1)醋酸 (2)饱和NaHCO![]() 溶液 除去二氧化碳中的醋酸杂质 (3)C
溶液 除去二氧化碳中的醋酸杂质 (3)C![]() H
H![]() Na溶液
Na溶液
C![]() H
H![]() O
O![]() +CO
+CO![]() +H
+H![]() O—→C
O—→C![]() H
H![]() OH+HCO
OH+HCO![]()
19.(1)溶液逐渐变蓝,烧瓶中气体逐渐变为红棕色,气球变大
(2)C D
(3)气球体积变小,瓶内气体颜色变浅 3NO![]() +H
+H![]() O====2NHNO
O====2NHNO![]() +NO
+NO
(4)2Cu+4HNO![]() +O
+O![]() ====2Cu(NO
====2Cu(NO![]() )
)![]() +2H
+2H![]() O (5)44.8
O (5)44.8
20.(1)铵态氮肥与碱肥混合会放出氨气,降低肥效。
(2)NH![]() HCO
HCO![]() 或者(NH
或者(NH![]() )
)![]() CO
CO![]() NH
NH![]() CH
CH![]() COOH
COOH
(3)c(Na![]() )>c(HCO
)>c(HCO![]() )>c(CO
)>c(CO![]() )>c(OH
)>c(OH![]() )>c(H
)>c(H![]() )
)
21.(1)O![]() +2H
+2H![]() O+4e
O+4e![]() ====4OH
====4OH![]()
(2)FeCl![]() +3H
+3H![]() O
O![]() Fe(OH)
Fe(OH) ![]() (胶体)+3HCl
(胶体)+3HCl
(3)1:10![]() H
H![]() (g)+
(g)+![]() O
O![]() (g) ====H
(g) ====H![]() O(1);ΔH=-285.8 kJ·mol
O(1);ΔH=-285.8 kJ·mol![]()
22.(1)![]()
(2)②⑥
23.(1)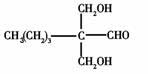
(2)②⑤
(3)

![]()
24.(1)60
(2)设合金中含有Mg,Al的物质的量分别为x、y,
则24g·mol![]() x*x+27g·mol
x*x+27g·mol![]() x*y=5.1 g ①
x*y=5.1 g ①
当加入的OH![]() 与原来H
与原来H![]() SO
SO![]() 溶液中的H
溶液中的H![]() 的物质的量相等时,Mg
的物质的量相等时,Mg![]() 、Al
、Al![]() 恰好沉淀完全,此时加入的NaOH溶液的体积为60×10
恰好沉淀完全,此时加入的NaOH溶液的体积为60×10![]() L×5.0 mol·L
L×5.0 mol·L![]() ×2÷10 mol·L
×2÷10 mol·L![]() =0.06 L=60 mL,再多加5 mL NaOH溶液所溶解的Al(OH)
=0.06 L=60 mL,再多加5 mL NaOH溶液所溶解的Al(OH)![]() 时质量为
时质量为
5×10![]() L×10 mol·L
L×10 mol·L![]() ×78 g·mol
×78 g·mol![]() =3.9 g,即沉淀的最大值为3.9g+9.7g=13.6 g。
=3.9 g,即沉淀的最大值为3.9g+9.7g=13.6 g。
故有58g·mol![]() ×x+78 g·mol
×x+78 g·mol![]() ×y=13.6 g ②
×y=13.6 g ②
由①②解得x=0.1
mol,y=0.1 mol,故产生H![]() 的物质的量为
的物质的量为
0.1 mol+0.1×1.5 mol=0.25 mol
故V(H![]() )=0.25 mol×22.4 L·mol
)=0.25 mol×22.4 L·mol![]() =5.6 L
=5.6 L
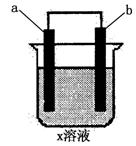 a极质量增加,b极放出无色气体
a极质量增加,b极放出无色气体