化学 氧族元素
【拓展延伸探究】
例题 1L ![]() 和aL空气燃烧,若反应前后物质都处于标准状况;试讨论当a的取值范围不同时,燃烧前后气体的总体积V的大小(用含a的代数式表示:假定空气中
和aL空气燃烧,若反应前后物质都处于标准状况;试讨论当a的取值范围不同时,燃烧前后气体的总体积V的大小(用含a的代数式表示:假定空气中![]() 和
和![]() 的体积比为4:1)。
的体积比为4:1)。
已知:![]() ,
,![]() 。
。
解析 ![]() 分别发生
分别发生![]() ,
,![]() 这样不同的反应,气体体积变化程度不同。一定体积(1L)的
这样不同的反应,气体体积变化程度不同。一定体积(1L)的![]() 在不定体积(aL)的空气中燃烧,发生哪种反应(生成
在不定体积(aL)的空气中燃烧,发生哪种反应(生成![]() 还是S),取决于
还是S),取决于![]() 的供应量(a的大小)。故题目要求进行不同情况下的讨论。
的供应量(a的大小)。故题目要求进行不同情况下的讨论。
若设生成S的反应为①、生成![]() 的反应为②,则因a的不同取值而发生反应的情况为:
的反应为②,则因a的不同取值而发生反应的情况为:
A.只发生反应①,且![]() 过量或适量;
过量或适量;
B.只发生反应②,且![]() 过量或适量;
过量或适量;
C.既发生反应①又发生反应②,![]() 、
、![]() 以两种比例参加反应。
以两种比例参加反应。
无论发生哪种反应,在反应过程中都既有气体体积的变化关系,又有电子转移的变化关系。所以解题时既可直接讨论气体体积变化关系,又可以以电子转移关系为契机,间接讨论气体体积关系。
解法1 aL空气中含![]() 为
为![]() L,含
L,含![]() 为
为![]()
(1)若a≤2.5,即只发生反应![]() 且
且![]() 过量或适量,则反应后的气态物质为
过量或适量,则反应后的气态物质为![]() 和
和![]() 或只有
或只有![]() 。
。
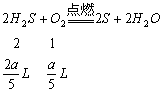
![]()
(2)当a≥7.5,即只发生![]() 且
且![]() 过量或适量,则反应后的气态物质为
过量或适量,则反应后的气态物质为![]() 、
、![]() 、
、![]() 或
或![]() 、
、![]() 。
。
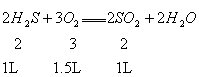
![]()
(3)若2.5<a<7.5,即![]() 和
和![]() 两个反应并存,则反应后的气态物质只有
两个反应并存,则反应后的气态物质只有![]() 和
和![]() 。化学反应的综合方程式为:
。化学反应的综合方程式为:
![]()
![]()
解法2 (1)若a≤2.5,参加反应的部分![]() 与
与![]() 之间发生电子转移:
之间发生电子转移:
![]() 。电子转移相等:
。电子转移相等:![]() 。
。
(2)若![]() ,参加反应的那部分
,参加反应的那部分![]() 与全部
与全部![]() 之间发生电子转移:
之间发生电子转移:
![]() (或
(或![]() )
)
电子转移相等:![]() 。
。
(3)若![]() ,全部
,全部![]() 与全部的
与全部的![]() 之间发生电子转移:
之间发生电子转移:
![]()
电子转移相等:![]() 。
。
【课本习题解答】
一、填空题
1.递增,增大,减弱,减弱,增强。
2.6。获得2,-2。+4,+6。
3.2
二、选择题
1.解析氧元素无正价,氧族元素的气态氢化物的稳定性随原子序数的递增而减弱。
答案B、C
2.解析半导体在金属元素与非金属元素分界处寻找。
答案 C
3.解析硫元素有多种单质,硫既具有氧化性又具有还原性。
答案B
4.答案D
5.答案A、B
三、问答题
1.相似点、不同点
①主要化合价:氧为-2,其他元素为:-2、+4、+6。
②原子半径不同,O、S、Se、Te原子半径依次增大。
③金属性、非金属性不同,O、S、Se、Te非金属性依次减弱、金属性依次增强。
④气态氢化物的化学式均为![]() ,气态氢化物的稳定性不同,还原性不同。
,气态氢化物的稳定性不同,还原性不同。
⑤最高价氧化物的化学式均为![]() ,最高价氧化物对应水化物的化学式为
,最高价氧化物对应水化物的化学式为![]() ,其酸性也不相同。
,其酸性也不相同。
主要原因:原子的最外层电子数均为6个,它们的化学性质相似。但它们的电子层数不同,原子半径不同,导致性质上的不同。
2.能说明氧的非金属性比硫强的事实是:
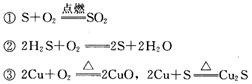
解释 氧原子、硫原子最外层电子数均为6,但氧原子电子层数比硫原子少,氧原子半径比硫原子小,导致硫原子得电子能力比氧原子弱,氧的非金属性比硫强。
3.臭氧的氧化性极强,人们可用臭氧作漂白剂、灭菌消毒剂及其他氧化剂;臭氧层吸收掉了来自太阳的大部分紫外线,使人们避免了紫外线的伤害。
四、计算题
1.
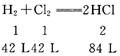
(1)消耗的![]() 的体积为42L
的体积为42L
(2)n(HCl)=84 L÷22.4 L/mol=3.75 mol
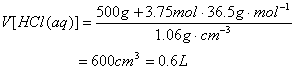
![]()
2.![]()
100 mL ![]() 溶液中含
溶液中含![]()
(1)2.44g ![]() 的物质的量=
的物质的量=![]()
(2)![]()
![]() 相对分子质量为244。
相对分子质量为244。
3.
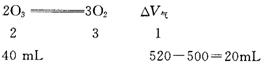
原混合气体中![]() 为40 mL,
为40 mL,![]() 为460 mL。
为460 mL。
