高三化学综合测试题
一.选择题(每小题只有一个正确选项,共54分)
1.我国决定推广使用车用乙醇汽油,它是在汽油中加入适量的乙醇形成的混合燃料。下列相关叙述中错误的是
A. 使用乙醇汽油能能减少有害气体的排放 B. 乙醇汽油是一种新型化合物
C.乙醇可以通过粮食发酵或化工合成等方法制得 D.甲醇、乙醇都属于可再生能源
2.下列分子中,所有原子不可能共处在同一平面上的是
A.C2H2 B.CS2 C.NH3 D.C6H6
![]() 3.已知卤代烃在碱性条件下易水解。某有机物的结构简式如下;lmol 该有机物与足量的NaOH 溶液混合共热,充分反应最多可消耗amolNaOH,将所得溶液蒸干后再与足量的碱石灰共热,又消耗bmol NaOH。则a与b的值分别是
3.已知卤代烃在碱性条件下易水解。某有机物的结构简式如下;lmol 该有机物与足量的NaOH 溶液混合共热,充分反应最多可消耗amolNaOH,将所得溶液蒸干后再与足量的碱石灰共热,又消耗bmol NaOH。则a与b的值分别是
A. 5mol,10mo1 B.6mol,2mol
C.8mol,4mol D.8mol,2mol
4. 下列说法或表示方法中正确的是:
A. 等质量的硫蒸气和硫磺分别完全燃烧,后者放出的热量多
B. 氢气的燃烧热为285.8kJ · mol-1,则氢气燃烧的热化学方程式为
2H2(g) + O2(g) = 2H2O(l);△H=-285.8 kJ· mol-1
C. Ba(OH)2 · 8H2O(s) + 2NH4Cl(s) = BaCl2(s) + 2NH3(g) + 10H2O(l);△H<0
D. 已知中和热为57.3 kJ · mol-1,若将含0.5mol H2SO4的浓溶液与含1mol NaOH的溶液混合,放出的热量要大于57.3 kJ
5. 已知C3N4晶体具有比金刚石还大的硬度,且每个原子的最外层均满足8电子结构。下列关于C3N4晶体的说法正确的是:
A. C3N4晶体可能是分子晶体,晶体中微粒间通过共价键相结合
B. C3N4晶体中每个碳原子连接4个氮原子,每个氮原子连接3个碳原子
C. C3N4晶体中,C—N键的键长比金刚石中C—C键的键长要长
D. C3N4晶体中每个氮原子上还有2对未共用电子
6. 下列各组顺序不正确的是:
A.粒子半径:S2->Cl ->F ->Na+>Mg2+ B.热稳定性:SiH4<PH3<NH3<H2O<HF
C.熔点: SiO2>NaCl>干冰>碘>臭氧 D.还原性:HF<HCl<HBr<HI<H2S
7. 下列除去杂质的方法正确的是
A. 除去FeCl2溶液中的少量FeCl3: 加入足量铁屑,充分反应后过滤
B. 除去CO2中的少量HCl: 通入Na2CO3溶液,收集气体
C. 除去N2中的少量O2: 通过灼热的CuO粉末,收集气体
D. 除去KCl溶液中的少量MgCl2: 加入适量NaOH溶液,过滤
8. 下列反应的离子方程式正确的是:
A. 用惰性电极电解MgCl2溶液:2Cl-+2H2O ![]() Cl2↑+H2↑+2OH -
Cl2↑+H2↑+2OH -
B. 向次氯酸钙溶液中通人过量CO2:ClO-+CO2+H2O = HClO+HCO3-
C. 小苏打溶液与甲酸溶液混合:HCO3-+H+ = H2O+CO2↑
D. 硫酸亚铁溶液中加入H2O2溶液:Fe2++H2O2+2H+ = Fe3++2H2O
9. 下列反应中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是:
A. NH4Cl![]() NH3↑+ HCl↑ B. Na2CO3+CO2+H2O=2NaHCO3
NH3↑+ HCl↑ B. Na2CO3+CO2+H2O=2NaHCO3
C. 2NaOH+Cl2 =NaCl+NaClO+H2O D. 2 Na2O2+2CO2=2Na2CO3+O2
10.物质的量浓度相同的下列溶液中,符合按pH由小到大顺序排列的是
A.Na2CO3 、NaHCO3 、NaCl 、NH4Cl B.Na2CO3 、NaHCO3、NH4Cl 、NaCl
C.(NH4)2SO4、NH4Cl、NaNO3、Na2S D.NH4Cl 、(NH4)2SO4、Na2S、NaNO3
11..在容积不变的密闭容器中,一定条件下进行如下反应:NO(g)+CO(g)=0.5N2(g)+CO2(g);
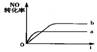 ΔH=-373.2
kJ/mol。右图曲线a表示该反应过程中,NO的转化率与反应时间的关系。若改变起始条件,使反应过程按照曲线b进行,可采取的措施是
ΔH=-373.2
kJ/mol。右图曲线a表示该反应过程中,NO的转化率与反应时间的关系。若改变起始条件,使反应过程按照曲线b进行,可采取的措施是
A.加催化剂 B.向密闭容器中加入氩气
C.降低温度 D.增大反应物中NO的浓度
12.A、B、C、D为四种短周期元素,已知A、C同主族,B、D同周期;A的气态氢化物比C的气态氢化物稳定;B的阳离子比D的阳离子氧化性强;B的阳离子比C的阴离子少一个电子层。下列叙述正确的是
A.原子序数:A>B>C>D B.单质熔点:D>B,A>C
C.原子半径:D>B>C>A D.简单离子半径:D>B>C>A
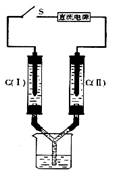 13.如右图所示装置,两玻璃管中盛满滴有酚酞溶液的NaCl饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。接通S后,C(Ⅱ)附近溶液变红,两玻璃管中有气体生成。下列说法正确的是
13.如右图所示装置,两玻璃管中盛满滴有酚酞溶液的NaCl饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。接通S后,C(Ⅱ)附近溶液变红,两玻璃管中有气体生成。下列说法正确的是
A.C(Ⅰ)的电极名称是正极
B.C(Ⅱ)的电极反应式是2Cl![]() -2e
-2e![]() =Cl2↑
=Cl2↑
C.电子从电源的负极沿导线流向C(Ⅱ)
D.电解过程中,C(Ⅰ)、C(Ⅱ)两极产生的气体质量相等
14.某校化学小组学生测定硫酸铜晶体里结晶水的含量。若实验测得硫 酸铜晶体中结晶水的含量偏低,造成此结果可能的原因有
①加热前所用的坩埚未完全干燥 ②加热时有少量固体溅出
③被测样品中含有加热易挥发的杂质 ④在空气中冷却后称量
⑤加热至样品还有淡淡的蓝色的就冷却称量
A.①④ B.②④ C.③⑤ D.④⑤
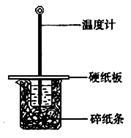 15.某实验小组学生按照课本实验要求,用50 mL0.5 mol/L的盐酸与50 mL0.55 mol/L的NaOH溶液在右图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算中和热。
15.某实验小组学生按照课本实验要求,用50 mL0.5 mol/L的盐酸与50 mL0.55 mol/L的NaOH溶液在右图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算中和热。
下列说法正确的是
A.实验过程中没有热量损失 B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的作用是固定小烧杯
D.若改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L的 NaOH溶液进行反应,从理论上说所求中和热不相等
16.在含有NaI、Na2SO3和FeBr2的溶液中通入足量的Cl2,将溶液在空气中加热蒸干并充分灼烧,最终得到的固体物质是
A.NaCl、FeCl3、Na2SO4 B.NaCl、FeBr2、Na2SO4 C.NaCl、Fe2O3、Na2SO4 D.NaBr、Fe(OH)3
17.已知在一定条件下,将1molSO3(g)充入一固定容积的密闭密闭容器中,发生反应
![]() 2SO3(g) 2SO2(g)+O2(g)达到平衡时,混合气体的压强比开始时增大了20%。若起始充入1molSO2和1molO2,在相同条件下建立平衡,则该情况下SO2的转化率为
2SO3(g) 2SO2(g)+O2(g)达到平衡时,混合气体的压强比开始时增大了20%。若起始充入1molSO2和1molO2,在相同条件下建立平衡,则该情况下SO2的转化率为
A.20% B.20%—60% C.60% D.大于60%
18.将2molNaHCO3 和一定量 Na2O2固体混合,在加热条件下,让其充分反应,在150℃时所 得气体仅含两种成分,反应后固体的物质的量n的取值范围是
![]()
![]() A.n 1mol B. 1mol<n<2mol C. 2 mol n < 4mol D. n>4mol
A.n 1mol B. 1mol<n<2mol C. 2 mol n < 4mol D. n>4mol
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
二.实验题(共2小题,15分)
19.(5分)现有下列仪器和用品: ①铁架台(含铁圈、各种铁夹) ②锥形瓶
③酸式与碱式滴定管 ④烧杯 ⑤玻璃棒 ⑥胶头滴管 ⑦天平(含砝码、镊子) ⑧滤纸
![]()
![]()
![]() ⑨分液漏斗 ⑩普通漏斗 双孔塞和导管 药匙
⑨分液漏斗 ⑩普通漏斗 双孔塞和导管 药匙
现有下列试剂:碱石灰、标准NaOH溶液、未知浓度的盐酸、蒸馏水、Na2CO3固体、MnO2、
NH4Cl固体、H2O2溶液。
(1) 过滤时应选用的仪器是(填编号)____________________.
(2) 配制500ml 0.1mol/lNa2CO3溶液,还缺少的仪器是___________________.
(3) 测定盐酸的物质的量浓度还缺少的试剂是_________________________.
(4)
|
20.(10分)工业上用固体硫酸亚铁制取颜料铁红![]() ,反应原理是:2FeSO4 ==Fe2O3+SO3+SO2。某研究性学习小组用下图所示装置分别检验该反应所产生的气态物质,然后利用装A瓶内的生成物来测定已分解的
,反应原理是:2FeSO4 ==Fe2O3+SO3+SO2。某研究性学习小组用下图所示装置分别检验该反应所产生的气态物质,然后利用装A瓶内的生成物来测定已分解的![]() 的质量。(已知
的质量。(已知![]() ) 请回答相关问题:
) 请回答相关问题:
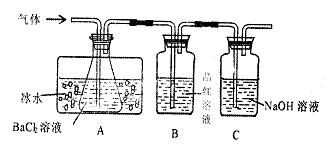 |
(1)本实验中,A瓶所盛BaCl2:溶液可以吸收的气体是 ,发生反应的离子方程式为 。
(2)A瓶所盛的试剂的作用是 ;
C瓶所盛试剂的作用是 。
(3)A瓶要用冷水冷却的原因是
(4)某学生欲利用装置B反应前后质量差确定已分解的![]() 质量,你认为该同学方案是否合理 (填“合理”、“不合理”),理由是
。
质量,你认为该同学方案是否合理 (填“合理”、“不合理”),理由是
。
(5)依据上述装置和反应事实,请设计测定己分解![]() 质量的操作和方法:
质量的操作和方法:
。
21.(8分)已知A、B、C、D均为短周期元素,且原子序数依次递增;A、B、C三种元素的核电荷数之和等于D元素的核电荷数,且D元素的核电荷数为C的2倍;C、D两元素同主族,且能在一定条件下发生下面两个反应: ①化合物(只含A、B)跟化合物(只含B、C)按物质的量比2:3反应生成单质(含B)和化合物(只含A、C),②化合物(只含A、D)跟化合物(只含C、D) 按物质的量比2:1反应生成单质(含D)和化合物(只含A、C).请通过分析后回答:
⑴B元素的名称是________________,C元素的原子结构示意图为__________________
⑵D元素最高价氧化物的水化物的化学式是_______,反应①中的化合物(只含A、B)分子的空间构型为____________________
⑶反应②的化学方程式为____________________,其中每生成单质D32g,反应中有___ mol电子转移。
⑷含有这四种元素(四种元素都含有)的各种化合物中,相同浓度下,溶液的pH最小的化合物的化学式为_________,该化合物的晶体中阳离子与阴离子的个数比为___________________。
22.(5分)现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作回答问题:
(1)取10 mL的甲溶液,加入等体积的水,醋酸的电离平衡________________移动(填“向左”、“向右”或“不”);另取10 mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将____________
(填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH(甲)_______________pH(乙)(填“大于”、“小于”或“等于)。
(3)各取25 mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(甲)__________________V(乙)(填“大于”、“小于”或“等于”)。
(4)取25 mL的甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中c(Na+)、c(CH3COO-)的大小关系为:c(Na+)___________c(CH3COO-)(填“大于”、“小于”或“等于”)。
23.10分)已知A为酸式盐,B为某二价主族金属(其原子序数不超过20)的化合物,常温常
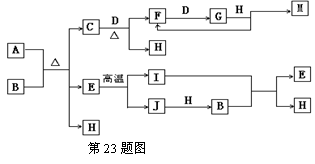 压下C、D、F、G、I均呈气态,H为无色液体。等物质的量的A、B充分混合后加热能恰好完全反应(如下图所示),E的式量为100,G的式量比F大16。图中反应条件(除加热外)均已略去。
压下C、D、F、G、I均呈气态,H为无色液体。等物质的量的A、B充分混合后加热能恰好完全反应(如下图所示),E的式量为100,G的式量比F大16。图中反应条件(除加热外)均已略去。
⑴写出B的电子式________________ I的结构式 。
⑵写出下列反应的离子方程式:
① 向A溶液中加入过量的NaOH溶液,
并加热 ,
②气体I通入B溶液中 ,
⑶写出C和D反应的化学方程式 ..
⑷如对盛有气体G的密闭容器(带可移动的活塞)进行突然压缩操作,产生的现象是______ ____________________________________ ,原因是_______________________________ _____________________________________________________________________。
24.(10分)已知一个碳原子上连有两个羟基时,易发生如下图的转化: 请根据下图回答。
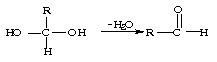 (1)E中含有官能团的名称是
;③的反应类型是
,C跟新制的氢氧化铜反应的化学方程化为
;
(1)E中含有官能团的名称是
;③的反应类型是
,C跟新制的氢氧化铜反应的化学方程化为
;
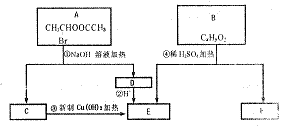 (2)已知B的相对分子质量为162,其燃烧产物中
(2)已知B的相对分子质量为162,其燃烧产物中![]() 则B的分子式为
,F的分子式为
。
则B的分子式为
,F的分子式为
。
(3)在电脑芯片生产领域,高分子光阻剂是光刻蚀![]() 线宽芯片的关键技术。F是这种高分子光阻剂生产中的主要原料。F具有如下特点:①能跟
线宽芯片的关键技术。F是这种高分子光阻剂生产中的主要原料。F具有如下特点:①能跟![]() 溶液发生显色反应:②能发生加聚反应;③芳环上的一氯代物只有两种。
溶液发生显色反应:②能发生加聚反应;③芳环上的一氯代物只有两种。
F在一定条件下发生加聚反应的化学方程式为 。
(4)化合物G是F的同分异构体,它属于芳香族化合物,能发生银镜反应。G可能有 种结构,
写出其中任一种同分异构体的结构简式 。
![]() 25. (8分)如图所示,将6molX和3molY混合气体置于体积可变的等压容器中,在一定温度下发生如下反应:2X(g)+Y(g) 2Z(g) ,反应达到平衡状态A时,测得气体总物质的量为6.6mol。若X、Y、Z的起始物质的量分别用a、b、c表示,请回答下列问题:
25. (8分)如图所示,将6molX和3molY混合气体置于体积可变的等压容器中,在一定温度下发生如下反应:2X(g)+Y(g) 2Z(g) ,反应达到平衡状态A时,测得气体总物质的量为6.6mol。若X、Y、Z的起始物质的量分别用a、b、c表示,请回答下列问题:
(1)达平衡状态A时,Y的转化率为 ,向达到平衡状态A的容器中通人
少量Y,体系中X的体积分数 (填“增大”或“减小”或“不变”)。
(2)若起始时a=3.2mol且达到平衡后各气体的体积分数与平衡状态A相同,则起始时 b、c 的取值分别为 。
(3)若要使反应开始时向逆反应方向进行,且达到平衡后各气体的物质的量与平衡状态A相同,则起始时C的取值范围是 .
26.(10分)向盛有400mL某浓度稀HNO3的大烧杯中加入Wg铁粉,充分反应后,铁粉质量减少16.8g,再往烧杯中加入V mL 4 mol·L-1的稀硫酸,充分反应后,铁粉质量又减少8.4g,此时铁粉仍有剩余,(假设稀HNO3只被还原为NO)
⑴写出题中铁粉与稀HNO3反应的离子方程式___________________________________,
通过计算得出所用的稀HNO3的物质的量浓度为_______________ mol·L-1,加稀H2SO4之前,溶液中剩余的NO3-的物质的量为___________mol。
⑵加入4 mol·L-1的稀硫酸的体积V =_______________________
⑶若硫酸足量,要使反应有H2产生,W的取值范围是_______________________。
参考答案
1.B2C,3D4,D5B6.C7.A8.B9.D.10.c11.C12C.13.C14D.15.B16C17D.18C
20.(1)
![]() (2分)
(2分)
(2)检验生成的![]() ;吸收未完全反应的
;吸收未完全反应的![]() ,防止污染空气。(每空1分,共2分)
,防止污染空气。(每空1分,共2分)
(3)因为![]() 溶解放热,防止形成酸雾,使
溶解放热,防止形成酸雾,使![]() 吸收完全。(2分)
吸收完全。(2分)
(4)不合理,(1分)品红溶液不能将![]() 完全吸收。(1分)
完全吸收。(1分)
(5)将装置A中的沉淀过滤、洗涤、干燥、称量,依据称量结果(![]() 的质量)计算出已分解硫酸亚铁质量。(操作2分.方法2分,共4分。如果用称量A装置的质量变化来确定 已分解硫酸亚铁质量酌情给分
的质量)计算出已分解硫酸亚铁质量。(操作2分.方法2分,共4分。如果用称量A装置的质量变化来确定 已分解硫酸亚铁质量酌情给分
21(1)氮 ;O
 (2)H2SO4
; 三角锥形
(2)H2SO4
; 三角锥形
(3)2H2S +SO 2=3S+2H2O ;4/3 (4)NH4HSO4 1:1
22..(共10分,每空2分)
(1)向右 减小 (2)小于 (3)大于 (4)小于
23.(14分)
(1)[H
![]() ] -Ca2+[
] -Ca2+[![]() H ] – (2分) O=C=O (2分)
H ] – (2分) O=C=O (2分)
(2)①NH4++HCO3-+2OH -![]() CO32-+2H2O+NH3↑(2分)
CO32-+2H2O+NH3↑(2分)
![]() ②CO2 +Ca2++2OH -=CaCO3↓+H2O (2分)
②CO2 +Ca2++2OH -=CaCO3↓+H2O (2分)
(3)4 NH3+5O2 4NO+6H2O (2分)
(4)气体颜色先变深,再逐渐变浅(2分);压缩容器将使有色气体NO2浓度增大,颜色加深,又因平衡2 NO2 ![]() N2O4 向右移动,颜色变浅(2分)。
N2O4 向右移动,颜色变浅(2分)。
![]() 24.(1)羧基;氧化反应;
24.(1)羧基;氧化反应;![]()
![]() (每空1分,方程式2分,共4分)(2)
(每空1分,方程式2分,共4分)(2)
![]() (每空2分,共4分)⑶、⑷略
(每空2分,共4分)⑶、⑷略
25.(1)80%(2分)减小(1分)(2)![]() (1分)c为任意值(2分);
(1分)c为任意值(2分);
![]() (3)4.8<C 6(3分)
(3)4.8<C 6(3分)
26.(1)3Fe +8H+ +2NO3-=3Fe2++2 NO↑+4H2O(2分),2(3分),0.6(3分)
(2)50.0(3分)
(3)W>67.2(3分)