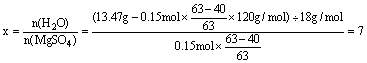全国大联考(广东专用)
2006届高三第八次联考·化学试卷
编审:江西金太阳教育研究所化学研究室
考生注意:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共150分,考试时间120分钟。
2.请将各卷答案填在试卷后面的答题卷上。
3.本试卷主要考试内容:高中化学全部内容。
4.可能用到的相对原子质量:H 1 C 12 N 14 O 16 Mg 24 K 39 Fe 56
第Ⅰ卷 (选择题 共67分)
一、选择题(本题包括9小题,每小题3分,共27分。每小题只有一个选项符合题意)
1.最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”——全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法中正确的是
A.分子中三个碳原子可能处于同一直线上
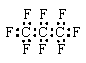 |
B.全氟丙烷的电子式为:
C.相同压强下,沸点:C3F8<C3H8
D.全氟丙烷分子中既有极性键又有非极性键
2.在搪瓷和陶瓷器具表面的釉质中含有极微量的Pb、Cd、Sb等重金属盐类,为防止慢性中毒,不能长期用搪瓷和陶瓷器具盛放的物质是
A.酱油 B.食醋 C.蔗糖 D.食盐
3.下列现象与氧化还原反应有关的是
A.碳酸钠溶液中加入氯化钙溶液产生沉淀 B.氢气球升到高空发生爆炸
C.石灰石溶于盐酸产生无色无味的气泡 D.氢气在氧气中燃烧产生淡蓝色火焰
4.镧(La)是一种活动性比锌更强的元素,它的氧化物的化学式为La2O3,La(OH)3是不溶于水的碱,而LaCl3、La(NO3)3都溶于水。由此判断下列几组反应中,不能直接用来制LaCl3的是
A.La2O3+HCl B.NaCl+La(OH)3
C.La(OH)3+HCl D.La+HCl
5.下列说法中不正确的是
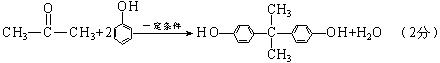
A.1 mol强酸与1mol强碱发生中和反应所放出的热量叫做中和热
B.用渗析法可除去鸡蛋白溶液中少量的氯化钠杂质
C.冰的密度比水小可以用氢键来解释
D.蔗糖无醛基而麦芽糖有醛基
6.下列叙述中指定粒子数目一定大于NA的是
A.11.2 L N2和NO的混合气体所含的原子数
B.12g 14C中所含的碳原子数
C.28g铁在反应中作还原剂时,失去电子的数目
D.1 L 0.1 mol·L-1 CH3COOH溶液中所含的分子总数
7.下列实验不能达到预期目的的是
| 序号 | 实验操作 | 实验目的 |
| A | 浓、稀HNO3分别与Cu反应 | 比较浓、稀HNO3的氧化性强弱 |
| B | MgCl2、AlCl3溶液中分别通入NH3 | 比较镁、铝的金属性强弱 |
| C | 测定等浓度的H3PO4、H2SO4两溶液的pH | 比较磷、硫的非金属性强弱 |
| D | 用等浓度的盐酸、碳酸氢钠两溶液混合反应 | 比较盐酸、碳酸的酸性强弱 |
8.混合下列各组物质使之充分反应,加热蒸干,并在300℃灼烧至质量不变,最终残留固体为纯净物的是
A.向CuSO4溶液中加入适量铁粉
B.等物质的量浓度、等体积的(NH4)2SO4与BaCl2溶液
C.等物质的量的NaHCO3与Na2O2固体
D.在NaBr溶液中通少量Cl2
9.将21.6g FeC2O4隔绝空气加热,分解得到10.8g铁的氧化物,则所得气体产物的成分及其物质的量为
A.0.15 mol CO B.0.3 mol CO2
C.0.15 mol CO和0.15 mol CO2 D.0.25 mol CO和0.25 mol CO2
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分;选两个且都正确的给满分,但只要选错一个,该小题就为0分)
10.拟晶(quasicrystal)是一种具有凸多面体规则外形但不同于晶体的固态物质。Al65Cu23Fe12是2000年之前发现的几百种拟晶之一,具有合金的某些优良物理性能。有关这种拟晶的说法中错误的是
A.Al65Cu23Fe12的硬度比金属Al、Cu、Fe都大
B.Al65Cu23Fe12中三种金属的化合价均可看做零
C.Al65Cu23Fe12不可用做长期浸泡在海水中的材料
D.1 mol Al65Cu23Fe12溶于过量的硝酸时共失去265mol电子
11.对室温下pH相同、体积相同的氨水和氢氧化钠溶液分别采取下列措施,其中叙述正确的是
A.分别加水稀释10倍,两溶液的pH仍相等
B.温度下降10℃,两溶液的pH均不变
C.加入适量的氯化铵晶体后,两溶液的pH均减小
D.用盐酸中和,消耗盐酸的体积相同
12.下列反应的离子方程式表示正确的是
A.少量氢氧化钙溶液与碳酸氢钠溶液反应:![]()
B.金属铝溶于氢氧化钠溶液:Al+2OH![]() ==
==![]() +H2↑
+H2↑
C.氨水中滴加稀盐酸:NH3+H+==NH4+
D.亚硫酰氯(SOCl2)剧烈水解生成两种酸:SOCl2+2H2O==H2SO3+2H++2Cl—
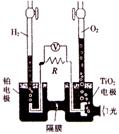 13.TiO2在光照射下可使水分解:2H2O
13.TiO2在光照射下可使水分解:2H2O![]() 2H2↑+O2↑,该过程类似植物的光合作用。右图是光照射下TiO2分解水的装置示意图。下列叙述中正确的是
2H2↑+O2↑,该过程类似植物的光合作用。右图是光照射下TiO2分解水的装置示意图。下列叙述中正确的是
A.该装置可以将光能转化为电能,同时也能转化为化学能
B.铂电极上发生的反应为:2H++2e—==H2↑
C.该装置工作时,电流由TiO2电极经R流向铂电极
D.该装置工作时,TiO2电极附近溶液的pH变大
14.关于某无色溶液中所含离子的鉴别,下列判断中正确的是
A.通入Cl2后,溶液变为黄色,加入淀粉溶液后溶液变蓝,可确定有I—存在
B.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO42—存在
C.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有Cl—存在
D.加入盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中不一定有CO32—
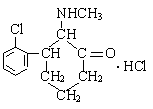 15.“K”粉,在医学上称氯胺酮,是一种白色粉末,属于静脉全麻药品,具有一定的精神依赖性。目前,该药物已被我国药检部门列为第二类精神药品管理。其结构简式如右图,则下列说法中正确的是
15.“K”粉,在医学上称氯胺酮,是一种白色粉末,属于静脉全麻药品,具有一定的精神依赖性。目前,该药物已被我国药检部门列为第二类精神药品管理。其结构简式如右图,则下列说法中正确的是
A.“K”粉的化学式为C13H18NOCl2
B.“K”粉能与NaOH溶液发生反应
C.1 mol“K”粉在一定条件下可与4 mol H2发生加成反应
D.“K”粉分子中最多有7个C原子处于同一平面
16.按下图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到液 体,则X气体可能是
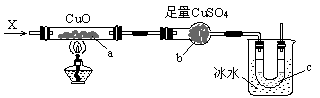
A.H2 B.CO和H2 C.NH3 D.CH3CH2OH(g)
17.在373K时,密闭容器中充入一定物质的量的NO2和SO2,发生如下反应:NO2+SO2![]() NO+SO3,平衡时,下列叙述中正确的是
NO+SO3,平衡时,下列叙述中正确的是
A.NO和SO3的物质的量一定相等
B.NO2和SO2的物质的量一定相等
C.体系中总的物质的量一定等于反应开始时总的物质的量
D.SO2、NO2、NO、SO3的物质的量一定相等
18.向含1mol HCl和1mol MgSO4的混合溶液中加入1mol·L—1的Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是
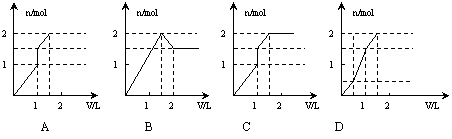 |
19.已知NaHSO3溶液和Na2CO3溶液混合后加热煮沸能产生CO2气体。现有浓度均为0.1 mol·L—1的NaHSO3溶液和NaHCO3溶液,则两溶液中各粒子物质的量浓度的关系一定正确的是(R表示S或C)
A.c(Na+)+c(H+)=c(HRO3—)+c(RO32—)+c(OH—)
B.c(H+)+c(H2RO3) = c(RO32—)+c(OH—)
C.c(Na+)>c(HRO3—)>c(H+)>c(OH—)>c(RO32—)
D.c(HRO3—)>c(H2RO3)>c(OH—)>c(RO32—)>c(H+)
第Ⅱ卷 (非选择题 共83分)
三、(本题包括2小题,共24分)
20.(9分)(1)下列有关实验的操作方法或现象有误的是 。

(2)Fe(OH)3胶体外观与Fe(SCN)3溶液相似,请设计一种简单的方法将它们鉴别出来且不破坏它们: 。
(3)如何检验Fe(OH)3胶体中是否混有Fe3+,简述实验方法: 。
21.(15分) (1)背景:2003年抗“非典”、2005年抗“禽流感”中,“过氧乙酸”是广泛用于医院、禽舍等方面的消毒液。“过氧乙酸”的消毒液成分和消毒原理引起了某化学兴趣小组的关注。
(2)查询资料:
资料一:H2O2是极弱的电解质,在酸性介质中才能稳定存在,是一种强氧化剂;
CH3COOH是弱酸,也能使蛋白质变性,是一种消毒液。
资料二:过氧乙酸消毒液是由H2O2、H2O、CH3COOH及少量H2SO4混合后,反应生成过氧乙酸(CH3COOOH),反应的化学方程式为CH3COOH+H2O2![]() CH3COOOH+H2O。CH3COOOH容易放出原子氧,它与空气中微生物机体作用,达到灭菌目的,是消毒液的主要成分。
CH3COOOH+H2O。CH3COOOH容易放出原子氧,它与空气中微生物机体作用,达到灭菌目的,是消毒液的主要成分。
(3)实验研究:兴趣小组找到过氧乙酸商品,下面是市售过氧乙酸的商品、标签。
| 过氧乙酸 本品包括甲、乙两种溶液,体积各500mL,把甲、乙溶液各1份 在玻璃容器中混合后,放置24h后,产生过氧乙酸浓度不少于10%, 应用50倍纯水稀释(浓度为0.2%),稀释后才能使用。 |
研究过程:
①提出假设:略。
②实验探究:取甲、乙两种溶液少许,分别用干燥的蓝色石蕊试纸检验,前者的现象为先变红后褪色,后者的现象为变红后不褪色。
③得出结论:。
甲溶液的主要成分为 。
乙溶液的主要成分为 。
④有效成分含量测定:某同学设计了测定的方案(不需详细的操作过程)。
用已知浓度的NaOH溶液滴定乙,测定其中的有效成分含量。
(a)用酚酞作指示剂。
(b)用到的玻璃仪器除了玻璃棒、量筒、胶头滴管外还缺 。
(c)滴定前仰视、滴定后俯视则测到的有效成分含量 (选填“偏高”、“偏低”或“不变”)。
(d)请简要说出测定另一有效成分的方法(不需详细的操作过程):
。
(4)请你为本实验拟一研究报告题目: 。
四、(本题包括2小题,共21分)
22.(10分)以下是周期表中短周期元素的有关数据x,x表示元素原子获得电子的能力。
| 0.98 | 1.57 | 2.04 | a 2.55 | b | c 3.44 | d 3.98 | ||||||||
| e 0.93 | 1.48 | f 1.61 | 1.90 | 2.19 | g 2.58 | h 3.16 |
(1)x越大,表示该元素原子越 (填“难”或“易”)形成阴离子。
(2)一般来讲,两元素的x值差(△x)大于1.7时,形成离子键;小于1.7时,形成共价键,则f、c组成的化合物属 化合物。
(3)能否用电解f、h化合物的水溶液制取f, (填“能”或“否”),用电解化学方程式表示为 。
(4)a~h中两种元素组成的化合物或单质,在某隔热的密闭容器中反应示意图如下。
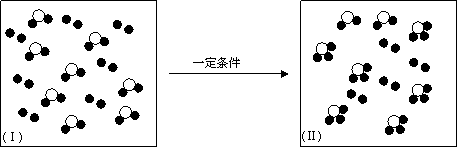 |
I表示反应前的分子状况,Ⅱ表示容器温度不再升高的分子状态,●和○分别表示不同的原子。
该反应的化学方程式为(不必注明反应条件) 。
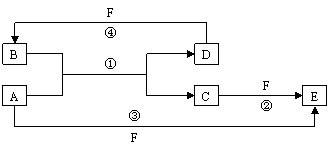 |
23.(11分)A、B、C、D、E、F六种物质的转化关系如下图所示(反应条件和部分产物未标出)。
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为 ,反应④的化学方程式为:
(F为浓溶液) 。
(2)若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是 。已知常温下1 g D与F反应生成B(气态)时放出92.3kJ热量,写出该反应的热化学方程式:
。
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为 。
五、(本题包括2小题,共18分)
24.(8分)有机物A为食品包装纸的常用防腐剂。A碳链无支链,可以使溴水褪色,难溶于水,但在酸性条件下可以发生水解反应,生成二元不饱和有机酸B和饱和一元醇C。一定量的C完全燃烧,生成的水物质的量是二氧化碳的两倍。B、C的混合物,只要总物质的量一定,不管以何种比例混合,完全燃烧生成的水物质的量也一定。B是符合上述条件相对分子质量最小的分子。
(1)B分子所含官能团的名称是 。
(2)C的分子式为 。
(3)由B制取A的化学方程式是 。
(4)高分子化合物M可由有机物B在一定条件下反应制得,其各元素质量分数与B完 全相同,则高分子化合物M的结构简式是 。
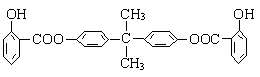
25.(10分)利用芳香烃X和链烃Y可以合成紫外线吸收剂BAD,已知G不能发生银镜反应,BAD的结构简式如下:
BAD的合成路线如下图所示:
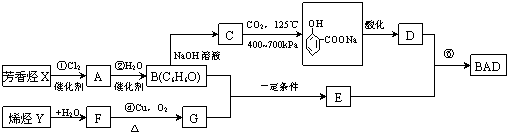 |
试回答下列问题:
(1)写出结构简式:X ,Y 。
(2)在反应①~⑤中,属于取代反应的有 (填数字序号)。
(3)写出下列反应的化学方程式:
反应④: ;
B+G→E: 。
六、(本题包括2小题,共20分)
26.(8分)NaHCO3在潮湿的空气中会缓慢分解,Na2CO3会吸收空气中的水分:Na2CO3
+nH2O==Na2CO3·nH2O(n为平均值,n≤10)。取没有妥善保管的NaHCO3样品9.16g,溶于水制成溶液,慢慢滴入稀盐酸并不停地搅拌,加入盐酸的体积与生成的CO2的体积(标准状况)如下表。(溶于水的CO2不计)
| 盐酸的体积(mL) | 4 | 8 | 15 | 20 | 50 | 120 | 150 |
| 生成CO2的体积(mL) | 0 | 0 | 112 | 224 | 896 | 2240 | 2240 |
求:
(1)稀盐酸的物质的量浓度。
(2)样品中的成分及成分的物质的量。
27.(12分)有下列实验:将过量Mg粉溶于100mL 1.5mol·L—1的稀H2SO4中,反应结束后, 滤去多余Mg粉,滤液在保持t℃的恒温下蒸发水分,当滤液质量为63 g时开始析出 MgSO4·xH2O晶体,当析出晶体13.47g时,剩下滤液40g。请计算下列各小题:
(1)生成标准状况下的气体体积。
(2)开始析出MgSO4·xH2O晶体时溶液的质量分数。
(3)t℃时MgSO4的溶解度。
(4)MgSO4·xH2O中x的值。
参考答案及评分标准
一、选择题(本题包括9小题,每小题3分,共27分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | D | B | D | B | A | D | B | B | C |
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。)
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 |
| 答案 | D | C | D | AB | AD | BC | D | AC | D | B |
三、20.(1)ACD (3分)
(2)利用丁达尔效应鉴别(3分)
(3)先渗析,再滴加KSCN溶液(3分)
21.(3)③H2O2、H2O、H2SO4 (3分);CH3COOH、H2O (2分)
④(b)锥形瓶、滴定管、烧杯(3分);(c)偏低(2分)
(c)使H2O2分解,测O2的体积计算含量(答案合理即可)(3分)
(4)关于“过氧乙酸”消毒液成分的研究报告(2分)
22.(1)易(2分)
(2)离子(2分)
(3)否(1分);2AlCl3 + 6H2O![]() 2Al(OH)3↓+3H2↑+3Cl2↑ (3分)
2Al(OH)3↓+3H2↑+3Cl2↑ (3分)
(4)2SO2
+ O2 ![]() 2SO3 (2分)
2SO3 (2分)
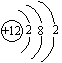 |
23.(1)
(2分);C + 4HNO3(浓)![]() CO2↑ + 4NO2↑ +2H2O(2分)
CO2↑ + 4NO2↑ +2H2O(2分)
(2)2Fe2+ + Cl2 == 2Fe3+ + 2Cl— (2分)
H2(g)+ Cl2(g)== 2HCl(g);△H = -184.6kJ·mol-1 (3分)
(3)2C + SiO2![]() 2CO↑+ Si
(2分)
2CO↑+ Si
(2分)
24.(1)羧基、碳碳双键 (2分)
(2)CH4O (2分)
(3)HOOCCH=CHCOOH+2CH3OH![]() CH3OOCCH=CHCOOCH3+2H2O (2分)
CH3OOCCH=CHCOOCH3+2H2O (2分)
![]()
25.(1)![]() (2分);CH3—CH=CH2
(2分)
(2分);CH3—CH=CH2
(2分)
(2)①②⑤ (2分)
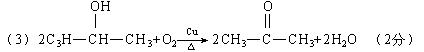
26.(1)1.0 mol·L-1 (3分)
(2)NaHCO3:0.090 mol (2分);Na2CO3·3H2O:0.010 mol (3分)
提示:(1)反应前一阶段的离子反应为CO32- + H+ == HCO3— ,后一阶段的离子反应为HCO3— + H+ == CO2↑+H2O
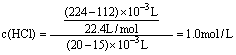
(2)由表中可判断原溶液中![]()
用于把CO32-转化为HCO3—的盐酸的物质的量为:
1.0mol·L-1×15×10-3L-![]() = 0.01mol,即n(CO32-) = 0.01mol
= 0.01mol,即n(CO32-) = 0.01mol
故n(NaHCO3) = 0.1mol-0.01mol = 0.090mol,
n(结晶水)=![]()
所以n值为:![]()
故还有0.010mol的Na2CO3·3H2O
27.(1)3.36 L (3分);(2)28.6% (3分);(3)40g (3分);(4)7 (3分)
提示:(1)![]() V
V
(H2)= 0.15mol×22.4L/mol = 3.36L
(2)n(MgSO4) = n(H2SO4) = 0.15mol
m(MgSO4) = 120g·mol-1 ×0.15mol = 18 g
w(MgSO4)
= ![]() ×100% = 28.6%
×100% = 28.6%
(3)S = ![]()
(4)在MgSO4·xH2O中: