广元市高中2006年级第一次高考适应性统考
化 学 试 题
说明:1、本试卷分第Ⅰ卷(选择题)和第Ⅱ(非选择题)两部分。答第Ⅰ卷时,每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号,不能答在试题卷上。
2、全卷满分110分,考试时间90分钟。
3、供解题时参考的数据——相对原子质量:
H—1 N—14 O—16 Na—23 S—32
Cl—35.5 Cu—64 Br—80 Ag—108 Ba—137
第Ⅰ卷 选择题(共44分)
| 得分 | 评卷人 |
一、选择题(本题包括11小题,每小题4分,共44分。每小题只有一个选项符合题意。)
1.下列分子的电子式写正确的是
|
![]()
![]()
![]() A. 氨气H N H
B. 四氯化碳
A. 氨气H N H
B. 四氯化碳![]() C. 氮气:N
C. 氮气:N![]() D. 二氧化碳
D. 二氧化碳 ![]()
2.已知下列元素的原子半径
| 元素 | N | S | O | Si |
| 原子半径(10-10m) | 0.75 | 1.02 | 0.74 | 1.17 |
根据以上数据,磷原子的半径(10-10m)可能是
A. 0.80 B. 1.10 C. 1.20 D. 0.70
3.下列产品的使用不会对环境造成污染的是
A. 酒精 B. 含磷洗衣粉 C. 氟里昂 D. 含汞电池
4.实验室配制的FeCl3溶液经常是浑浊的。为了获得比较澄清透明的FeCl3溶液,某学生采用下列几种方法,其中正确的是
A. 加入过量铁粉后过滤 B. 将溶液加热后过滤
C. 用渗析的方法除去浑浊物 D. 滴入少量盐酸
5.下列各组离子在溶液中可以大量共存的是
A.![]() 、Fe3+、
、Fe3+、![]() 、Cl- B.
、Cl- B.
![]() 、OH-、Fe2+、Mg2+
、OH-、Fe2+、Mg2+
C. Cl-、![]() 、Na+、Ag+ D.
NH
、Na+、Ag+ D.
NH![]() 、Ba2+、Cl-、
、Ba2+、Cl-、![]()
6.NA为阿伏加德罗常数,下列说法正确的是
A. 同温同压下,相同体积的任何气体单质所含的原子数目相同
B. 常温常压下,11.2L氮气所含的原子数目为NA
C. 标准状况下,22.4L单质溴所含有的原子数目为2NA
D. 电解食盐水若产生2g氢气,则转移的电子数目为2NA
7.向某溶液加入BaCl2溶液时无沉淀生成。再向此液体中加入NaOH溶液时则出现白色沉淀。原溶液中可能存在的阴离子是
A. HSO![]() B.
HCO
B.
HCO![]() C.
CO
C.
CO![]() D.
SO
D.
SO![]()
8.把硫和强碱(如NaOH)加热至沸,反应后,硫转化为S2-和![]() ,则反应的S和生成的S2-、
,则反应的S和生成的S2-、![]() 的物质的量之比为
的物质的量之比为
A. 2:1:1 B. 3:2:1 C. 3:1:2 D. 4:1:3
9.下列实验操作正确的是
A. 将氢氧化钠放在滤纸上称量
B. 用10mL量筒量取8.52mL蒸馏水
C. 配制0.5mol/L的NaOH溶液时,将溶解NaOH的烧杯洗2—3次,并将洗涤液转入容量瓶中
D. 制取氯气时,用二氧化锰与浓盐酸在常温下反应,并用排水集气法收集
10.能正确表示下列化学反应的离子方程式是
A. 金属钠投入冷水中:2Na+2H2O=2Na++2OH-+H2↑
B. 硫化钠的第一步水解:S2-+2H2O=H2S↑+2OH-
C. 氯化铁溶液中加入铁粉:Fe3++Fe=2Fe2+
D. 碳酸钙溶于硝酸中:![]()
11.100mL 0.1mol/L的盐酸与50mL 0.2mol/L的氨水混合后,下列关系式正确的是
A. ![]()
B. ![]()
C. ![]()
D. ![]()
广元市高中2006年级第一次高考适应性统考
化 学 试 题
(满分110分,90分钟完卷)
总 分 表
| 题号 | 二 | 三 | 四 | 五 | 总分 | 总分人 |
| 得分 |
第Ⅱ卷 非选择题(共66分)
| 得分 | 评卷人 |
二、完成下列各题(共26分)
12.(10分)A、B、C、D、E、F为原子序数依次增大的同周期的短周期元素。已知:A、C、F三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物两两之间皆能反应,均能生成盐和水;D元素原子的最外层电子数比次外层电子数少4;E元素原子次外层电子数比最外层多3。
(1)写出下列元素的符号;
A ,C ,E ,F ;
(2)B的单质与F的单质反应所得的物质的电子式 ;
(3)A的最高价氧化物对应水化物与C的最高价氧化物对应水化物反应的离子方程式是 ;
(4)F的氢化物的水溶液与C的最高价氧化物反应的离子方程式是
。
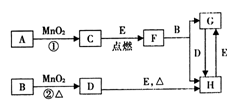 13.(16分)下图所涉及的物质均为中学化学中的常见物质,其中C为O2、D为Cl2、E为Fe单质,其余为化合物。它们存在如下转化关系,反应中生成的水及次要产物均已略去。
13.(16分)下图所涉及的物质均为中学化学中的常见物质,其中C为O2、D为Cl2、E为Fe单质,其余为化合物。它们存在如下转化关系,反应中生成的水及次要产物均已略去。
(1)写出有关物质的化学式
F ,G ,H ,
(2)指出MnO2在相关反应中的作用,反应①中是 剂,反应②中是 剂。
(3)若反应①是在加热条件下进行,则A是 ;若反应①是在常温条件下进行,则A是 。
(4)写出B与MnO2共热获得D的离子方程式 。
(5)写出B与F反应的化学方程式 。
| 得分 | 评卷人 |
三、填空题(共16分)
14、(16分)2004年是俄国化学家马尔柯夫尼柯夫(V.V.Markovnikov,1838—1904)逝世100周年。马尔柯夫尼柯夫因为提出碳碳双键的加成规则而闻名于世,该规则是指不对称的烯烃与HX或HCN加成时,氢总是加到含氢较多的双键碳原子上。
![]()
![]()
|
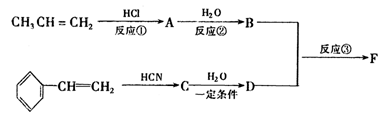
以下是某有机物F的合成路线,请填写下列空白。
(1)写出下列物质的结构简式A ,C 。
(2)反应①的反应类型是 ,反应②的反应类型是 。
(3)写出反应③的化学方程式 。
(4)写出与D互为同分异构体、结构中含有苯环且苯环上含有一个甲基(苯环上的取代基处于
对位)的酯类的结构简式 、 、 。
| 得分 | 评卷人 |
四、实验题(共14分)
15、(14分)下图是铜与稀硝酸反应的两个实验装置图,请回答下列问题:
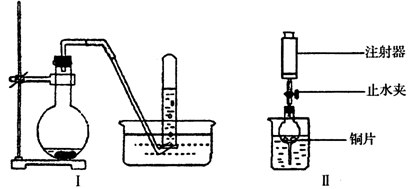
(1)铜与稀硝酸反应的离子方程式 。
(2)I实验装置中能否证明铜与稀硝酸反应生成的是NO气体 (填“能”或“不能”),简述理由
。
(3)若用II实验装置进行实验,以证明铜与稀硝酸反应生成的气体是NO,则:检查气密性的操作是
。在烧杯中加入一定体积的稀硝酸,找开止水夹,用注射器慢慢抽取干燥管内的空气,稀硝酸沿着干燥管慢慢上升,直到充满整个干燥管,停止抽拉注射器,关闭止水夹,观察干燥管内的现象是
。反应停止后,打开止水夹,用注射器抽取干燥管内的气体(事先已将注射器内原有的空气推出),关闭止水后夹后取下注射器,并抽取一定量的空气,观察到的现象是 。反应停止后,打开目水夹,用注射器抽取干燥管内的气体(事先已将注射器内原有的空气推出),关闭止水夹后取下注射器,并抽取一定量的空气,观察到的现象是
。
(4)上述实验完成后,将注射器内的气体通入到NaOH溶液中,其目的是 。
| 得分 | 评卷人 |
五、计算题(共10分)
16、氢氧化钡是一种使用广泛的化学试剂。某课外小组通过下列实验测定某试样中Ba(OH)2•nH2O的含量。
(1)称取7.0g试样溶于蒸馏水配成100mL溶液,从中取出10.0mL溶液于锥形瓶中,加2滴指示剂,用0.100mol•L-1HCl标准溶液滴定至终点,共消耗标准液20.0mL(杂质不与酸反应),则试样中氢氧化钡的物质的量为 。
(2)另取5.25g试样加热至失去全部结晶水(杂质不分解),称得质量为4.17g,则Ba(OH)2•nH2O中的n= 。
(3)试样中的Ba(OH)2•nH2O的质量分数为 。
广元市高2006年级第一高考适应性统考参考答案
化 学
1、C 2、B 3、A 4、D 5、A 6、D 7、B 8、B 9、C 10、A 11、C
12、(10分)(1)Na、Al、P、Cl
(2)![]()
![]() (3)OH-+Al(OH)3===AlO
(3)OH-+Al(OH)3===AlO![]() +2H2O
+2H2O
(4)Al2O3+6H+===2Al3++3H2O
13、(16分)(1)F: Fe3O4,G:FeCl2,H:FeCl3(各2分)
(2)催化剂:氧化剂(各1分)
![]() (3)KClO3;H2O2(各2分)。
(3)KClO3;H2O2(各2分)。
(4)4H++2Cl-+MnO2===Mn2++Cl2↑+2H2O(2分)
(5)Fe3O4+8HCl=FeCl2+2FeCl3+4H2O(2分)
14、(16分,每空2分)
![]()
![]()
![]()
![]()
![]()
![]() (1)CH3CHCH3,
(1)CH3CHCH3,![]() CH CH3 (各2分)
CH CH3 (各2分)
Cl CN
(2)加成反应,水解反应(或取代反应)(各1分)
|
|
|
 | |||||||||
| |||||||||
|
|
|
|
|
|
|
 | |||||||
 | |||||||
| |||||||
(各2分)
15、(14分)(1)3Cu+2NO![]() +8H+=====3Cu2++2NO↑+4H2O(2分)
+8H+=====3Cu2++2NO↑+4H2O(2分)
(2)不能,因为圆底烧瓶中有空气,空气中的氧气会与NO反应生成NO2,出现红棕棕色。(3分)
(3)关闭止水夹,将干燥管放入带有水的烧怀中,若干燥管内的液面比烧杯中的液面低,且过一段时间后干燥管内的液面位置保持不变,则表明该装置的气密性良好。(3分)
铜片溶解,且表面有无色气泡产生,溶液变成蓝色;液面下降。(2分)有红棕色气体产生。(2分)
(4)(2分)防止污染环境。
16.(10分) (1)0.01mol (3分)
(2)n=8 (4分)
(3)45% (3分)