第二章 化学反应与能量
第二讲 化学能与电能
复习重点:初步认识原电池概念、原理、组成及应用。
复习难点:通过对原电池实验的探究,引导学生从电子转移角度理解化学能向电能转化
的本质以及这种转化的综合利用价值。
知识梳理
一、化学能与电能的相互转化
1、原电池:(1)概念:________________。 (2)工作原理:
负极:__电子(化合价___),发生__反应
正极:__电子(化合价__),发生__反应
(3) 原电池的构成条件 :关键是能自发进行的氧化还原反应能形成原电池,a. 有______________作电极; b. 电极均插入____________;c. 两电极______________形成闭合回路。(4)原电池正、负极的判断:负极:_______的电极(较___的金属),金属化合价__;正极:电子__的电极(较___的金属、石墨等):元素化合价__ 。
2、金属活泼性的判断:
(1)金属活动性顺序表;(2)原电池的负极(电子流出的电极,质量减少的电极)的金属更活泼 ; (3)原电池的正极(电子流入的电极,质量不变或增加的电极,冒气泡的电极)为较不活泼金属
3 原电池的电极反应:
(1) 负极反应:X-ne=Xn- (2) 正极反应:溶液中的阳离子得电子的还原反应
二、原电池的设计:
根据电池反应设计原电池:(三部分+导线)
(1)负极为___的金属(即化合价__的物质);
(2)正极为_______的金属或___;
(3) 电解质溶液含有________离子(即化合价____的物质)。
三、金属的电化学腐蚀
(1)不纯的金属(或合金)在电解质溶液中的腐蚀,关键形成了____,加速了金属腐蚀。
(2) 金属腐蚀的防护: ①改变金属内部组成结构,可以增强金属耐腐蚀的能力。如:不锈钢。②在金属表面覆盖一层保护层,以断绝金属与外界物质接触,达到耐腐蚀的效果。(油脂、油漆、搪瓷、塑料、电镀金属、氧化成致密的氧化膜)。③ 电化学保护法:牺牲活泼金属保护法,外加电流保护法。
四、发展中的化学电源
1、干电池(锌锰电池)
负极:________________;
正极(石墨):2NH4+ +2e-====2NH3+H2O
H2+2MnO2====Mn2O3+H2O 4NH3+Zn2+==== [Zn(NH3)4]2+
总反应式:________________;
2. 充电电池
(1)铅蓄电池: 铅蓄电池充电和放电的总化学方程式

放电时电极反应:
负极:Pb + SO42--2e-=PbSO4
正极:___________________________;
(2)氢氧燃料电池:它是一种高效、不污染环境的发电装置。它的电极材料一般为活性电极,具有很强的催化活性,如铂电极,活性炭电极等。
总反应:2H2 + O2=2H2O
电极反应为(电解质溶液为KOH溶液)
负极:________________;
正极:________________;
疑难点拨
一、原电池的正、负极的判断方法:
1、由组成原电池的两极的电极材料判断。一般是活泼的金属是负极,活泼性较弱的金属或能导电的非金属是正极。
注意:如Mg、Al与NaOH溶液形成原电池;Fe、Cu与浓硝酸形成原电池。都是相对不活泼金属作负极。
2、根据电流方向或电子流动方向判断。电流是由正极流向负极,电子流动方向是由负极流向正极。
3、根据原电池里电解质溶液内离子的定向流动方向判断。在原电池的电解质溶液内,阳离子移向的极是正极,阴离子流向的极为负极。
4、根据原电池两极发生的变化来判断。原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
二、原电池电极反应的书写方法
原电池反应所依托的化学反应原理是氧化还原反应,书写电极反应的方法归纳如下:
1、写出总化学反应方程式(即氧化还原反应方程式);
2、根据总反应方程式从电子得失(或元素化合价升降)的角度,将总反应分成氧化反应和还原反应;
3、氧化反应在负极发生,还原反应在正极发生,注意介质可能参与反应;
4、验证;两电极反应式相加所得式子和原化学方程式相同,则书写正确。
典例剖析
【例1】把a、b、c、d四块金属浸入稀硫酸中,用导线两两相连组成原电池,若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时, c极上产生大量气泡;b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序为
A.a>b>c>d B.a>c>d>b C.c>a>b>d D.b>d>c>a
解析:根据原电池原理:作为负极的金属活动性比正极的金属活动性强,电子流动方向是由负极流向正极,电流方向与电子流动方向相反,因此依次作出判断:活泼性a>b;c>d;a>c;d>b。答案为B。
【例2】在用Zn片、Cu片和稀硫酸组成的原电池装置中,经过一段时间工作后,下列说法正确的是
A.锌片是正极,铜片上有气泡产生 B.电流方向是从锌片流向铜片
C.溶液中硫酸的物质的量浓度减小 D.电解质溶液的pH保持不变
解析:活泼金属锌为负极,电流方向由正极到负极,与电子流动方向相反,随着H+消耗,pH逐渐增大。答案为C
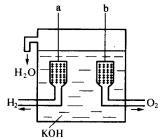
【例3】美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源,其构造如图所示:a、b两个电极均由多孔碳制成,通入的气体由孔隙中逸出,并在电极表面放电。
(1)a是__极,b是__极.电极反应式分别是_____________、______________。
(2)飞船上宇航员的生活用水由燃料电池提供.已知这种电池发1度电能生成350g水,试计算能量的转化率。(已知: 2H2(g)+O2(g)=2H2O(1);![]() =-572kJ/mol)
=-572kJ/mol)
(3)这种电池的输出电压为1.2V,用它使标有“1.2V 1.5W”的小灯泡发光1h,需要消耗标准状态下的 H2多少升?
解析:(1)a中的 H2失去电子被氧化,是负极;b中的 O2得到电子被还原,是正极.两电极的反应分别是:
![]()
(2)由方程式: 2H2(g)+O2(g)=2H2O(1);![]() =-572kJ/mol可知,发生350g液态水放出的热量为:
=-572kJ/mol可知,发生350g液态水放出的热量为:
![]() kJ.
kJ.
这过程中产生的电能是1度,即 ![]() kJ,因此能量转化率为:
kJ,因此能量转化率为: ![]() .
.
(3)1.5W灯泡连续发光1h,消耗的电能: ![]() ,
,
产生这些电能需要消耗化学能: ![]() .
.
这过程中消耗标准状态下的氢气的体积: ![]() L.
L.
【例4】1991年我国首创以铝-空气-海水电池作为能源的新型海水标志灯,以海水为电解质,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水中数分钟,就会发出耀眼的白光,其总反应方程式为:4Al + 3O2 + 6H2O = 4Al(OH)3,则该电源的负极材料为 ,正极材料为 ,负极反应
正极反应 。
解析:Al 、O2(空气)之间的氧化还原反应为:4Al + 3O2 = Al2O3.将该反应与原电池原理、铝的导电性等知识进行综合分析可知,铝既是负极产物,又是反应材料,O2是正极反应物,正极材料应该选择还原性比铝弱的导电性强的材料,如石墨等
铝、O2的氧化反应、还原反应分别为:Al – 3e- = Al3+,O2 + 2H2O + 4e- = 4OH-
答案:铝 石墨 负极反应:Al – 3e- = Al3+,O2 + 2H2O + 4e- = 4OH-
【例5】(2005年江苏高考化学题)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2
+ 2Fe(OH)3
+ 4KOH,下列叙述不正确的是
3Zn(OH)2
+ 2Fe(OH)3
+ 4KOH,下列叙述不正确的是
A.放电时负极反应为:Zn-2e—+2OH—=Zn(OH)2
B.充电时阳极反应为:Fe(OH)3 -3e—+ 5OH—=FeO42-+ 4H2O
C.放电时每转移3mol电子,正极有1molK2FeO4被氧化
D.放电时正极附近溶液的碱性增强
解析:高铁电池放电(原电池)时的负极反应为3Zn+6OH—-6e—=3Zn(OH)2,正极反应为2FeO42-+8H2O+6e-==2Fe(OH)3+10OH—;充电(电解池)时的阴极反应为3Zn(OH)2+6e-==3Zn+6OH—,阳极反应为2Fe(OH)3+10OH—-6e-==2FeO42-+8H2O。从而不难分析出答案为C。
知能训练
一、选择题
1.随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因是
A.利用电池外壳的金属材料
B.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
C.不使电池中渗泄的电解液腐蚀其他物品 D.回收其中石墨电极
2.废电池处理不当不仅造成浪费,还会对环境造成严重污染,对人体健康也存在极大的危害。有同学想变废为宝,他的以下想法你认为不正确的是
A.把锌皮取下洗净用于实验室制取氢气 B.碳棒取下洗净用作电极
C.把铜帽取下洗净回收利用
D.电池内部填有氯化铵等化学物质,将废电池中的黑色糊状物作化肥用
3、下列变化中属于原电池的是
A.在空气中金属铝表面迅速氧化形成保护层
B.白铁(镀锌)表面有划损时,也能阻止铁被氧化
C.红热的铁丝与水接触表面形成蓝黑色保护层
D.铁与稀硫酸反应时,加入少量硫酸铜溶液时,可使反应加速
4、实验室中欲制氢气,最好的方法是
A.纯锌与稀硫酸反应 B.纯锌与浓硫酸反应
C.纯锌与稀盐酸反应 D.粗锌(含铅、铜杂质)与稀硫酸反应
5、铁制品上的铆钉应该选用下列哪些材料制成
A.铝铆钉 B.铜铆钉 C.锌铆钉 D.锡铆钉
6、由铜、锌和稀硫酸组成的原电池工作时,电解质溶液的pH怎样变化
A.不变 B.先变小后变大 C.逐渐变大 D.逐渐变小
7、对铜-锌-稀硫酸构成的原电池中,当导线中有1mol电子通过时,理论上的两极变化是
①锌片溶解了32.5g②锌片增重了32.5g③铜片上析出1g H2④铜片上析出1molH2
A. ①③ B. ①④ C. ②③ D. ②④
8、 X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成的原电池时,Y为电池的负极,则X、Y、Z三种金属的活动顺序为
A.X > Y > Z B. X > Z > Y C. Y > X > Z D. Y > Z > X
9、将铜棒和铝棒用导线连接后插入浓硝酸溶液中,下列叙述正确的是
A.该装置能形成原电池,其中铝是负极 B.该装置能形成原电池,其中铜是负极
C.该装置不能形成原电池 D.以上说法均不正确
10、碱性电池具有容量大、放电电流大的特点,因而得到广泛使用,锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应为:Zn(s)+2MnO2(s)+H2O(l)﹦Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-﹦Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
11、微型锂电池可作植入某些心脏病人体内的心脏起博器所用的电源,这种电池中的电解质是固体电解质LiI,其中的导电离子是I-.下列有关说法正确的是
A.正极反应:2Li - 2e- = 2Li+ B.负极反应:I2 + 2e- = 2I-
C.总反应是:2Li + I2 = 2LiI D.金属锂作正极
12、某原电池总反应离子方程式为2Fe3+ + Fe = 3Fe2+能实现该反应的原电池是
A.正极为铜,负极为铁,电解质溶液为FeCl3溶液
B.正极为铜,负极为铁,电解质溶液为Fe(NO3)2溶液
C.正极为铁,负极为锌,电解质溶液为Fe2(SO4)3
D.正极为银,负极为铁,电解质溶液为CuSO4
13、锌锰干电池在放电时,电池总反应方程式可以表示为:
Zn + 2MnO2 + 2NH4+ = Zn2+ + Mn2O3 + 2NH3 + H2O
在此电池放电时,正极(碳棒)上发生反应的物质是
A. Zn B. 碳棒 C. MnO2 和NH4+ D. Zn2+ 和NH4+
14、氢氧燃料电池用于航天飞船,电极反应产生的水,经过冷凝后可用作航天员的饮用水,其电极反应如下:负极:2H2 + 4OH- - 4e- = 4H2O 正极:O2 + 2H2O + 4e- = 4OH—,当得到1.8L饮用水时,电池内转移的电子数约为
A.1.8mol B.3.6mol C.100mol D.200mol
二、填空题
15、将锌片和铜片插入某种电解质溶液,锌片和铜片用导线相连,形成原电池装置。
(1)若电解质溶液是稀硫酸,则发生氧化反应的是 极(“锌”、“铜”),铜极发生的反应是 ,该电池的总反应方程式是 。(2)若电解质溶液是硫酸铜溶液,在导线中电子是由 极流向 极,铜极上反应的电极反应方程式是 ,该电池总反应方程式是 。
16、某同学想测定A、B、C三种金属活动顺序,他把这三种金属放到相同物质的量浓度的盐酸中,反应速率都较慢,不易分辨出三者差异,现只有盐酸一种化学试剂,应该用什么方法迅速测出三种金属的活动性顺序?
17、市场上出售的“热敷袋”其中主要成分是铁屑、碳粉和少量的NaCl、水等.热敷袋在启用前用塑料袋使之与空气隔绝,启用时,打开塑料袋轻轻揉搓,就会放出热量,使用完后,会发现袋内有许多铁锈生成,回答:
(1)热敷袋放出的热量来源于 放出的热量.
(1)碳粉的作用是 .
(3)加入NaCl的作用是 .
(4)写出有关的电极反应式和化学方程式 .
18、请设计一个原电池,其总反应为:Zn + 2FeCl3 = ZnCl2 + 2FeCl2。
19.有A、B两种金属分别与盐酸反应,产生氢气的速率相近。怎样设计一个实验证明A、B两种金属的活动性?(画出实验装置图)
三、计算题
20.在由铜片、锌片和200 mL稀硫酸组成的原电池中,若锌片只发生电化学腐蚀,当在铜片上放出3.36 L(标准状况)的H2时,硫酸恰好用完,则:
(1)产生这些气体消耗的锌的质量是多少?
(2) 通过导线的电子的物质的量是多少?
(3)原稀硫酸的物质的量浓度是多少?
参考答案:
1.B 2.D 3.BD 4.D 5.AC 6.C 7.A 8.C 9.B 10.C 11.C 12.A 13.C 14.D
15.(1) 锌 2H+ + 2e- = H2↑ Zn + 2H+ = Zn2+ + H2 ↑
(2)锌 铜 Cu2+ + 2e- = Cu Zn + Cu2+ = Zn2+ + Cu
16.将A、B、C三种金属两两连接起来,放入盐酸溶液中,观察哪种金属上产生气泡,则其活动性较差。
17.(1)铁屑被氧化 (2)碳粉与铁及NaCl溶液组成原电池,作为原电池的正极。
(3)NaCl与水作用形成电解质溶液。(4)负极Fe - 2e- = Fe2+
正极 2H2O + O2 +4e- = 4OH-
18.该总反应中,Zn为还原剂,Zn可直接作负极材料,FeCl3是氧化剂易溶于水可作电解质溶液,用不活泼的金属或能导电的非金属(如石墨等)作正极,用导线连接正、负极即可。
19.将A、B金属用导线连接插入盐酸中组成原电池,有气泡冒出的是较不活泼金属,另一极为活泼金属。(图略)
20、(1) 9.75 g;(2) 0.3 mol;(3) 0.75 mol/L
