高考化学二调模拟考试(三)
化 学 试 题
本试卷分试题卷和答题卡两部分。共150分。考试时间120分钟。
第Ⅰ卷(选择题 共64 分)
注意事项:
1.答卷前,考生务必将本人的学校、班级、姓名、学号、考试号填在答题卡的密封线内。
2.将答案填在答题卡相应的位置上。在试卷上答题无效。
3.考试结束,请将答题卡交给监考人员。
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1.信息、材料、能源被称为新科技革命的“三大支柱”。下列有关资讯错误的是
A.在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源
B.目前,中、美、日等国掌握的陶瓷发动机技术,能较大程度地降低能耗,节约能源
C.光缆在信息产业中有广泛应用,制造光缆的主要材料是单质硅
D.结构陶瓷碳化硼(B4C3)常用于制造切削工具,它是一种新型无机非金属材料,属于原子晶体
2.美国科学家用有机分子和球形笼状分子C60,首次制成了“纳米车”(如图),每辆“纳米车”是用一个有机分子和4个球形笼状分子“组装”而成。 “纳米车”可以用来运输单个的有机分子,生产复杂的材料和药物,成为“纳米生产”中的有用工具。下列说法正确的是
“纳米车”可以用来运输单个的有机分子,生产复杂的材料和药物,成为“纳米生产”中的有用工具。下列说法正确的是
A.我们可以直接用肉眼清晰地看到这种“纳米车”的运动
B.“纳米车”的诞生,说明人类操纵分子的技术进入一个新阶段
C.C60是一种新型化合物
D.C60熔点比金刚石熔点高
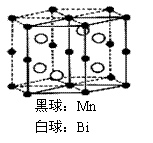 3.磁光盘机(Magnetic
Optical Disk Drive,MO)是一种可重写的光盘驱动器,它使用磁光盘片作存储媒体。磁光存储的研究是Williams等在1957年使Mn和Bi形成的晶体薄膜磁化并用光读取之后开始的。下图是该物质的晶体结构,其化学式可表示为
3.磁光盘机(Magnetic
Optical Disk Drive,MO)是一种可重写的光盘驱动器,它使用磁光盘片作存储媒体。磁光存储的研究是Williams等在1957年使Mn和Bi形成的晶体薄膜磁化并用光读取之后开始的。下图是该物质的晶体结构,其化学式可表示为
A.Mn2Bi B.MnBi C.MnBi3 D.Mn4Bi3
4.某溶液中大量存在五种离子:NO3- 、SO42-、Fe3+ 、H+ 、X ,其物质的量之比为:
n(NO3-) :n(SO42-) :n(Fe3+) :n(H+) :n (X) = 2 :3 :1 :3 :1,则X 可能为
A.Fe2+ B. Mg2+ C.Cl- D.Ba2+
5.氮化碳晶体的硬度超过金刚石,是首屈一指的超硬新材料。氮化碳晶体结构示意图如下,
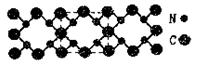 下列有关氮化碳的说法中,不正确的是
下列有关氮化碳的说法中,不正确的是
A.氮化碳晶体属于原子晶体
B.氮化碳中碳显—4价,氮显+3价
C.氮化碳的化学式为C3N4
D.每个碳原子与四个氮原子相连,每个氮原子与三个碳原子相连
6.下列实验基本操作中正确的是
A.过滤时,玻璃棒靠在三层滤纸边沿稍下方
B.配制一定物质的量浓度的溶液,在移液时玻璃棒轻靠在容量瓶瓶口
C.测定烧杯中溶液的pH时,用pH试纸直接在烧杯中蘸取溶液
D.做Fe与H2O反应的实验时,应用酒精灯外焰对装有铁粉的直通管加热
7.下列各项操作中,不发生“先产生沉淀后沉淀又溶解”现象的是
①向饱和碳酸钠溶液中通入过量的CO2
②向Fe(OH)3胶体中逐滴滴加入过量的稀硫酸
③向氨水中逐滴加入AgNO3溶液至过量 ④向石灰水中通入过量的CO2
⑤向硅酸钠溶液中逐滴加入过量的盐酸
A.①②③⑤ B.①③⑤ C.①⑤ D.②③⑤
 8.右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部
8.右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部
分内容。据此下列说法正确的是
A.该试剂的物质的量浓度为9.2 mol·L—1
B.该硫酸50 mL与足量的铜反应可得到标准状况下SO2 10.3 L
C.配制200 mL 4.6 mol·L—1的稀硫酸需该硫酸50 mL
D.该硫酸与等体积的水混合所得溶液的质量分数小于49%
二、选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。
9.阿伏加德罗常数约为6.02×1023mol-1,下列说法中错误的是
A.标准状况下,3.01×1023个CCl4所占的体积约为11.2 L
B.80 g NH4NO3晶体中约含有NH4+ 6.02×1023个
C.3.9 gNa2O2吸收足量的CO2时转移的电子数约是3.01×1022
D.46 g NO2和N2O4混合气体中含有原子数约为1.806×1024
10.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水的离子反应是:
4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-
工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入一定量的KOH就可制得高铁酸钾。制备高铁酸钠的两种方法的主要反应原理如下:
湿法制备——2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
干法制备——2FeSO4 +6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑。
下列有关说法中错误的是
A.高铁酸钾与水反应时,水发生还原反应
B.湿法中每生成1mol Na2FeO4共转移3mol电子
C.干法中每生成1mol Na2FeO4共转移4mol电子
D.K2FeO4处理水时,不仅能杀菌,还能除去H2S、NH3等,并使悬浮杂质沉降
11.镍氢电池是近年开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。镍氢电
池的总反应式是:H2+2NiO(OH) 2Ni(OH)2,据此反应判断,下列叙述中正确的是
A.电池放电时,电池负极周围溶液的pH 不断增大
B.电池充电时,阳极反应为:Ni(OH)2 + OH- - e-= NiO(OH) +H2O
C.电池充电时,氢元素被还原
D.电池放电时,负极反应为:H2-2e-=2H+
12.下列离子方程式书写正确的是
A.向CaCl2溶液中通入少量CO2气体: Ca2++CO2+H2O===CaCO3↓+2H+
B.碳酸氢钠溶液与硫酸氢钠溶液反应: HCO3-+H+=CO2↑+H2O
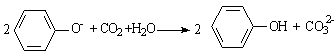
C.向苯酚钠溶液中通入少量CO2:
D.含有FeBr2溶液中通入足量的Cl2: 2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
13.已知甲为恒温恒压容器,乙为恒温恒容容器。初始时,两容器的温度、体积相同,两容器中均充入2molSO2和lmolO2,且发生反应为2SO2(g)+O2(g)![]() 2SO3(g);△H<0;当两容器都达到平衡后,为使两者中的SO2在平衡混合物中的物质的量分数相同,下列措施中可行的是
2SO3(g);△H<0;当两容器都达到平衡后,为使两者中的SO2在平衡混合物中的物质的量分数相同,下列措施中可行的是
A.向甲容器中再充人一定量的氦气 B.向乙容器中再充人2mol的SO3气体
C.适当降低乙容器的温度 D.缩小甲容器的体积
14. 时钟反应或振荡反应提供了迷人课堂演示实验,也是一个活跃的研究领域。测定含I-浓度很小的碘化物溶液时,利用振荡反应进行化学放大,以求出原溶液中碘离子的浓度。主要步骤如下:
①在中性溶液中,用溴将试样中I-氧化成IO3-,将过量的溴除去。
②再加入过量的KI,在酸性条件下,使IO3-完全转化成I2。
③将②中生成的碘完全萃取后,用肼将其还原成I-,方程式为:N2H4+2I2==4I-+N2+4H+
④将生成的I-萃取到水层后用①法处理。
⑤将④得到的溶液加入适量的KI溶液,并用硫酸酸化。
⑥ 将⑤反应后的溶液以淀粉作指示剂,用Na2S2O3标准液滴定,方程式为:2Na2S2O3+I2==Na2S4O6+2NaI
经过上述放大后,溶液中I-浓度放大为原溶液中I-浓度的(设放大前后溶液体积相等):
A.2倍 B.4倍 C.6倍 D.36倍
15. 某结晶水合物的化学式为A·H2O,其相对分子质量为B,在60℃时m g 该晶体溶于ng
水中,得到v mL 密度为d g· mL-1 的饱和溶液,下述表达式或判断正确的是
A.该溶液物质的量浓度为(1000m/BV)mol·L-1
B.60℃时A 的溶解度为(100m(B-18)/nB)g
C. 该溶液溶质的质量分数为(m/(m+n))×100%
D.60℃时,将10g A 投入到该饱和溶液中,析出晶体大于l0g
16.左多巴是一种著名的药物,2000年Nobel医学奖和2001年Nobel化学奖都跟它有关。
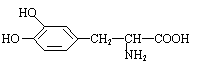 |
它的结构简式和学名为:
3—(3,4—二羟基苯基)—2—氨基丙酸 。 该名称中,“复杂基团”作为一个整体,用一个括号括起。括号内的3,4表示羟基在苯环的位置,括号前和氨基前的3,2分别表示这两个基团在丙酸分子中碳链的位置。如果保持名称中的括号、汉字不变,仅仅改变表示位置的4个阿拉伯数字,可以写出多少种同分异构体
A、20种 B、23种 C、24种 D、11种
第Ⅱ卷(非选择题,共86分)
三、(本题包括2小题,共16分)
17. (6分)下列有关实验的叙述,正确的是 (选填字母序号)。
A.制备乙酸乙酯时,将乙醇和乙酸依次倒入到浓硫酸中
B.用干燥且洁净的玻璃棒蘸取待测液滴到放在表面皿上的pH试纸上
C.滴定管洗净后,经蒸馏水润洗即可注入标准液进行滴定
D.铜片跟稀硝酸反应产生的气体可用排水法收集
E.用浓氨水洗涤做过银镜反应的试管
F.在溴水中滴入少量苯酚溶液有白色沉淀生成
18. (10分)某实验小组欲比较CuO和MnO2对KClO3分解速率的影响,进行了如下实验:
(一)制取CuO
实验步骤:①称取5 g CuSO4·5H2O,研细后倒入烧杯中,加30 mL蒸馏水溶解;
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀为止,然后将所得混合物转移到蒸发皿中,加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤,晾干后研细备用。
回答下列问题: (1)上述实验步骤中需要使用玻璃棒的是 (填实验步骤序号),
(2)步骤③中洗涤沉淀的操作方法是
(二)催化效果比较
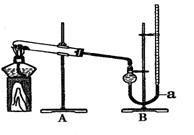 用右图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表:
用右图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表:
| 实验 | KClO3质量 | 其它物质的量 | 待测数据 |
| 实验Ⅰ | 1.2g | 无其他物质 | |
| 实验Ⅱ | 1.2g | CuO 0.5g | |
| 实验Ⅲ | 1.2g | MnO2 0.5g |
回答下列问题:
(3)上表所列实验中的“待测数据”指
(4)若要证明实验Ⅱ中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住装置B中的乳胶管a,拔去干燥管上单孔橡皮塞,
(5)为探究CuO在实验Ⅱ中是否为催化剂,需补做如下实验(无需写出具体操作):
a. ,b.检验CuO的化学性质有没有改变。
四、(本题包括2小题,共16分)
19.(6分)化学键的键能是原子间形成1mol化学键(或其逆过程)时释放(或吸收)
的能量。以下是部分共价键键能数据:H-S 364kJ·mol-1,S-S 266kJ·mol-1,
O=O ,496kJ·mol-1, H-O 464kJ·mol-1。
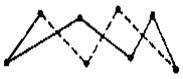 已知:
已知:
2H2S(g)+O2(g)=2S(g)+2H2O(g);△H1
2H2S(g)+3O2(g)=2SO2+2H2O(g); △H2=-1000kJ·mol-1
反应产物中的S实为S8分子,是一个八元环状分子(如图)
(1)试根据上述数据计算可得△H1= kJ·mol-1
(2)将a mol H2S与b mol O2混合进行上述反应,当a>2b时,反应放热 kJ,
将a mol H2S与b mol O2混合进行反应,当3a<2b时,反应放热 kJ。
20.(10分)2004年美国火星探测车在火星大气层中检测到了A气体。资料显示,A气体分子是一种三原子分子,其相对分子质量为60.0,在地球环境下A不太稳定,易分解得到一种单质和一种化合物。粉末状的KSCN与浓硫酸在一定条件下可得到气体A和两种硫酸氢盐,生成物的物质的量之比为1∶1∶1
(1)试推测火星大气层的温度比地球环境高还是低,简述你的理由。
(2)试确定A的化学式 。
(3)写出KSCN与浓硫酸反应的化学反应方程式 。
(4)A分解得到一种单质和一种氧化物,写出A分解的化学反应方程式 。
(5)B与SO3反应得到A与一种淡黄色的固体单质。已知B由两种元素组成,A和B分子中原子的最外层电子总数相等,B中两元素的质量比为3∶16。试写出B与SO3反应制备A的化学反应方程式: 。
五、(本题包括1小题,14分)
21.(14分)化学科研小组的同学在精确测试Na2SO3溶液的pH时,遇到了困惑。为此,他们进行了冷静的思考和准备,决心重新实验,揭开奥秘。请你了解情况,参与交流讨论。
[查阅资料]①常温下0.1mol·L-1的H2SO3溶液的pH约为2.1。
②通常情况下,H2S为无色,有腐蛋臭味的气体,其水溶液称为氢硫酸。常温下0.1mol·L-1的H2S溶液的pH约为4.5。
[实验操作]①准确称取纯净的Na2SO3·7H2O晶体25.20g,配成1L水溶液,测得其pH=7.8。
②以坩埚再次准确称取25.20g上述晶体,继而隔绝空气在600℃以上高温下强热至恒重,质量为12.60g。
③将②所得之12.60g固体进行元素定性定量分析,组成与Na2SO3无异。将其溶于水得250mL溶液,测得pH=10.3。
[分析猜想] Na2SO3·7H2O在强热下,失去结晶水,进而发生了分解反应(自身氧化还原反应)
[交流讨论]
(1)实验操作②中称量操作至少进行 次。
(2)给Na2SO3·7H2O加热时要隔绝空气,请以简要的文字和化学方程式给以说明。
。
(3)猜想Na2SO3在高温强热下发生分解反应的化学方程式是 。
(4)实验①和③中,两次测得的溶液pH相差明显,其合理的解释是
。实验③中溶液的pH=10.3的原理是(以相关的离子方程式表示) 。
(5)请你设计简单的实验方案,给上述分析、猜想及解释以佐证。请简单叙述实验步骤、现象和结论。
六、(本题包括2小题,共22分)
22、 (8分) 据某国时尚杂志报道,一种名为苹果醋(ACV)的浓缩饮料多年来风靡当地。,苹果酸是这种饮料的主要酸性物质,对此酸的化学分析如下:
a.燃烧的产物是CO2和H2O,碳、氢质量分数分别为:C:35.82%,H:4.48%;
b.0.001mol该酸与足量的NaHCO3反应,放出44.8mLCO2;或与足量的Na反应放出33.6mLH2(气体体积均已折算为标准状况);
c.结构分析表明,该分子中存在四种化学环境不同的碳原子
试回答下列问题:
(1)苹果酸的化学式为 ,结构简式为
(2)写出该酸在一定条件下分子内脱去一分子水的产物的可能结构简式
、 (写出两种即可)
23.(14分)已知:
|
|
![]()
![]()
![]()
![]()
![]() R—CH2—C—CH2—R’
R—CH2—C—CH2—R’
|
|
|
|
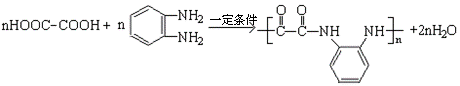
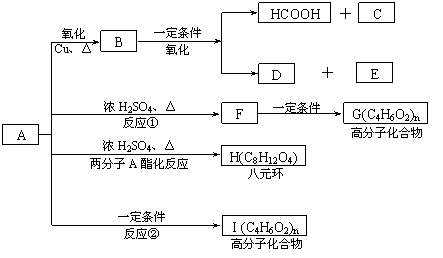 现将A进行如下图所示反应,已知:D的相对分子质量比E小,B不能发生银镜反应,F可使溴水褪色,且其中含甲基。
现将A进行如下图所示反应,已知:D的相对分子质量比E小,B不能发生银镜反应,F可使溴水褪色,且其中含甲基。
试回答下列问题:
(1)写出下列物质的结构简式:A____________C____________D____________。
(2)反应①和②的反应类型:反应①____________ 反应②____________
(3)写出下列变化的化学方程式:
![]() ①E与邻苯二胺(
)缩聚生成一种合成纤维:
①E与邻苯二胺(
)缩聚生成一种合成纤维:
②F→G_________________________________________________
③A→H_________________________________________________
七、(本题包括2小题,共18分)
24、(8分)2006年是中国环保事业取得长足进步的一年。江南某厂平均每天产生约600 m3含氨废水(NH3 的浓度为153 mg·L-1,密度为1 g·cm—3)。该厂采用下列方法对废水进行联合处理和利用。
方法1:对废水进行加热蒸发得到NH3,使废水中的NH3 的浓度降为17
mg·L-1。对加热蒸发得到的NH3进行合理利用:用一定量空气氧化(设空气中氧气的体积分数为20%),发生的主要反应有: 4NH3 + 5O2 ![]() 4NO + 6H2O,
4NO + 6H2O,
4NO + 3O2 + 2H2O === 4HNO3, 副反应有:4NH3 + 3O2 === 2N2 + 6H2O
方法2:向方法1处理过的废水中,加入甲醇,在微生物作用下发生如下反应:
2O2 + NH3 = == NO3- + H+ + H2O
6NO3— + 6H+ + 5CH3OH→ 3N2↑ + 5CO2↑ + 13H2O
若废水加热前后的体积和密度近似认为不变,试进行下列计算:
(1)方法1中,若90% NH3转化为硝酸,10% NH3发生了副反应,则消耗标准状况下的空气多少立方米?
(2)方法2中,若NH3 的 转化率为95%,则消耗甲醇多少千克?
25、(10分)甲、乙两个研究小组,用以下两种方法由Cu粉制Cu(NO3)2溶液。
(1)甲组用a g Cu粉,在加热条件下,与空气充分反应,然后将生成的CuO全部溶于适量的稀HNO3溶液中,制得Cu(NO3)2溶液。则消耗的O2的物质的量是 ,
消耗的HNO3的物质的量是
(2)乙组用a g Cu粉全部溶于一定量的浓HNO3中,测得生成的气体在标准状况下体积为b L (不考虑NO2转化成N2O4)。则消耗的HNO3的物质的量是 mol。为消除污染,将生成的气体通入水中并同时通入O2,使生成的气体完全溶于水,则消耗O2的物质的量是 mol;若将生成的气体通入NaOH溶液中,气体被完全吸收,产
物只有NaNO3、NaNO2和H2O,则生成NaNO2的物质的量是 mol。
 | |||
| |||
化学试题参考答案
一、选择题:
1、C 2、B 3、B 4、B 5、B 6、A 7、C 8、C
二、选择题:
9、A 10、AC 11、BC 12、B 13、AC 14、D 15、AD 16、C
三、17、(6分) BDF
18、(10分)
(1) ①②③
(2)向漏斗中的沉淀上加蒸馏水至浸没沉淀,静置使水全部滤出,重复2~3次
(3)产生25mL气体所需的时间
(4)取一根带火星的木条,伸入干燥管内,看木条是否复燃
(5)测CuO的质量没有改变
四、19、(6分) (1) -436kJ/mol (2) 436b 500a
20、(10分)
(1) 低 因为如果温度高,则易分解
(2) SOC (不考虑书写顺序)
(3) KSCN+2H2SO4(浓)+H2O=KHSO4+NH4HSO4+SOC
(4) SOC=S+CO
(5) 3CS2+SO3=3COS+4S
五、21、(14分)
(1) 4
(2) 避免Na2SO3被氧化 2Na2SO3+O2=2Na2SO4
(3) 4Na2SO3 Na2S+3Na2SO4
(4) 实验③的溶液中可能有Na2S,相同条件下,S2-水解程度大于SO![]() ,溶液的碱性强
,溶液的碱性强
![]() S2- +
H2O
HS-+OH-
S2- +
H2O
HS-+OH-
(5) 取③溶液适量于试管中,向其中加稀H2SO4,如有腐蛋气味气体生成,则证明有S2-
另取③中溶液适量于试管中,加入HCl酸化的BaCl2,如有白色沉淀生成,证明有SO![]()
![]() 六、22、(8分)
六、22、(8分)
(1) C4H6O5
![]()
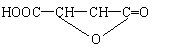 (2) HOOC—CH=CH—COOH
(2) HOOC—CH=CH—COOH
23.(14分,方程式每个2分)
(1)A:CH3—CH(OH)—CH2—COOH C:HOOC—CH2—COOH D:CH3COOH
(2)消去,缩聚(各1分,共2分,答聚合也给分)
 |
(3)①
 |
②
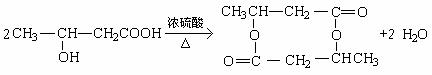 |
③
七、24、(8分)解(1) 在方法1中:
所得氨气的物质的量为![]() ×10-3g/mg×600m3×103L/m3=4800
mol
×10-3g/mg×600m3×103L/m3=4800
mol
由已知条件,发生的主要反应有:
4NH3 + 5O2 ![]() 4NO + 6H2O 4NO + 3O2 + 2H2O
=== 4HNO3
4NO + 6H2O 4NO + 3O2 + 2H2O
=== 4HNO3
得关系式: NH3——2O2
消耗O2的物质的量=4800 mol×90%×2=8640 mol
在副反应:4NH3 + 3O2 === 2N2 + 6H2O中
消耗O2的物质的量=4800 mol×10%×3/4=360 mol
所以共消耗空气的体积=(8640+360)mol×22.4L/mol×10-3m3/L/20%=1 008 m3(4分)
(2)在方法2中:
废水中所得氨气的物质的量=![]() =600 mol
=600 mol
由已知条件:2O2 + NH3 === NO3- + H+ + H2O,
6NO3- + 6H+ + 5CH3OH → 3N2↑ + 5CO2↑ +13H2O
得关系式:6NH3——5CH3OH
所以每天处理废水需甲醇的质量为:
600 mol×95%×5/6×32g/mol×10-3Kg/g=15.20 kg (4分)
25、(10分)(1) ![]() (2)
(2) ![]()
![]()