![]()
|
| 学科:化学 |
| 教学内容:物质结构 元素周期律单元达纲检测(AA级) |
【单元达纲检测】
一、选择题(2分×25=50分)
1.某元素含有二种质量数不同的原子,这两种原子可以组成三种相对分子质量分别为:2n-2、2n和2n+2的双原子分子,若n为整数,这两种原子的质量数肯定不是( )
A.n+2 B.n+1 C.n-2 D.n-1
2.x原子获得3个电子或Y原子失去2个电子后形成的离子都与OH-具有相同的电子数,X与Y两单质反应得到的化合物化学式为( )
A.Y3X2 B.X3Y2 C.X2Y3 D.Y2X3
3.两种微粒含有相同的质子数和电子数,这两种微粒的关系可能是:(1)同一元素的不同原子,(2)不同元素的原子,(3)两种不同的分子,(4)一种原子和一种分子,(5)一种原子和一种离子,(6)一种分子和一种离子,(7)两种不同的阳离子,(8)两种不同的阴离子,(9)一种阴离子和一种阳离子,其中正确的是( )
A.(1)(3)(4)(7)(8) B.(1)(2)(5)(7)(9)
C.(1)(2)(5)(7)(9) D.(1)(2)(3)(4)(5)
4.下列递变情况不正确的是( )
A.Na+、Mg2+、Al3+的氧化性依次增强
B.N、O、F的最高正价依次升高
C.O、S、P的原子半径依次增大
D.P3-、S2-、Cl-的还原性依次减弱
5.已知A、B两元素的原子序数在3~20之间,它们可形成离子化合物AmBn,若A的原子序数为A,则B的原子序数不可能为( )
A.a+8-m-n B.a+16-m-n
C.a-16-m-n D.a-m-n
6.元素X的最高正价和最低负价的绝对值之差为6,Y元素的离子与X元素的离子具有相同的电子层结构,则X、Y形成的化合物可能是( )
A.MgF2 B.K2S C.NaCl D.KCl
7.X元素原子L层比Y元素原子L层少3个电子,Y元素原子核外电子总数比X元素原子核外电子总数多5个,则X、Y两元素的原子序数分别为( )
A.6、11 B.11、6 C.7、12 D.12、7
8.某元素的一种核素,核内质子数为m,中子数为n,关于该元素的下列说法正确的是( )
A.该元素的相对原子质量为m+n
B.该核素的质量为12C的(m+n)倍
C.该核素的同位素核内质子数一定为m
D.核内中子数为n的原子一定是该核素的同位素
9.下列说法不正确的是( )
A.同周期元素,原子核外电子层数一定相同
B.同主族元素,原子最外电子层上的电子数一定相等
C.同周期元素,随原子序数的递增,金属性逐渐减弱,非金属性逐渐增强
D.同主族元素,随原子核外电子层数的增多,得电子能力增强,失电子能力减弱
10.原子序数均不大于20的3种元素X、Y、Z,它们的原子序数之和为42,又知X与Y同周期,Y与Z同主族,下列判断不正确的是( )
A.X和Y不可能在第2周期
B.X和Y若在第4周期,则Z一定在第2周期
C.X和Y若在第3周期,则Z不可能在第4周期
D.X和Y若在第3周期,则Z可能在第2周期
11.A、B两元素形成离子化合物时,一个A原子要失去1个电子转移给B原子,而一个B原子要得到2个A原子的电子。下列有关说法正确的是( )
A.它们形成的离子化合物化学式为A2B
B.原子序数:A一定大于B
C.A和B形成的离子电子层结构一定相同
D.A一定是金属,B一定是非金属
12.下列说法不正确的是( )
A.共价化合物和离子化合物中,一定都含有非金属元素
B.离子化合物中,一定既含有金属元素又含有非金属元素
C.化学变化过程,一定会破坏旧的化学键,同时形成新的化学键
D.共价化合物都是由分子构成的,而离子化合物中一般不存在单个分子
13.对于第n电子层,若它作为原子最外层则最多容纳的电子数与n-1层的相同,当它作为次外层,则其容纳的电子数比n+1层上电子最多能多10个电子,则第n层为( )
A.L层 B.M层 C.N层 D.任意
14.已知钡的金属活动性介于钾和钠之间,则下述说法中可能实现的是( )
A.钡可从冷水中置换出氢
B.钡可从氯化钠溶液中置换钠
C.溶液中钡离子可氧化金属锌,使成为锌离子
D.钡可从氯化钾溶液中置换钾
15.aX和bY分别是元素X和元素Y的一种同位素,已知a>b,元素X和元素Y的相对原子质量的关系是( )
A.大于 B.等于 C.小于 D.不能确定
16.氯只有35Cl和37Cl两种稳定的同位素,在氯气中35Cl和37Cl的原子数之比为3∶1。则相对分子质量为70、72、74的氯气分子数之比可能是( )
A.5∶2∶1 B.5∶2∶2 C.9∶3∶1 D.9∶3∶2
17.设某元素原子核内的质子数为m,中子数为n,则下述论断正确的是( )
A.不能由此确定该元素的相对原子质量
B.这种元素的相对原子质量为m+n
C.若碳原子质量为wg,此原子的质量为(m+n)wg
D.核内中子的总质量小于质子的总质量
18.某元素(X)构成的双原子单质分子有三种,其相对分子质量分别为158、160、162。在天然单质中,此三种单质的物质的量之比为1∶1∶1,由此推断以下结论中,正确的是( )
A.此元素有3种不同的同位素 B.其中一种同位素质量数为80
C.同位素79X占原子总数的1/2 D.X2的平均相对分子质量为160
19.元素的化学性质主要决定于( )
A.原子的半径 B.原子的外层电子结构
C.元素化合价 D.元素的相对原子质量
20.主族元素X、Y、Z的离子的电子层结构相同,原子半径X>Z,离子半径Y>Z。Y和Z能形成离子化合物,由此可判断三种元素的原子序数是( )
A.X>Y>Z B.Z>X>Y C.Y>X>Z D.X>Z>Y
21.已知元素周期表中的各周期可排列元素数目如下:
周期 1 2 3 4 5 6 7
元素数目 2 8 8 18 18 32 32
人们预测元素周期表第8周期将来也会排满,那么该周期排满时会排( )种元素。
A.18 B.32 C.50 D.无法知道
22.下列说法正确的是( )
A.所有核素的原子核都是由质子和中子构成的
B.石墨和金刚石是由碳元素组成的同位素
C.质量数相同的核素不能称为同位素
D.质子数相同的核素一定是同位素
23.以下对元素的叙述,可以肯定是主族元素的是( )
A.最高价氧化物对应的水化物是酸的元素
B.原子电子层结构中次外层为8个电子的元素
C.元素的最高正化合价为+7价的元素
D.原子电子层结构中最外层为5个电子的元素
24.1934年,约里奥·居里夫妇发现铝(1327Al)受α粒子轰击引起核反应生成中子后,还发射出正电子,核反应先后得到两种新元素的同位素,这两种同位素在元素周期表中的位置是( )
A.第3周期ⅣA族 B.第3周期ⅣA族
C.第3周期ⅤA族 D.第3周期ⅦA族
25.用萃取法从碘水中分离碘,所用萃取剂应具有性质是( )
①不和碘或水起化学反应;②能溶于水;③不溶于水;
④应是极性溶剂;⑤应是非极性溶剂。
A.①②⑤ B.②③④ C.①③⑤ D.①③④
二、填空题(共40分)
26.(5分)X、Y、Z是主族元素的单质,K、H是化合物,它们有如下三个反应(式中各物质的计量数和反应条件已一概略去)
①X+K=H+Y;②X+Z→H;③Y+Z→K。
(1)若X和Y的组成元素不是同一族,请写出(并配平)符合①式的2个不同的化学方程式(2个式子中的2种X和2种Y分别由不同族的元素组成):______________。
(2)今有某化合物W,它跟化合的K和CO2反应都能生成单质Y。符合该条件(题设的3个“通式”)的单质X是______________,单质Y是______________,单质Z是______________,化合物W是______________(均写化学式)
27.(5分)化合物A是一种不稳定的物质,它的分子组成可用OxFy表示,10mLA气体能分解生成15mLO2和10mLF2(同温同压下)
(1)A的化学式是______________,推断的依据是______________。
(2)已知A分子中x个氧原子呈…O—O—O…链状排列,则A分子的电子式是______________,结构式是______________。
28.(7分)有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生3.36LH2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题:
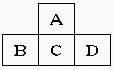
(1)五种元素的名称:A__________,B______________,C____________,D______________,E______________。
(2)画出C原子、A离子的结构示意图:______________。
(3)B单质在D单质中燃烧,反应现象是______________,生成物的化学式为______________。
(4)A与E形成的化合物的化学式是______________,它的性质决定了它在物质的分类中应属于______________。
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液直至再无明显现象发生时,观察到的现象是___________________________,有关反应的离子方程式为________________。
29.(7分)有X、Y、Z三种元素,其中:X的负价阴离子的原子核外电子排布和氙的原子核外电子排布相同;Y有两种氧化物,其水溶液都呈碱性。在Y的两种氧化物中,Y的质量分数分别是74.19%和58.97%,这两种氧化物的摩尔质量分别是62g·mol-1和78g·mol-1。在X和Y化合生成物的水溶液中滴入Z单质的水溶液,溶液由无色变为深黄色。Z和X在同一主族,相差2个周期。试回答:
(1)写出三种元素的名称:X______________,Y______________,Z______________。
(2)两种氧化物分别为______________和______________。
(3)Z的单质溶于不,滴加到X和Y形成的化合物的水溶液中,其离子方程式为(要求标明电子转移方向和总数)______________。
(4)X与Y形成化合物熔点比Z与Y形成的化合物______________,其原因是___________。
(5)用电子式表示Y的质量分数与74.19%的氧化物的形成过程:______________。
30.(4分)已知有关物质的熔、沸点数据如下表:
| 物质 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 熔点/℃ | 2852 | 2072 | 714 | 190(215×105Pa) |
| 沸点/℃ | 3600 | 2980 | 1412 | 182.7 |
(1)工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔混合物的方法生产铝。为什么不用电解MgO的方法生产镁,也不用电解AlCl3的方法生产铝?
答:______________________________________________________________________
(2)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实验方法是___________。
31.(5分)A、B、C三种元素为短周期元素。A元素的阴离子不能被任何氧化剂氧化,则A离子的结构示意图为______________,它是______________离子。1molB单质能从盐酸中置换出3g氢气,此时B转变为与Ne原子具有相同电子层结构的离子,则B元素是______________;B的最高价氧化物的对应水化物的化学式为______________。C元素有3个电子层,且最外层比L电子层少2个电子,则C元素是______________;C与Na反应后生成物的电子式为______________,化合物中的化学键属于______________。
32.(4分)气体A只含X、Y两种短周期元素,X的原子序数大于Y的原子序数,B、D、E是中学化学中常见的气体,各物质有如下图所示的转化关系:
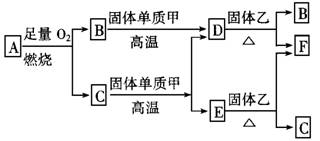
试根据上述条件回答下列问题:
(1)若气体A为混合气体,且X与Y的质量比小于3,则气体A中肯定含有______________。
(2)若气体A为单一气体,且X与Y的质量比等于3,则气体A的名称叫______________。
(3)C与固体甲在高温下反应的化学方程式为_____________________________________。
33.(4分)某离子晶体晶胞结构如下图所示,X位于立方体的顶点,Y位于立体中心。试分析:
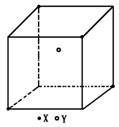
(1)体中每个Y同时吸引着______________个X,每个X同时吸引着______________个Y,该晶体化学式为______________。
(2)晶体中在每个X周围与它最接近且距离相等的X共有______________个。
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX的度数为______________(填角的度角)。
(4)设该晶体的摩尔质量为Mg·mol-1,晶体密度为ρg·cm-3,阿伏加德罗常数为Na,则晶体中两个距离最近的X中心间的距离为______________cm。
三、解答题(5分+5分=10分)
34.有A、B、C三种元素,已知5.75gA单质跟盐酸完全反应,在标准状况下可产生2.8L氢气和0.25molACln;B的气态氢化物的分子式为H2B,其相对分子质量与B的最高价氧化物的水化物相对分子质量之比为1∶2.88,B核内质子数与中子数相等;C和B可以形成CB2型液态化合物,并能溶解B的单质,试回答下列问题:
(1)试通过计算推断A、B、C各是什么元素?
(2)写出A、B的离子结构示意图、B在周期表中的位置、CB2的化学式;
(3)用电子式表示Ca和B形成化合物的过程。
35.某元素的同位素ZAX,它的氯化物XCl21.11g溶于水制成溶液后,加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内有20个中子,求:
(1)Z值和A值;
(2)X元素在周期表中的位置;
(3)把X的单质放入水中,有何现象?写出反应的化学方程式。

参考答案
【单元达纲检测】
一、1.AC 2.A 3.A 4.B 5.C 6.D 7.C 8.C 9.D 10.C 11.AD 12.BD 13.B 14.A 15.D 16.AD 17.A 18.CD 19.B 20.B 21.C 22.CD 23.BD 24.BC 25.C
二、26.(1)2Al+6HCl=2AlCl3+3H2↑ 2F2+2H2O=4HF+O2↑。 (2)F2 O2 H2 Na2O2
27.(1)O3F2,阿伏加德罗定律及质量守恒定律 (2)![]() ,F—O—O—O—F
,F—O—O—O—F
28.(1)A:O B:P C:S D:Cl E:Al
(2)C原子:![]() A离子:
A离子:![]()
(3)白色烟雾 PCl3、PCl5
(4)Al2O3 两性氧化物
(5)先有白色胶状沉淀产生并逐渐增多,随NaOH加入又逐渐溶解最终澄清 Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O
29.(1)碘
钠 氯 (2)Na2O Na2O (3)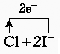 =2Cl-+I2
(4)低
I-离子半径大于Cl-离子半径,NaI离子键比NaCl弱,故NaI的熔点比NaCl低。
=2Cl-+I2
(4)低
I-离子半径大于Cl-离子半径,NaI离子键比NaCl弱,故NaI的熔点比NaCl低。
(5) ![]()
30.(1)因为MgO的熔点远高于MgCl2,故电解熔融MgO将需要更高的温度,不便于操作。观察表中数据可见,AlCl3易升华,熔、沸点低,故属于分子晶体,不存在离子,不能被电解。(2)将两种晶体加热到熔化状态,MgCl2能导电,AlCl3不能导电,故确证MgCl2为离子晶体,AlCl3为分子晶体。要注意由于MgCl2、AlCl3溶于水都能电解,不能用它们的溶液作导电性实验来证明所属晶体类型。
31.![]() 氟 Al
Al(OH)3 S
氟 Al
Al(OH)3 S ![]() 离子键
离子键
32.(1)H2 (2)甲烷 (3)H2O+C![]() CO+H2
CO+H2
33.(1)4 8 XY2(或Y2X) (2)12 (3)109°28′ (4)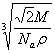
三、34.(1)A为钠,B为硫,C为碳 (2)![]()
![]() B在第三周期ⅥA族,CB2化学式为CS2 (3)
B在第三周期ⅥA族,CB2化学式为CS2 (3)![]()
35.(1)Z=20,A=40 (2)第四周期,ⅡA族 (3)有气泡产生,Ca+2H2O=Ca(OH)2+H2↑
