物质结构 元素周期律
第二讲 元素周期律
复习重点:原子核外电子层排布和元素金属性、非金属性变化的规律。
复习难点:元素金属性、非金属性变化的规律。
知识梳理
一、原子核外电子的排步
1.核外电子运动特征:(1)核外电子的特征:⑴电子的质量极___(____kg);
⑵电子绕核运动是在_______的空间(原子的直径约___m)中进行;⑶电子绕核作__速运动(运动的速度接近__,约为__)。
(3)核外电子运动特征:电子绕核运动__确定的轨道,__精确测定或计算电子在任一时刻所在的位置,____描绘出其运动轨迹。我们只能指出___________。
(3)电子层与离核远近及能量高低关系:
| 层序数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 电子层符号 | K | L | M | N | O | P | Q |
| 离核远近 | |||||||
| 能量 | |||||||
2.核外电子排布规律
电子由内向外按能量由低到高分层排布,第n层最多容纳的电子数为__,最外层电子数≤_。(K层为最外层不超过_个)。次外层电子数≤__,倒数第三层电子数≤__。
3.元素性质原子核外电子排布的关系
(1)稀有气体元素的原子最外层有8个电子(He为2)处于稳定结构,化学性质稳定,一般不跟其它物质发生化学反应。
(2)非金属性与金属性(一般规律):
| 电外层电子数 | 得失电子趋势 | 元素性质 | |
| 金属元素 | <4 | __ | ___ |
| 非金属元素 | >4 | __ | ___ |
二.元素周期律
金属性的判断:①单质与水反应置换出氢的难易程度;②单质与酸反应置换出氢的难易程度③最高价氧化物对应的水化物(氢氧化物)的碱性强弱。
非金属性的判断:①与氢气反应生成氢化物的难易程度;②氢化物的稳定性;③最高价氧化物对的水化物的酸性强弱。
1、探究第三周期元素性质递变规律:
(1)钠镁铝金属性的递变规律
①与水反应:Mg常温下与水无明显现象;加热镁带表面有大量气泡出现,滴入酚酞溶液变红。Al在常温或加热下,遇水无明显现象。
②与酸反应:Mg与盐酸反应要比Al剧烈。与Mg反应的试管壁温度_,与Al反应的试管壁温度_。
③Na2O、MgO为碱性氧化物,Al2O3为两性氧化物。Al(OH)3为两性两性氢氧化物。
_Al2O3+_HCl = __+__ ; _Al2O3+_NaOH = ___+___。
_Al(OH)3+_H2SO4 == __+__; _Al(OH)3+_NaOH =__+___。
2、硅、磷、硫、氯的非金属性的递变规律
| Si | P | S | Cl | |
| 最高正价 | ||||
| 最低负价 | ||||
| 单质与氢气反应的条件及氢化物稳定性 | ||||
| 最高价氧化物 | ||||
| 离高价氧化物的水化物 | H4SiO4 弱酸 | H3PO4 中强酸 | H2SO4 强酸 | HClO4 最强无机酸 |
|
| ||||
| 结论 | ||||
综上所述,我们可以从11~18号元素性质的变化中得出如下结论:
Na Mg Al Si P S Cl Ar
![]() 金属性逐渐减弱,非金属性逐渐增强 稀有气体元素
金属性逐渐减弱,非金属性逐渐增强 稀有气体元素
三.元素周期表和元素周期律的应用
1.元素的金属性和非金属性与元素在周期表中的递变关系
(1)同周期元素:同周期,电子层数相同,即原子序数越大,原子半径越 ,核对电子的引力越 ,原子失电子能力越 ,得电子能力越 ,金属性越 、非金属性越 。
(2)同主族元素:同主族,电子层数越多原子半径越 核对电子引力越 原子失电子能力越强得电子能力越弱金属性越 、非金属性越 。
2、元素化合价与元素在周期表中位置的关系:
对于主族元素:最高正价= 族序数;最高正化合价 +∣最低负价∣= 8。
3.元素周期表及元素周期律应用
◎农药多数是含__元素的化合物,在周期表的____。
◎半导体材料都是____的元素,如硅、锗等。
◎催化剂的选择:人们在长期的生产实践中发现___元素对许多化学反应有良好的催化性能。这些元素的催化性能跟它们的原子的次外层电子层电子排布的特点有密切关系。
疑难点拨
一、微粒半径大小的比较规律
1.
层数相同,核大半径小。即电子层数相同时,结构相似的微粒中核电荷数大的微粒半径小。例如:![]() 。
。
2.
层异,层大半径大。即当微粒的电子层数不同时,结构相似的微粒中,电子层数大的微粒半径大。如:![]() 。。
。。
3.
核同,价高半径小。即对同一种元素形成的不同的简单微粒中,化合价高的微粒的半径小。如![]() 。
。
4.
电子层结构相同,核电荷数大,则半径小。如![]() 。
。
二、1~20号元素中的某些元素的特性
1、与水反应最激烈的金属是K,非金属是F。
2、原子半径最大的是K,最小的是H。
3、单质硬度最大的,熔、沸点最高的,形成化合物品种最多的,正负化合价代数和为零且气态氢化物中含氢百分率最高的元素是C。
4、气体密度最小的,原子核中只有质子没有中子的,原子序数、电子层数、最外层电子数三者均相等的是H。
5、气态氢化物最稳定的,只有负价而没有正价的,无含氧酸的非金属元素是F。
6、最高氧化物对应的水化物酸性最强的是CI,碱性最强的是K。
7、空气中含量最多的,气态氢化物在水中的溶解度最大,其水溶液呈现碱性的是N。
8、单质和最高价氧化物都是原子晶体的是Si。
9、具有两性的元素是AI(Be)。
10、最轻的金属是Li。
11、地壳中含量最多的元素是O。
12、单质能自燃的元素是P。
13、族序数等于周期数的元素是H、Be、AI。
14、族序数等于周期数2倍的元素是C、S。
15、族序数等于周期数3倍的元素是O。
16、周期数是族序数2倍的元素是Li。
17、周期数是族序数3倍的元素是Na。
18、最高正价与最低负价代数和为零的短周期元素是C、Si。
19、最高正价是最低负价绝对值3倍的短周期元素或短周期中离子半径最大的元素是S。
20、除H外,原子半径最小的元素是F。
21、最高正化合价不等于族序数的元素是O、Fe。
三、中学中几种重要的两性化合物
既能跟强酸(H+)反应,又能跟强碱(OH-)反应的化合物可称为两性化合物。包括两性氧化物、两性氢氧化物、弱酸的酸式盐以及氨基酸等。
1.铝、氢氧化铝、氧化铝的两性
(1)2Al+6 H+==2 Al3++3H2↑ 2Al+2OH-+2H2O==2AlO2-+3H2↑
(2)Al2O3+6H+==2Al3++3H2O Al2O3+2OH-=2AlO2-+H2O
(3)Al(OH)3既能与强酸反应又能与强碱反应:
Al(OH)3既能与强酸反应又能与强碱反应,说明Al(OH)3必须同时能电离出H+和OH-,即能发生“两性电离”:
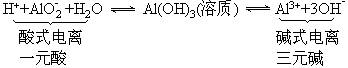
根据平衡移动原理,:当向上述平衡体系中加强酸,[H+]增大,同时又中和OH-使[OH-]下降,平衡向右移动,结果Al(OH)3逐渐溶解成Al3+;当向上述平衡中加强碱,[OH-]增大,同时又中和H+使[H+]下降,平衡向左移动,结果Al(OH)3固体逐渐溶解成为AlO2-。相关方程式:
Al(OH)3+3H+==Al3++3H2O(不能与H2CO3等弱酸反应)
Al(OH)3+OH-==AlO2-+2H2O(不能与氨水等弱碱反应)
2.Be(OH)2或H2BeO2(铍酸)的两性
与Al(OH)3相同Be(OH)2存在如下两性电离:
2H++BeO22-
![]() Be(OH)2
Be(OH)2 ![]() Be2++2OH-
Be2++2OH-
Be(OH)2+2H+==Be2++2H2O Be(OH)2+2OH-==BeO22-+2H2O
3、Zn(OH)2或H2ZnO2(锌酸)的两性:
Zn(OH)2+2H+==Zn2++2H2O Zn(OH)2+2OH-==ZnO22-+2H2O
注意:Zn(OH)2可溶于氨水生成[Zn(NH3)4]2+。
4、弱酸的酸式盐的两性
(1)实例:NaHCO3、NaHS、NaH2PO4、Na2HPO4等。
(2)本质:酸式盐的阴离子在水中亦存在两个平衡:
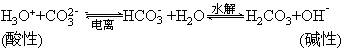
所以它们均既能与强酸反应又能与强碱反应,如:
NaHS+HCl==NaCl+H2S↑ NaHS+NaOH==Na2S+H2O
5、氨基酸的两性
氨基酸分子既有酸性的羧基,又有碱性的氨基,因此和酸碱均能反应生成盐,是一种两性化合物。而且氨基酸分子中的氨基与羧基还可形成内盐。氨基酸的水溶液中,存在如下平衡:
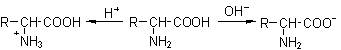
在强酸性溶液中,氨基酸以阳离子形式存在;在强碱性溶液中,则主要以阴离子形式存在;氨基酸在一般情况下不是以游离的羧基或氨基存在的,而是两性电离,在固态或水溶液中形成内盐:
![]()
典例剖析
【例1】X和Y两元素的阳离子具有相同的电子层结构,X元素的阳离子半径大于Y元素的阳离子半径;Z和Y两元素的原子核外电子层次相同,Z元素的原子半径小于Y元素的原子半径。X、Y、Z三种元素原子序数的关系是
A、X>Y>Z B、Y>X>Z C、Z>X>Y D、Z>Y>X
解析:根据原子序数和元素周期律推测原子和离子半径大小,这是正向思维。而本题是已知原子和离子半径的大小,要判断原子序数大小的关系,这是逆向思维。已知电子层结构相同的阳离子,核电荷数大的则半径小,具有相同的电子层数的原子,随着原子序数增大,原子半径递减。根据题意,X元素的阳离子半径大于Y元素的阳离子半径,则X的原子序数小于Y的原子序数;Z和Y元素的原子核外电子层数相同,且Z元素的原子半径小于Y元素的原子半径,则Z元素的原子序数大于Y元素。由此得出三种元素原子序数的关系为Z>Y>X,答案:D。
【例2】已知铍(Be)的原子序数为4。下列对铍及其化合物的叙述中,正确的是
A、铍的原子半径大于硼的原子半径 B、氯化铍分子中铍原子的最外层电子数是8
C、氢氧化铍的碱性比氢氧化钙的弱 D、单质铍跟冷水反应产生氢气
解析:因为同周期元素原子半径从左到右递减,所以A正确;BeCl2中Be的最外层电子数为2,B错误;同主族元素从上到下金属性增强,最高价氧化物对应水化物碱性增强,C正确;Mg不与冷水反应,而Be的金属性比镁弱,与冷水反应更难,D错误。答案:A、C
【例3】下表是元素周期表的一部分,表中所列的字母分别表示一种化学元素

⑴下列 (填写编号)组元素可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、l ④d、e、f
⑵如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
A、原子核对核外电子的吸引力;B、形成稳定结构的倾向
(2)下表是一些气态原子失去核外不同电子所需的能量(KJ/mol):
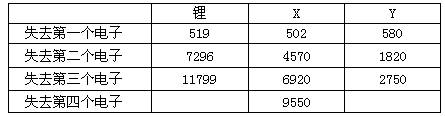
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量。_____________________。
②表中X可能为以上13种元素中的_______(填写字母)元素。用元素符号表示X和j形成化合物的化学式__________;Y是周期表中______族元素。
③以上13种元素中,__(填写字母)元素原子失去核外第一个电子需要的能量最多。
答案:(1)①④ (2)①Li原子失去一个电子后,Li+已经形成稳定结构,此时再失去一个电子很困难 ②aNa2O和Na2O2 ③IIIA或第三主族 ④m
【例4】制冷剂是一种易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到制冷目的。人们曾经采用过乙醚、NH3、CH3Cl等作制冷剂,但它们不是有毒,就是易燃。于是科学家根据元素性质的递变规律来开发新的制冷剂。
据现有知识,某些元素化合物的易燃性、毒性变化趋势如下:
(1)氢化物的易燃性:
第二周期: > >H2O>HF
第三周期:SiH4>PH3> >
(2)化合物的毒性:PH3>NH3;H2S>H2O;CS2 CO2;CCl4>CF4,于是科学家们开始把注意力集中在含F、Cl的化合物上。
(3)已知CCl4的沸点为76.80C,CF4的沸点为—1280C,新制冷剂的沸点范围应介于其间。
经过较长时间的反复试验,一种新的制冷剂氟里昂CF2Cl2终于诞生了,其他类似的还可以是
。
(4)然而,这种制冷剂造成了当今的某一个环境问题是 。但求助于周期表中元素及其化合物 变化趋势来开发制冷剂的科学思维方法是值得借鉴的。(填写字母,多选扣分)
①毒性;②沸点;③易燃性;④水溶性;⑤颜色
A、①②③ B、②④⑤ C、②③④
解析:(1)根据元素周期律,非金属性越强,氢化物的稳定性越大.从题中的信息,知道第三周期的氢化物易燃性顺序为SiH4>PH3>H2S>HCl,因此很容易推出第二周期的氢化物的易燃性顺序为CH4>NH3>H2O、HF.(2)根据已知化合物的毒性:PH3>NH3,CCl4>CF4,自己创
造规律,得出“相同类型的化合物,相对分子质量越大,其化合物的毒性也越大”的结论,然后应用此规律,得出H2S>H2O;CS2>O2.答案:(1)CH4 NH3 (2)> > (3)CFCl3(或CF3Cl)(4)使大气臭氧层出现空洞 A。
知能训练
一、选择题
1.元素性质呈周期性变化的原因是
A.相对原子质量逐渐增大 B.核电荷数逐渐增大
C.核外电子排布呈周期性变化 D.元素的化合价呈周期性变化
2.已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是
A. 质子数c>b B. 离子的还原性Y2->Z-
C. 氢化物的稳定性H2Y>HZ D. 原子半径X<W
3.下列各组元素中,按最高正价递增顺序排列的是
A.F、Cl、Br、I B.K、Mg、C、S
C.C、N、O、F D.Li、Na、K、Rb
4.按Be、Mg、Ca、Sr、Ba的顺序而递增的性质是
A.氧化性 B.还原性 C.熔点 D.化合价
5.1~18号元素的离子中,原子核电荷数和离子最外层电子数相同的是
A.Cl— B.Na+ C.O2— D.S2—
6.1~18号元素中,原子的核外电子数与电子层数相同的是
A.氢 B.铍 C.铝 D.氯
7.下列各组微粒半径之比大于1的是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
8.元素X的原子核外M电子层上有3个电子,元素![]() 的离子核外有18个电子,则这两种元素可形成的化合物为
的离子核外有18个电子,则这两种元素可形成的化合物为
A.XY2 B.X2Y3 C.X3Y2 D.X2Y
9.A、B均为原子序数1~20的元素,已知A的原子序数为n,![]() 离子比
离子比![]() 离子少8个电子,则B的原子序数为
离子少8个电子,则B的原子序数为
A.n+4 B.n+6 C.n+8 D.n+10
10.X、Y、Z是3种短周期元素,其中X、Y位于同一族,Y、Z处于同一周期。X原子的最外层电子数是其电子层数的3倍。Z原子的核外电子数比Y原子少1。下列说法正确的是
A.元素非金属性由弱到强的顺序为Z<Y<X
B.Y元素最高价氧化物对应水化物的化学式可表示为H3YO4
C.3种元素的气态氢化物中Z的气态氢化物最稳定
D.原子半径由大到小的顺序为Z>Y>X
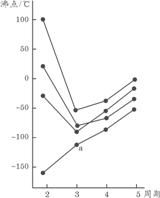
11.右图中每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是
A. H2S B. HCl C. PH3 D. SiH4
12.R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数)
A.若R(OH)n为强碱,则W(OH)n+1也为强碱
B.若HnXOm为强酸,则Y是活泼非金属元素
C.若Y的最低化合价为-2,则Z的最高正化合价为+6
D.若X的最高正化合价为+5,则五种元素都是非金属元素
二、填空题
13.金属元素A1mol单质跟足量盐酸反应能生成3gH2,这时A转化为与氖原子电子层结构相同的离子,故A的元素符号为 ,与左、右相邻元素比较,其原子半径比 大,金属性比 弱;A的氧化物化学式为 ,它是 性氧化物,在原子核外电子层数与A原子相同的元素中,原子半径最大的元素是 ,该元素最高价氧化物的水化物与A的氧化物反应的化学方程式为 。
14.非金属元素R,其单质4.8g在氧气中充分燃烧生成RO29.6g,在R原子中,核内质子数等于中子数,则R的元素名称为 ,其最高价为 ,与左右相邻元
素比较,R的氢化物比 稳定,R的最高价氧化物的水化物酸性比 弱。
15.A、B两元素形成的简单离子具有相同的电子层结构,A、B两元素的单质都能与水剧烈反应,在反应中,A单质为氧化剂,B单质为还原剂,则:
(1)A单质的化学式为 ,A的原子结构示意图为 ,B单质的化学式为 ,B的离子结构示意图为 。
(2)A单质与水反应的化学方程式为 ,B单质与水反应的化学方
程式为 。
三、推断题
16.已知A、B、C三种元素的原子中,质子数为A<B<C,且都小于18,A元素的原子最外层电子数是次外层电子数的2倍;B元素的原子核外M层电子数是L层电子数的一半;C元素的原子次外层电子数比最外层电子数多1个。试推断:
(1)三种元素的名称和符号:A________,B________,C________。
(2)画出三种元素的原子结构示意图:A________,B________,C________。
17.某元素R的原子最外层有5个电子,6.2g R的单质完全氧化后生成14.2g氧化物,R原子核内质子数比中子数少1个。试推断R元素的名称________;元素符号________;原子结构示意图________。
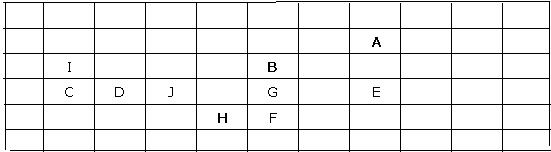
18.设想你去外星球做了一次科学考察,采集了该星球上十种元素单质的样品,为了确
定这些元素的相对位置以便系统地进行研究,你设计了一些实验并得到了下列结果:
| 单质 | A | B | C | D | E | F | G | H | I | J |
| 熔点/℃ | -150 | 550 | 160 | 210 | -50 | 370 | 450 | 300 | 260 | 250 |
| 与水反应 | √ | √ | √ | √ | ||||||
| 与酸反应 | √ | √ | √ | √ | √ | √ | ||||
| 与氧气反应 | √ | √ | √ | √ | √ | √ | √ | √ | ||
| 不发生化学反应 | √ | √ | ||||||||
| 对于A元素 的原子质量 | 1.0 | 8.0 | 15.6 | 17.1 | 23.8 | 31.8 | 20.0 | 29.6 | 3.9 | 18.0 |
按照元素性质的周期性递变规律,试确定以上十种元素的相对位置,并填入下表:
| A | ||||||||||
| B | ||||||||||
| H | ||||||||||
四、计算题
19.已知有两种气体单质![]() 和
和![]() 。2.4g
。2.4g ![]() 和2.1g
和2.1g ![]() 所含原子数目相等;在相同状况下,它们的体积比为2∶3。A和B的原子核内质子数等于中子数,且A原子的L层所含电子数是K电子层上电子数的3倍。试通过计算推断:
所含原子数目相等;在相同状况下,它们的体积比为2∶3。A和B的原子核内质子数等于中子数,且A原子的L层所含电子数是K电子层上电子数的3倍。试通过计算推断:
(1)A、B两元素的名称。
(2)m和n的值。
(3)自然界中还存在一种由A元素形成的单质,试写出其化学式。
参考答案:
一、1.C 2.B 3.B 4.B 5.C 6.A 7.C 8.B 9.A 10.AD11.D12.B
二、13.Al,Si,Mg,Al2O3,两,Na,2NaOH+Al2O3=2NaAlO2+H2O 14.硫,+6,PH3,HClO4
15.(1)F2 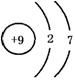 Na
Na 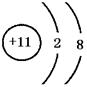 (2)2F2+2H2O=4HF+O2 Na+2H2O=2NaOH+H2↑
(2)2F2+2H2O=4HF+O2 Na+2H2O=2NaOH+H2↑
三、16.(1)A:碳、C B:硅、Si C:氯、Cl
(2)A:![]() B:
B: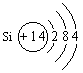 C:
C: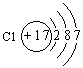 17.磷;P;
17.磷;P;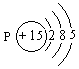
18.
四、19.(1)A:氧 B:氮 (2)m=3,n=2 (3)![]()
