第二章 化学反应与能量
第一讲 化学能与热能
复习重点:化学能与热能之间的内在联系以及化学能与热能的相互转化。
复习难点:从本质上(微观结构角度)理解化学反应中能量的变化,从而建立起科学的能量变化观。
知识梳理
一.化学键与化学反应中能量变化的关系
键能:拆_________所需的能量叫键能。单位:____。1mol H2中含有1molH-H,在250C 101kPa条件下,由H原子形成1molH-H要放出436kJ的能量,而断开1molH-H重新变为H原子要________的能量。
1、化学键的断裂是化学反应中能量变化的主要原因。
一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于____________________的相对大小。
∑E(反应物)>∑E(生成物)——______能量;
∑E(反应物)<∑E(生成物)——______能量。
二.化学能与热能的相互转化
放热反应:___________;吸热反应:___________。
2Al+6HCl=2AlCl3+3H2↑反应___热;Ba(OH)2·8H2O+2NH4Cl==BaCl2+2NH3↑+10H2O反应__热;H+ + OH- = H2O反应__热
三、中和热:_________________时所释放的热量。
疑难点拨
一、化学反应的热效应和键能的关系
在化学反应中,从反应物分子改变为生成物分子,各原子内部并没有多少变化,但原子间的结合方式发生了改变.在这个过程中,反应物分子中的化学键部分或全部遭到破坏,生成物分子中的新化学键形成了,在破坏旧化学键时,需要能量来克服原子间的相互作用,在形成新化学键时,由于原子间的相互作用而放出能量、化学反应的热效应来源于反应过程中
断裂旧化学键并形成新化学键时的能量变化。化学键键能的大小可粗略计算化学反应的热效应。化学反应的热效应ΔH=生成物的键能总和-反应物的键能总和。
二、. 化学反应中能量变化与反应的放、吸热
反应物的总能量>生成物的总能量,化学反应放出能量
反应物的总能量<生成物的总能量,化学反应吸收能量
化学键的断裂和形成是化学反应中能量变化的主要原因。
化学变化的过程伴随着化学能与其他能量的相互转化,这种变化,通常表现为热量的变化——吸热或放热。例如:中和反应是放热反应,H2与Cl2的反应也是放热反应。常见的吸热反应:大多数分解反应;氯化铵与八水合氢氧化钡的反应;
典例剖析
【例1】 近年来,科学家正在探索利用铝粉做燃料的可能性,以期铝能成为一种石油的取代物。假如铝作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法,你认为哪项是错误的
A、 铝质轻,便于运输、贮存,且安全
B、 铝燃烧时放出的热量大,且燃烧后新产物对环境的污染容易得到有效控制
C、 在地球上,铝矿资源丰富
D、现代电冶铝的工业技术已为铝作为新能源奠定了重要基础
解析:铝质轻,燃烧时放热多,在地壳中是含量最大的金属元素,铝矿资源丰富,这些都是用铝作为新型燃料的有利条件,但是电冶铝本身需要消耗大量的能量,从这一点考虑,如果没有开发出新的冶炼金属铝的技术,则用铝作为新能源的做法是不合算的。所以D说法错误。答案:D。
【例2】最近,新华社的一条消息中披露:我国南海海底发现巨大的“可燃冰”带,能源总量估计相当于中国石油总量的一半;而我国东海“可燃冰”的蕴藏量也很可观……“可
燃冰”的主要成分是一水合甲烷晶体(CH4·H2O)。请结合初中化学知识回答下列问题:
(1)下列说法中正确的是(填序号)___________________________.
A.CH4·H2O晶体中水是溶剂B.CH4·H2O的组成元素有3种
C.CH4·H2O中CH4和H2O的质量比为1:1D.可燃冰能燃烧,说明水具有可燃性
(2)可燃冰的发现为我国在新世纪使用高效新能源开辟了广阔的前景.你认为能开发利用 的新能源还有(至少填写二种)__________________,__________________.
解析:(1)溶剂是能够溶解其他物质的物质,溶剂与溶质间没有固定的组成,而CH4·H2O的组成固定故A不正确.CH4中含C、H二元素,H2O中含H、O二元素,故CH4·H2O由C、H、O三元素,组成B正确.CH4·H2O分子中CH4与H2O的物质的量之比为1:1,而其式量不等则C
不正确.CH4·H2O可燃是由于分解产生CH4的原因,故D不正确.
(2)新能源是指以新技术为基础,系统开发利用的能源包括太阳能、生物能、风能、
地热能、氢能源等.
答案:(1)B (2)太阳能、潮汐能、水能、风能、核能、地热、氢能源等.
【练习】 为减少汽车对城市大气的污染,近年来中国成功地开发出了以新燃料作能源
的“绿色汽车”.这种汽车可避免有毒的有机铅、苯和苯的同系物以及多环芳烃的排放,保护环境.这种“绿色汽车”的燃料是
A.甲醇 B.汽油 C.柴油 D.重油
答案: A
【例3】50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
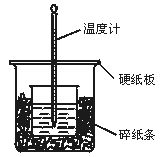
(1)从实验装置上看,图中尚缺少的一种玻璃用品是___________________________.
(2)烧杯间填满碎纸条的作用是_____________________________________________.
(3)大烧杯上如不盖硬纸板,求得的中和热数值__________________(填“偏大”“偏小”
“无影响”)。
(4)实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行反应,与上
述实验相比,所放出的热量_________(填“相等”“不相等”),所求中和热_________(填“相等”“不相等”),简述理由_____________________________________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会________;用50 mL 0.50 mol/L NaOH溶液进行上述实验,测得的中和热的数值会__________________.(均填“偏大”“偏小”“无影响”)
解析: 本实验成败的关键是准确测量反应后的温度.因此所用装置必须保温、绝热且可使体系温度尽快达到一致,故缺少的仪器应为环形玻璃搅拌棒.(2)碎纸条的作用为减少实验过程中的能量损失.(3)不盖硬纸板会损失部分热量故所测结果偏低.(4)由中和热概念可知,中和热只与生成水的量有关而与过量的酸碱无关,但液体体积增大温差减小,不便测
量.(5)由于弱酸弱碱的中和热等于H+与OH-生成H2O时的反应热加上其电离时吸热.
答案: (1)环形玻璃搅拌棒 (2)减少实验过程中的热量损失 (3)偏小 (4)不等 相等 因为中和热是指酸跟碱发生中和反应生成1 mol H2O所放出的能量,与酸碱的
用量无关 (5)偏小 偏小
思考: 要想提高中和热测定的准确性,实验应注意什么?
答案: (1)搅拌或倾倒时不要有溶液损失;(2)准确读取混合液的最高温度值;(3)溶液浓度不能太浓或太稀。
知能训练
一、选择题
1. 天然气、石油、煤等在地球上的蕴藏量是有限的,因此:①可利用电解水的方法得
到氢气作能源;②可用酒精作能源;③砍伐树木作能源;④应开发太阳能、核能等新的能源.上述说法正确的是
A.只有① B.①和④ C.②和③ D.只有④
2.下列说法正确的是
A. 物质发生化学反应都伴随着能量变化
B. 伴有能量变化的物质变化都是化学变化
C. 在一个确定的化学反应关系中,反应物的总能量与生成物的总能量一定不同
D. 在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量
3.能源可分为一级能源和二级能源,自然界中以现成形式提供的能源称一级能源,需依靠其他能源的能量间接制取的能源称为二级能源。据此判断,下列叙述正确的是
A.天然气是二级能源 B.石油是二级能源C.电能是一级能源 D.水力是一级能源
4.下列反应属于放热反应的是
A.氢气还原氧化铜 B.氢气在氧气中燃烧
C.氢氧化钾和硫酸中和 D.碳酸钙高温分解成氧化钙和二氧化碳
5.下列反应属于吸热反应的是
A.二氧化碳与赤热的碳反应生成一氧化碳 B.葡萄糖在人体内氧化分解
C.Ba(OH)2·8H20与NH4Cl反应 D.锌粒与稀H2S04反应制取H2
6.下列说法不正确的是
A.焦炭在高温下与水蒸气的反应是吸热反应
B.氢氧化钾与硝酸的反应是放热反应
C.燃料有足够的空气就能充分燃烧
D.化学反应的过程,都可以看成是“贮存”在物质内部的能量转化为热能等而被释放
出来的过程
7.(2002年上海综合,18)下列选项中说明乙醇作为燃料的优点的是
①燃烧时发生氧化反应②充分燃烧的产物不污染环境③乙醇是一种再生能源④燃烧时放出大量热量
A.①②③ B.①②④C.①③④ D.②③④
8.(2002年上海综合,16)船天飞机用铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料,
点燃时铝粉氧化放热引发高氯酸铵反应,其方程式可表示为:
NH4ClO4===N2↑+4H2O+Cl2↑+2O2↑
下列对此反应的叙述中错误的是
A.上述反应属于分解反应
B.上述反应瞬间产生大量高温气体推动航天飞机飞行
C.反应从能量变化上说,主要是化学能转变为热能和动能
D.在反应中高氯酸铵只起氧化剂作用
9.已知某反应是放热反应,下列说法正确的是
A. 该反应发生时,一定不需要加热
B. 该反应中反应物的总能量小于生成物的总能量
C. 该反应中反应物的总能量大于生成物的总能量
D. 如果该反应开始后停止加热,反应一定能继续进行
10. 1 molH–I 键的键能是299KJ。 1mol I – I 键的键能是151KJ, 1mol H–H键的键能是436KJ, 则H2(g)+I2(g)=2HI(g)的反应是
A. 吸热反应 B. 放热反应 C. 分解反应 D. 可逆反应
11. 已知反应A+B=C+D为放热反应,对该反应的下列说法中正确的为
A. A的能量一定高于C B. B的能量一定高于D
C. A和B的总能量一定高于C和D的总能量
D. 该反应为放热反应,故不必加热就一定能发生
12. 2C + O2 = 2CO,2CO + O2 = 2CO2 都是放热反应。据此推断,下列说法不正确的是
(其他条件相同)
A. 12gC所具有的能量一定高于28gCO所具有的能量
B. 56gCO和32gO2所具有的总能量大于88gCO2所具有的总能量
C. 12gC和32gO2所具有的总能量大于44gCO2所具有的总能量
D. 将一定质量的碳燃烧,生成CO2比生成CO时放出的热量多
二、填空题
13、一切化学反应除了有质量的变化外,还伴随着 的变化,它们分别遵循 定律和 定律。能量变化通常主要表现为 的变化,即 或者 。
14、 既是化学反应过程的本质,又是化学反应中能量变化的主要原因 。 从能量的角度看,断开化学键要 ,形成化学键要 。一个化学反应是吸收能量(热量)还是放出能量(热量),取决于 。
15.不同的物质不仅组成不同、结构不同,所包含的 也不同。放热反应的宏观表现是 ,其微观表现是 。
16.在氢气与氯气反应生成氯化氢气体的反应中,若断裂1mol H - H键要吸收436KJ的能量,断裂1mol Cl- Cl键要吸收243KJ的能量,断裂1molH - Cl键要吸收432KJ的能量,则充分燃烧1mol H2 的能量变化是 。若 ΔH〈 0代表放热,ΔH 〉0代表吸热,该化学反应的热化学方程式是 。
17、把煤作为燃料可通过下列两种途径:
途径Ⅰ:C(s)+O2(g)![]() CO2(g) (
放热Q1 kJ )
CO2(g) (
放热Q1 kJ )
途径Ⅱ:先制水煤气
C(s)+H2O(g) == CO(g)+H2(g) (吸热Q2 kJ)
再燃烧水煤气
![]()
|
2H2(g)+O2(g) ![]() 2H2O(g)
2H2O(g)
试回答下列问题:
(1)判断两种途径放热:途径Ⅰ放出的热量_________(填“大于”、“等于”或“小于”)
途径Ⅱ放出的热量。
(2)Q1、Q2、Q3的数学关系式是__________________。
(3)由于制取水煤气反应里,反应物所具有的总能量________生成物所具有的总能量,
那么在化学反应时,反应物就需要_______能量才能转化为生成物,因此其反应条
为 。
(4)简述煤通过途径Ⅱ作为燃料的意义: 。
三、计算题
18、火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热.已知0.4 mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出256.652 kJ的热量.
(1)反应的热化学方程式为_____________________.
(2)又已知H2O(l)===H2O(g),ΔH=+44 kJ·mol-1,由16 g液态肼与液态双
氧水反应生成液态水时放出的热量是__________kJ.
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是________________________________________.
(4)火箭的密封仪器舱内有一水银气压计,起飞前仪器舱内气温为 17 ℃,气压计中水银柱高度为76 cmHg.当火箭以大小为g的加速度竖直向上发射时,气压计水银柱高度为
45.6 cm Hg.问此时仪器舱内温度为多少?
参考答案
一、选择题
1、 D2、 AC3 、D4 、BC5 、AC6、 CD 7、D8、D9、CD10、BD11、C12、A
二、填空题
13、能量;质量守恒定律;能量守恒定律;热量 ;放热;吸热 。
14、化学键的断裂与形成;吸收能量;放出能量;断开化学键吸收的能量多,还是形成化学键释放的能量多 。
15、化学能;反应物总能量高于生成物总能量;断开化学键吸收的能量少于形成化学键放出的能量 。
16、出185KJ的能量;H2(g) + Cl2(g)= 2HCl(g);ΔH = - 185KJ/ mol。
17、(1)等于 (2)Q1 = Q3 - Q2 (3)低于 吸收 高温 (4) 固体煤经处理变为气体燃料后,不仅在燃烧时可以大大减少SO2和烟尘对大气造成的污染,而且燃烧效率高,也便于输送 。
18、1)N2H4(l)+2H2O2(l)===N2(g)+4H2O(g);ΔH=-641.63 kJ·mol-1 (2)408.815 (3)产物不会造成环境污染(4)348 K