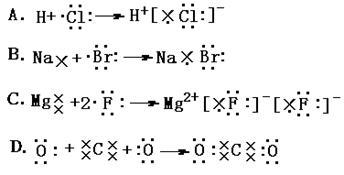第一章 物质结构 元素周期律
第三讲 化学键
复习重点:离子键、共价键的概念;离子化合物和共价化合物的概念;化学键的概念;
化学反应的实质。
复习难点:化学键的概念;化学反应的实质。
知识梳理
一、离子键
1._______________所形成的化学键叫做离子键。
成键微粒:____;相互作用:________;成键过程:________。
举例哪些物质能提供阴、阳离子:_______________、_______________、_______________。
2.电子式:_______________的式子。
原子电子式:H___ Cl___ S___ Ar___ Mg___
离子电子式:Na+__ Mg2+__OH—___NH4+__。
3.用电子式表示出离子化合物的形成过程。
用电子式表示MgO、K2S形成过程:___________、___________。
注意:
(1)首先考虑箭号左方原子的摆放,并写出它们的电子式。
(2)箭号右方写离子化合物的电子式。写时要注意二标:标正负电荷、阴离子标[]。
(3)箭号左方相同的微粒可以合并写,箭号右方相同的微粒不可以合并写。
(4)在标正负电荷时,特别要注意正负电荷总数相等。
二、共价键
1、概念:____________叫共价键。
写出![]() 的电子式和结构式。
的电子式和结构式。
___、____、____、____、____、____、____、____。
2.用电子式表示共价分子的形成过程。
用电子式表示I2、![]() 、H2O、H2S、NH3的形成过程:
、H2O、H2S、NH3的形成过程:
I2:____________;![]() :____________;H2O:____________;H2S:____________;NH3:____________。
:____________;H2O:____________;H2S:____________;NH3:____________。
3.非极性键与极性键
(1)非极性键:_____________________,存在于______。
(2)极性键:______________________,存在于______。
4.化学键:使离子相结合或原子相结合的作用。
注意:①化学键存在分子内②化学键是一种较强的相互作用
He、Ar、Ne、等稀有气体分子中是否存在化学键?______
三、共价键性的参数
(1)键长:__________________核间距离。
键长决定分子的稳定性,一般说来,键长越___,键越___,也越稳定。键长的大小与成键微粒的半径大小有关。如键和H—Cl_H—Br_H—I,则稳定性:H—Cl_H—Br_H—I。
(2)键能:拆开1 mol某键所需的能量叫键能。单位:_____。键能决定分子的稳定性,键能越_,键越_,分子越_。
(3)键角:________的夹角。
键角决定分子的空间构型,凡键角为180°的为_____,如:![]() ;凡键角为109°28′的为_____体,如:
;凡键角为109°28′的为_____体,如:![]() 。
。
四、非极性分子和极性分子
1、非极性分子:分子中电子云分布均匀,分子结构对称的分子属于非极性分子。只由________分子。如:![]() 。由________也属于非极性分子。如:
。由________也属于非极性分子。如:![]()
2、极性分子:分子中由于电子云分布不均匀而呈极性的分子。由极性键结合形成的分子,正、负电荷重心不重叠,产生正、负极,分子结构不对称,属于分子极性分子。如:HCl、![]() 。
。
3.分子间作用力:分子间作用力存在于:________之间。化学键存在于:________原子之间。氢键是一种分子间作用力,影响物质的____,如H2O由于分子间氢键的形成,分子间作用力骤然增强,从而改变了Te—S氢化物熔沸点降低的趋势而猛然升高,卤族中的HF和氮族中的NH3也有类似情况。
疑难点拨
一、怎样认识化学键的极性和分子的极性
元素形成单质或化合物时,在邻近两个或多个原子之间的,主要的、强烈的相互作用叫化学键。
一般来说,活泼金属和活泼非金属以离子键相结合。离子键没有方向性和饱和性。由离子键形成的化合物称离子化合物。在离子化合物中还可能存在共价键。
当非金属形成化合物或单质时,通常以共价键结合(除惰性气体单原子分子外)。共价键是靠共用电子对形成的化学键,具有方向性和饱和性。分子中只含有共价键的化合物称共价化合物。
在共价化合物中,不同种原子对共用电子对吸引力不同,所以共用电子对将偏向吸引电子能力强的原子一边,形成了键的极性,称极性共价键。当两种原子吸引电子能力差异越大,则形成的共价键的极性也越强。在单质或某些化合物(如H202)中,同种原子吸引电子能力相同,所以共用电子对不发生偏移,这样的共价键为非极性共价键。形成极性键时,有如下两种情况:
化学键的极性是分子极性产生的原因之一。当分子中所有化学键都是非极性键时,分子为非极性分子。当分子内的化学键为由分子中电荷的空间分布不对称,即各个键的极性无法抵消时为极性分子,由分子中电荷的空间分布对称,使各个键的极性互相抵消时,形成非极性分子。
现列举说明如下:
| 键的极性 | 代表物 | 分子空间构型对称性 | 分子的极性 |
| 非极性键 | N2、CI2、O2 | 直线型;对称 | 非极性分子 |
|
极性键 | HCI、 HBr | 直线型、不对称 | 极性分子 |
| CO2、CS2 | 直线型;对称 | 非极性分子 | |
| H2O、H2S | 折线型、不对称 | 极性分子 | |
| BF3 | 平面三角型、对称 | 非极性分子 | |
| NH3 | 三角锥型、不对称 | 极性分子 | |
| CH4、CCI4 | 正四面体;对称 | 非极性分子 |
二、离子键和共价键有何区别:
1、形成条件不同:离子键只有在易失电子的活泼金属元素(ⅠA、ⅡA)的原子与易获得电子的活泼非金属(卤素、氧、硫等)的原子间形成;共价键主要存在于同种非金属元素、不同种非金属元素或金属性较弱的金属元素与非金属性较弱的非金属元素的原子间。
2、作用方式不同:离子键是通过阴阳离子间的静电作用形成;共价键是通过共用电子对的作用形成。
3、特征不同:离子键无饱和性和方向性;共价键有方向性和饱和性。
三、氢键的形成对化合物性质的影响
分子缔合作用,是由于分子间氢键的形成,钳环化则是由于分子内氢键的形成。两者对于化合物的性质的影响是显著的,并且往往是相反的,现简述如下。
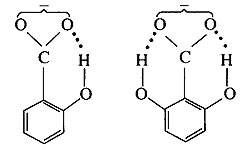
(1)对沸点和熔点的影响:分子间氢键的形成使物质的沸点和熔点升高,因为要使液体气化,必须破坏大部分分子间的氢键,这需要较多的能量;要使晶体熔化,也要破坏一部分分子间的氢键。所以,形成分子间氢键的化合物的沸点和熔点都比没有氢键的同类化合物为高。
分子内氢键的生成使物质的沸点和熔点降低,如邻位硝基苯酚的熔点为45 ℃,而间位和对位硝基苯酚的熔点分别是96 ℃和114 ℃。这是由于间位和对位硝基苯酚中存在着分子间氢键,熔化时必须破坏其中的一部分氢键,所以它们熔点较高;但邻位硝基苯酚中已经构
成内氢键,不能再构成分子间氢键了,所以熔点较低。
(2)对溶解度的影响:在极性溶剂里,如果溶质分子与溶剂分子间可以生成氢键,则溶质的溶解度增大。如果溶质分子钳环化,则在极性溶剂里的溶解度减小。例如,对硝基苯酚中O—H基,能同水的氧原子缔合成氢键,促使它在水中溶解,因此溶解度大,在水蒸气里不挥发。但邻硝基苯酚的O—H基,通过氢原子能与其邻位上硝基的氧原子钳环化,即不能再同水的氢原子形成氢键,因此溶解度减小,而且易被水蒸气蒸馏出去。邻位与对位硝基苯酚在20 ℃的水里的溶解度之比为0.39。钳环化的化合物在非极性溶剂里,其溶解度与上述情况相反。
(3)对酸性的影响:如苯甲酸的电离常数为K,则在邻位、间位、对位上带有羟基时,电离常数依次为15.9 K、1.26K和0.44 K。如左右两边邻位上各取代一羟基,则电离常数为800 K。这是由于邻位上的羟基与苯甲酸根生成带氢键的稳定的阴离子,从而增加了羧基中氢原子的电离
典例剖析
【例1】下列说法中正确的是
A、离子键是阴阳离子间存在的静电引力
B、失电子难的原子获得电子的能力一定强
C、在化学反应中,某元素由化合态态变为游离态,该元素被还原。
D、电子层结构相同的不同离子,其半径随核电荷数增多而减少。
解析:A错。静电作用包括引力和斥力两方面的作用。B:失电子难的原子,获得电子的能力不一定强,例如稀有气体,失电子难,得电子也难。C:化学反应中,元素的化合态变为游离态,可能被氧化,也可能被还原。如: CuCl2+Fe→FeCl2+Cu, 则Cu2+被还原;CuBr2+Cl2→CuCl2+Br2 则Br-被氧化D是对的,答案为D。
【例2】下列叙述正确的是
A、两种非金属原子间不可能形成离子键。B、非金属原子间不可能形成离子化合物。
C、离子化合物中可能有共价键。 D、共价化合物中可能有离子键。
解析:两种非金属原子间不能得失电子,不能形成离子键,A对,非金属原子,当组成原子团时,可以形成离子的化合物,如NH4Cl, B错;离子化合物中可以有共价键,如:NaOH中的O—H键,C对;有离子键就是离子化合物,D错。答案为A、C。
【例3】 以下叙述中错误的是
A. 钠原子与氯气反应生成食盐后,其结构的稳定性增强
B. 在氧化钠中,除氧离子和钠离子的静电吸引作用外,还存在电子与电子,原子核与原子核之间的排斥作用
C. 任何离子键在形成过程中必定有电子的得与失
D. 钠与氧气反应生成氧化钠后,体系的能量降低
解析:钠原子最外层只有一个电子,当它失去1个电子后可以形成8个电子的稳定结构使体系的能量降低,所以A、D项均正确;在离子化合物中除阴阳离子电荷之间的静电引力外,还存在电子与电子,原子核与原子核之间的排斥作用,所以B项正确;一般说来形成离子键有电子的得失,但也有例外如铵盐的形成。答案:C。
【例4】有A、B、C、D四种元素。已知:A的最高正价与其最低负价的代数和为6,A、D次外层电子都是8个,A和D的化合物DA在水溶液中能电离出具有相同电子层结构的阴,阳离子,B有两个电子层,其最高正价与最低负价的代数和为零;C2-离子与氪原子具有相同的电子层结构。试写出:
(1)上述各元素的符号:A_____B_____C_____D_____。
(2)DA的电子式为________。
解析:最高正价与负价代数和为6的元素位于第ⅦA族(+7,-1)。最高正价与负价代数和为4的元素位于第ⅥA族(+6,-2)。第ⅤA族的最高正价与负价的代数和为2(+5,-3)。第ⅣA族元素的最高正价与负价的代数和为零(+4,-4)。所以A位于ⅦA,B位于ⅣA,B有两个电子层,B为碳元素。C2-离子与氪原子具有相同的电子层结构,所以C为ⅥA族并位于第四周期,即为Se元素。A和D的化合物DA在水溶液中能电离出具有相同电子层结构的阴、阳离子,且A、D次外层都有8个电子,所以A为氯元素,D为钾元素。答案:(1)Cl、C、Se、K。
知能训练
一、选择题
1、下列物质中属于含有极性共价键的离子化合物的是
A、过氧化钠 B、碘化氢 C、苛性钠 D、氯化钾
2、下列分子中所有原子最外层都满足8电子结构的是
A、次氯酸(HClO) B、CF2Cl2 C、三氟化硼(BF3) D、白磷(P4)
3、下列各项表达正确的是
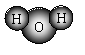 A.H2O的分子模型示意图:
B.F—的结构示意图:
A.H2O的分子模型示意图:
B.F—的结构示意图:
C.乙烯分子的结构简式:CH2CH2
D.CaCl2的电子式:![]()
4、关于氢键,下列说法正确的是
A、氢键比范德华力强,所以它属于化学键
B、分子间形成的氢键使物质的熔点和沸点升高
C、由于NH3和H2O之间可形成分子间氢键,使氨在水中溶解度增大
D、H2O是一种稳定的化合物,这是由于H2O之间形成氢键所致
5、在下列有关晶体的叙述中错误的是
A.离子晶体中,一定存在离子键 B.原子晶体中,只存在共价键
C.金属晶体的熔、沸点的均很高 D.稀有气体的原子能形成分子晶体
|
7.下列事实中,能够证明HCl是共价化合物的是:
A.HCl易溶于水; B.液态的HCl不导电;
C.HCl不易分解; D.HCl溶于水能电离,呈酸性。
8.下列性质中,可以证明某化合物中一定存在离子键的是
A.可溶于水 B.具有较高的熔点
C.水溶液能导电 D.熔融状态能导电
9. 下列变化过程中,共价键被破坏的是
A. 烧碱固体溶于水 B. 氯化氢气体溶于水
C. 二氧化碳变成干冰 D. 碘溶于酒精
10、下列化合物中所有化学键都是共价键的是:
A.Na2O2; B.NaOH; C.BaCl2; D.H2SO4。
11.下列分子中,属于含有极性键的非极性分子是
A.H2O; B.Cl2; C.CCl4; D.CO2
11、下列叙述中正确的是
A.在极性分子中不可能存在非极性键; B.在离子晶体中不可能存在极性键
C.在原子晶体中不可能存在离子键;
D.含有共价键的晶体有的属于分子晶体,有的属于原子晶体,还有的属于离子晶体
12、下列各组顺序的排列不正确的是
A.离子半径:Na+>Mg2+>Al3+>F —; B.热稳定性:HCl>H2S>PH3>AsH3
C.酸性强弱:H3AlO3<H2SiO4<H2CO3<H3PO4; D.溶点:NaCl>SiO2>H2O>CO2
13、根据水是极性分子组成的溶剂,试判断下列物质不易溶于水的是: ( )
A、HF B、CH4 C、NaCl D、KBr
14.离子化合的熔点与离子的半径、离子所带的电荷有关,离子的半径越小,离子所带的电荷越高,则离子化合物的熔点就高。NaF、NaI、MgO均为离子化合物,现有下列数据,试判断这三种化合物的熔点高低顺序:
| 物 质 | ① | ② | ③ |
| 离子电荷数 | 1 | 1 | 2 |
| 键长(10-10m) | 2.31 | 3.18 | 2.10 |
A.①>②>③; B.③>①>②; C.③>②>①; D.②>①>③。
15. X、Y都是短周期元素,X原子最外层只有一个电子,Y元素的最高正价与最低负价的代数和为6,X和Y两元素形成的化合物为R,则下列关于R的叙述正确的是
A、R 一定是共价化合物 B、R一定是离子化合物
C、R可能是共价化合物,也可能是离子化合物
D、R可能是气态物质,也可能是固态物质
二、填空题
16、影响分子间作用力的因素很多,例如,组成和结构相似的物质,分子量越大,分子
间的作用力也越大,试根据这一规律判断卤素沸点由高到低的排列顺序是 ;CF4、CCl4、CBr4、CI4中熔点最高的是 ,熔点最低的是 。
17.W、X、Y、Z为短周期内除稀有气体外的4种元素,它们的原子序数依次增大,其中只有Y为金属元素。Y和W的最外层电子数相等。Y、Z两元素原子的质子数之和为W、X两元素质子数之和的3倍。由此可知:⑴写出元素符号:W为_____,X为____,Y为_____,Z为____。
⑵W2Z是由________键组成的分子,其电子式为___________。
⑶由Y、X、W组成的化合物中有____________键和__________键组成的__________化合物。
⑷Z的最高价与X形成的化合物属于_____性分子(填极性或非极性,下同),W2Z属于_____分子。
(5)由W 、X、Y、Z四种元素组成的化合物的化学式 , ;写出这两种物质之间反应的离子方程式
18. 1919年,Langmuir提出等电子原理:原子数相同、电子总数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近。
(1)根据上述原理,仅由第2周期元素组成的共价分子中,互为等电子体的是:
和 。
(2)此后,等电子原理又有所发展。例如,由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与 NO2-互为等电子体的分子有: 、 。
19、通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可
以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
| 键能/ KJ·mol—1 | 460 | 360 | 436 | 431 | 176 | 347 |
 请回答下列问题:
请回答下列问题:
⑴ 比较下列两组物质的熔点高低 (填>或<)
SiC______ Si; SiCl4 ______ SiO2
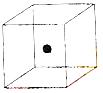
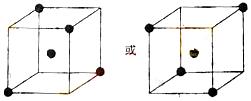
⑵ 右图立方体中心的“●”表示硅晶体中的一个原子,
请在立方体的顶点用“●”表示出与之紧邻的硅原子。
⑶ 工业上高纯硅可通过下列反应制取:
SiCl4
(g) + 2H2(g) ![]() Si(s) +
4HCl(g)
Si(s) +
4HCl(g)
该反应的反应热△H = ___________ KJ/mol
参考答案:
1、C 2、BD 3、A 4、B 5、C 6、D 7、B 8、D 9、B 10、B 11、CD 12、AD 13、B 14、B 15、CD
16、 I2>Br2>Cl2>F2 CI4 CF4
17.(1)H O Na S(2)共价 ![]() (3)离子 共价 离子(4)非极 极性(5)NaHSO4 NaHSO3 H++HSO3_ =SO2↑+H2O
(3)离子 共价 离子(4)非极 极性(5)NaHSO4 NaHSO3 H++HSO3_ =SO2↑+H2O
18.(1)N2 CO (2) SO2 O3
19.
(1)> <
(2)如图所示
(3)+236