历届全国高考题电解质溶液专项试题荟萃
[90全国]
1.下列说法正确的是
(A)酸式盐的溶液一定显碱性
(B)只要酸与碱的摩尔浓度和体积分别相等,它们反应后的溶液就呈中性
(C)纯水呈中性是因为水中氢离子摩尔浓度和氢氧根离子摩尔浓度相等
(D)碳酸溶液中氢离子摩尔浓度是碳酸根离子摩尔浓度的二倍
2.把0.05摩NaOH固体分别加入下列100毫升液体中,溶液的导电能力变化不大的是:
(A)自来水 (B)0.5摩/升盐酸
(C)0.5摩/升醋酸 (D)0.5摩/升氯化铵溶液
3.把80毫升NaOH溶液加入到120毫升盐酸中,所得溶液的pH值为2.如果混和前NaOH溶液和盐酸的摩尔浓度相同,它们的浓度是
(A)0.5摩/升 (B)0.1摩/升 (C)0.05摩/升 (D)1摩/升
[91全国]
4. 已知一种[H+]=1×10-3摩/升的酸和一种[OH-]=1×10-3摩/升的碱溶液等体积混和后溶液呈酸性.其原因可能是
(A)浓的强酸和稀的强碱溶液反应 (B)浓的弱酸和稀的强碱溶液反应
(C)等浓度的强酸和弱碱溶液反应 (D)生成了一种强酸弱碱盐
5.将0.2摩/升CH3COOK与0.1摩/升盐酸等体积混和后,溶液中下列微粒的摩尔浓度的关系正确的是
(A)[CH3COO-]=[Cl-]=[H+]>[CH3COOH] (B)[CH3COO-]=[Cl-]>[CH3COOH]>[H+]
(C)[CH3COO-]>[Cl-]>[H+]>[CH3COOH] (D)[CH3COO-]>[Cl-]>[CH3COOH]>[H+]
6.在80℃时,纯水的pH值小于7,为什么?
[92全国]
7.用pH试纸测定某无色溶液的pH值时,规范的操作是
(A)将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较
(B)将溶液倒在pH试纸上,跟标准比色卡比较
(C)用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较
(D)在试管内放入少量溶液,煮沸,把pH试纸放在管口,观察颜色,跟标准比色卡比较
8.若某溶液跟甲基橙作用呈红色,则下列离子在该溶液中浓度不可能很大的是
(A)SO42- (B)S2- (C)CO32- (D)Cl-
9.等体积混和0.10摩/升盐酸和0.06摩/升Ba(OH)2溶液后,溶液的pH值等于
(A)2.0 (B)12.3 (C)1.7 (D)12.0
[93全国]
10.摩尔浓度相同的三种盐NaX、NaY和NaZ的溶液,其中pH值依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是 [ ]
(A)HX、HZ、HY (B)HZ、HY、HX
(C)HX、HY、HZ (D)HY、HZ、HX
11.在1升浓度为c摩/升的弱酸HA溶液中,HA、H+和A-的物质的量之和为nc摩,则HA的电离度是 [ ]
![]()
[94全国]
12.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的 [ ].
(A)NaOH(固体) (B)H2O (C)NH4Cl(固体) (D)CH3COONa(固体)
13.在氯化铵溶液中,下列关系式正确的是 [ ].
(A)[Cl-]>[NH4+]>[H+]>[OH-] (B)[NH4+]>[Cl-]>[H+]>[OH-]
(C)[Cl-]= [NH4+]> [H+]=[OH-] (D)[NH4+]= [Cl-]> [H+]>[OH-]
[95全国]
14.100毫升0.1摩/升醋酸与50毫升0.2摩/升氢氧化钠溶液混和,在所得溶液中( )
A.[Na+]>[CH3COO-]>[OH-]>[H+] B.[Na+]>[CH3COO-]>[H+]>[OH-]
C.[Na+]>[CH3COO-]>[H+]=[OH-] D.[Na+]=[CH3COO-]>[OH-]>[H+]
15.100毫升6摩/升H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应进行的速度,但又不影响生成氢气的总量.可向反应物中加入适量的( )
A.碳酸钠(固体) B.水 C.硫酸钾溶液 D.硫酸铵(固体)
16.甲酸的下列性质中,可以证明它是弱电解质的是( )
A.1摩/升甲酸溶液的pH值约为2
B.甲酸能与水以任何比例互溶
C.10毫升1摩/升甲酸恰好与10毫升1摩/升NaOH溶液完全反应
D.在相同条件下,甲酸溶液的导电性比强酸溶液的弱
17.下列物质能跟镁反应并生成氢气的是( )
A.甲酸溶液 B.氢氧化钠溶液 C.氯化铵溶液 D.碳酸钠溶液
18.C1、C2、α1、α2,pH1,pH2分别表示2种一元弱酸的摩尔浓度、电离度和溶液的pH值如果已知pH1<pH2,且α1>α2,则C1和C2的关系( )
A.C1>C2 B.C1=C2 C.C1<C2 D.无法确定
[96全国]
19.相同温度下的0.1摩/升和0.01摩/升CH3COOH溶液中,CH3COOH的电离度( ).
(A)大于 (B)小于 (C)等于 (D)不能肯定
20.把三氯化铁溶液蒸干灼烧,最后得到的固体产物是( ).
(A)无水三氯化铁 (B)氢氧化铁 (C)氧化亚铁 (D)三氧化二铁
21.把氢氧化钙放入蒸馏水中,一定时间后达到如下平衡:
Ca(OH)2(固) ![]() Ca2++2OH-。加入以下溶液,可使Ca(OH)2减少的是( )
Ca2++2OH-。加入以下溶液,可使Ca(OH)2减少的是( )
(A)Na2S溶液 (B)AlCl3溶液 (C)NaOH溶液 (D)CaCl2溶液
22.将pH=3的盐酸溶液和pH=11的氨水等体积混和后,溶液中离子浓度关系正确的是( ).
(A)[NH4+]>[Cl-]>[H+]>[OH-] (B)[NH4+]>[Cl-]>[OH-]>[H+]
(C)[Cl-]>[NH4+]>[H+]>[OH-] (D)[Cl-]>[NH4+]>[OH-]>[H+]
[97全国]
23.0.1 mol·L-1NaOH和0.1 mol·L-1NH4Cl溶液等体积混合后,离子浓度大小正确的次序是
(A)[Na+]>[Cl-]>[OH-]>[H+] (B)[Na+]=[Cl-]>[OH-]>[H+]
(C)[Na+]=[Cl-]>[H+]>[OH-] (D)[Cl-]>[Na+]>[OH-]>[H+
24.将0.1 mol下列物质置于1 L水中充分搅拌后,溶液中阴离子数最多的是
(A)KCl (B)Mg(OH)2 (C)Na2CO3 (D)MgSO4
25.在室温下等体积的酸和碱的溶液,混合后pH值一定小于7的是
(A)pH=3的硝酸跟pH=11的氢氧化钾溶液 (B)pH=3的盐酸跟pH=11的氨水
(C)pH=3的硫酸跟pH=11的氢氧化钠溶液 (D)pH=3的醋酸跟pH=11的氢氧化钡溶液
26.若室温时pH=a的氨水与pH=b的盐酸等体积混合,恰好完全反应,则该氨水的电离度可表示为
(A)10(a+b-12)% (B)10(a+b-14)% (C)10(12-a-b)% (D)10(14-a-b)%
[98全国]
27、用水稀释0.1摩/升氨水时,溶液中随着水量的增加而减小的是
A、![]() B、
B、![]()
C、[H+]和[OH-]的乘积 D、OH-的物质的量
28、等体积等浓度的MOH强碱溶液和HA弱酸溶液混和后,混和液中有关离子的浓度应满足的关系是
A、[M+]>[OH-]>[A-]>[H+] B、[M+]>[A-]>[H+]>[OH-]
C、[M+]>[A-]>[OH-]>[H+] D、[M+]>[H+]
=[OH-]+[A-]
29、PH=13的强碱溶液与PH=2的强酸溶液混和,所得混和液的PH值=11,则强酸与强碱的体积比是
A、11:1 B、9:1 C、1:11 D、1:9
[99全国]
30.用0.1mol.L-1
NaOH溶液滴定0.lmol.L-1盐酸,如达到滴定的终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05mL).继续加水至50mL,所得溶液的pH是
A.4 B.7.2 C.10 D.11.3
31 某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:
H2A![]() H++HA- HA-
H++HA- HA-![]() H++A2-
H++A2-
已知相同浓度时的电离度a(H2A)>d(HA-),设有下列四种溶液:
A.0.01mol.L-1的H2A溶液
B.0.01mol.L-1的NaHA溶液
C.0.01mol.L-1的HCl与0.04mol.L-1的NaHA溶液等体积混合液
D.0.02mol.L-1的NaOH与0.02 mol.L-1的NaHA溶液等体积混合液
据此,填写下列空白(填代号)
(1) [H+]最大的是___________________,最小的是___________________。
(2)[H2A]最大的是__________________,最小的是___________________。
(3)[A2-]最大的是__________________, 最小的是___________________。
[2000广东]
32.室温时,若0.1 mol·L-1的一元弱碱的电离度为1%,则下列说法正确的是
A. 该溶液的pH=11
B. 该溶液的pH=3
C. 加入等体积0.1 mol·L-1 HCl后所得溶液的pH=7
D.加入等体积0.1 mol·L-1 HCl后所得溶液的pH>7
33.用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是
A.加热 B.不用稀硫酸,改用98%浓硫酸
C.滴加少量CuSO4溶液 D.不用铁片,改用铁粉
34.在甲酸溶液中加入一定量NaOH溶液,恰好完全反应,对于生成的溶液,下列判断一定正确的是
A.[HCOO-]<[Na+] B.[HCOO-]>[Na+]
C.[OH-]>[HCOO-] D.[OH-]<[HCOO-]
[2000全国]
35.室温下,在pH=12的某溶液中,由水电离的[OH-]为
A. 1.0×10-7mol·L-1 B.1.0×10-6mol·L-1 C.1.0×10-2mol·L-1 D.1.0×10-12mol·L-1
36.)25℃时,若体积为Va、pH=a的某一元强酸与体积Vb、pH=b的某一元强碱混合,恰好中和,且已知Va<Vb和a=0.5b,请填写下列空白;
(1)a值可否等于3(填“可”或“否”)_________,其理由是____________________________________________;
(2)a值可否等于5(填“可”或“否”)________,其理由是_____________________________________________;
(3)a的取值范围是_______________________________________。
[2000上海]
37.等物质的量浓度的下列溶液中,N![]() 离子的浓度最大的是
离子的浓度最大的是
A.NH4Cl B.NH4HCO3 C.NH4HSO4 D.NH4NO3
38.取pH值均等于2的盐酸和醒酸各100ml分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,有关叙述正确的是
A .醋酸与锌反应放出氢气多
B.盐酸和醋酸分别与锌反应放出的氢气一样多
C.醋酸与锌反应速率大
D.盐酸和醋分别与锌反应的速度一样大
[2001春招]
39.在 0.1 mol/L Na2CO3溶液中,下列关系正确的是
A.c(Na+) = 2c(CO32-) B.c(OH-) = 2c(H+)
C.c(HCO3-) > c(H2CO3) D.c(Na+) <〔c(CO32-)+c(HCO3-) 〕
[2001上海]
40.将0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10rnL混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是
A c (Ac-)>c (Cl-)>c (H+)>c (HAc)
B c (Ac-)>c (Cl-)>c (HAc)>c(H+)
C c (Ac-)=c (Cl+)>c (H+)>c (HAc)
D c (Na+)+c (H+)=c (Ac-)+c (Cl-)+c (OH-)
41.为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG=![]() ,则下列叙述正确的是
,则下列叙述正确的是
A 中性溶液的AG=0 C 常温下0.lmol/L氢氧化钠溶液的AG=12
B 酸性溶液的AG<0 D 常温下0.lmol/L盐酸溶液的AG=12
42.用实验确定某酸HA是弱电解质。两同学的方案是:
甲:① 称取一定质量的HA配制0.lmol/L的溶液100mL;
② 用pH试纸测出该溶液的pH值,即可证明HA是弱电解质。
乙: ① 用已知物质的量浓度的HA溶液、盐酸,分别配制pH=l的两种酸溶液各100mL;
② 分别取这两种溶液各10mL,加水稀释为100mL;
③ 各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现 象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH 1(选填>、<、=)
乙方案中,说明HA是弱电解质的现象是 (多选扣分)
(a)装HCl溶液的试管中放出H2的速率快;
(b)装HA溶液的试管中放出H2的速率快;
(c)两个试管中产生气体速率一样快。
(3)请你评价:乙方案中难以实现之处和不妥之处
、
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
[2001广东]
43.将0.1mol·L-1CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起
A 溶液的pH增加 B CH3COOH电离度变大
C 溶液的导电能力减弱 D 溶液中[OH-]减少
44.若pH=3的酸溶液和pH=11的碱溶液等体积混合后 溶液呈酸性,其原因可能是
A 生成了一种强酸弱碱盐 B 弱酸溶液和强碱溶液反应
C 强酸溶液和弱碱溶液反应 D 一元强酸溶液和一元强碱溶液反应
45.(5分)用pH试纸测定溶液的pH,正确操作是:
。
[2002上海]
46.在常温下10mL pH=10的KOH溶液中,加人pH=4的一元酸HA溶液至pH刚好等于7(假设反应前后体积不变),则对反应后溶液的叙述正确的是
A c(A-)=c(K+) B c(H+)=c(OH-)<c(K+)<c(A-)
C V总≥20mL D V总≤20mL
[2002全国广东]
47.室温时,0.01 mol·L-1某一元弱酸的电离度为1%,则下列说法正确的是
A 上述弱酸溶液的pH=4
B 加入等体积0.01 mol·L-1 NaOH溶液后,所得溶液的pH=7
C 加入等体积0.01 mol·L-1 NaOH溶液后,所得溶液的pH>7
D 加入等体积0.01 mol·L-1 NaOH溶液后,所得溶液的pH<7
[2003上海]
48.相同温度下等物质的量浓度的下列溶液中,pH值最小的是
A NH4Cl B NH4HCO3 C NH4HSO4 D (NH4)2SO4
49.在10mL0.1mol·L-NaOH溶液中加入同体积、同浓度的HAc溶液,反应后溶液中各微粒的浓度关系错误的是
A C(Na+)>C(Ac-)>C(H+)>C(OH-)
B C(Na+)>C(Ac-)>C(OH-)>C(H+)
C C(Na+)=C(Ac-)+C(HAc)
D C(Na+)+C(H+)=C(Ac-)+C(OH-)
[2003江苏 广东]
50.将0.2mol·L-1HCN溶液和0.1mol·L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是
A c(HCN)<c(CN-) B c(Na+)>c(CN-)
C c(HCN)-c(CN-)=c(OH-) D c(HCN)+c(CN-)=0.1mol·L-1
[2004江苏]
51.用pH均为2的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗盐酸和醋酸溶液的体积分别为Vl和V2,则Vl和V2的关系正确的是
A V1>V2 B V1<V2 C V1=V2 D V1≤V2
52.草酸是二元弱酸,草酸氧钾溶液呈酸性。在O.1mol·L-1 KHC2O4溶液中,下列关系正确的是
A c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-)
B c(HC2O4-)+c(C2O42-)=0.1mol·L-1
C c(C2O42-)>c(H2C2O4)
D c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)
[2004广东]
53.甲酸和乙酸都是弱酸,当它们的浓度均为0.10mol·L-1时,甲酸中的c(H+)约为乙酸中c(H+)的3倍。现有两种浓度不等的甲酸溶液a和b,以及0.10mol·L-1的乙酸,经测定它们的pH从大到小依次为a、乙酸、b。由此可知
A a的浓度必小于乙酸的浓度 B a的浓度必大于乙酸的浓度
C b的浓度必小于乙酸的浓度 D b的浓度必大于乙酸的浓度
[2004上海]
54.将标准状况下的2.24L CO2通入150mL 1mol/L NaOH溶液中,下列说法正确的是
A.c(HCO-3)略大于c(CO23) B.c(HCO-3) 等于c(CO23)
C.c(Na+)等于c(CO2-3)与c(HCO-3) D.c(HCO-3)略小于c(CO2-3)
55.常温时,向pH=2的硫酸中加入等体积的下列溶液后,滴入甲基橙试液,出现红色,该溶液可能是
A.pH=12的Ba(OH)2 C.pH=12的氨水
C.0.005mol/L NaOH D.0.05mol/L BaCl2
[2005上海]
56. 叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是( )
A、HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(H+)>c(N3¯)>c(OH¯)
B、HN3与NH3作用生成的叠氮酸铵是共价化合物
C、NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3¯) >c(OH¯)>c(H+)
D、N3¯与CO2含相等电子数
[2005江苏]
57.在一定体积pH = 12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH = 11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是
A.1∶9 B.1∶1 C.1∶2 D.1∶4
58.常温下将稀NaOH溶液与稀CH3COOH溶液混合,不可能出现的结果是
A.pH > 7,且c(OH—) > c(Na+) > c(H+) > c(CH3COO—)
B.pH > 7,且c(Na+) + c(H+) = c(OH—) + c(CH3COO—)
C.pH < 7,且c(CH3COO—) >c(H+) > c(Na+) > c(OH—)
D.pH = 7,且c(CH3COO—) > c(Na+) > c(H+) = c(OH—)
[2005广东]
59.关于小苏打水溶液的表述正确的是
A、c (Na+)=c (HCO3-) + c (CO32-) + c (H2CO3)
B、c (Na+) + c (H+) = c (HCO3-) + c (CO32-) +c (OH-)
C、HCO3- 的电离程度大于HCO3-的水解程度
D、存在的电离有:NaHCO3 = Na+ + HCO3-, HCO3- = H+ + CO32-
H2O = H++OH-
[2001安徽竞赛]
60.在25℃时,纯水的电离度为α1,pH=3的醋酸中水的电离度为α2,pH=11的氢氧化钠溶液中水的电离度为α3。若将上述醋酸溶液和氢氧化钠溶液等体积混合,所得溶液中水的电离度为α4,则下列关系正确的是
A α1<α3<α2<α4 B α3<α2<α1<α4
C α2=α3<α1<α4 D α2=α3<α4<α1
61.在相同温度下,等体积、等物质的量浓度的下列溶液①Na2SO4、②H2SO3、③NaHSO3、④Na2S中,所含带电微粒数由多到少的顺序为
A ④>①>③>② B ①>④>③>②
C ①=④>②=③ D ④=①>③>②
62.在0.100mol/L Na(NH4)2PO4溶液中,正确的关系式为
A [Na+]+[NH4+]+[NH3]=[H3PO4]+[H2PO4-]+[HPO42-]+[PO43-]
B [H+]+[Na+]+[NH4+]=[OH-]+[H2PO4-]+[HPO42-]+[PO43-]
C [H+]+3[H3PO4]+2[H2PO4-]+[HPO42-]=[OH-]+[NH3]
D [H3PO4]+[H2PO4-]+2[HPO42-]+3[PO43-]=0.100mol/L
63.将硫酸钾、硫酸铬(Ⅲ)和铬矾三种盐溶液于硫酸酸化的水中,测得[K+]=0.025mol/L,[Cr3+]=0.015mol/L,溶液的pH=1。假设溶液中硫酸完全电离成H+离子和SO42-离子,则[SO42-]为
A 0.035mol/L B 0.070mol/L C 0.085mol/L D 0.140mol/L
[2003安徽竞赛]
64.对于Na(NH4)2PO4溶液而言,下列等式成立的是
A. [H+]+[Na+]+[ NH4+]=[OH-]+[PO43-]
B. [H+]+[Na+]+[ NH4+]=[OH-] + [H2PO4-]+[HPO42-]+[PO43-]
C. [H+]+[Na+]+[ NH4+]=[OH-] + [H2PO4-]+2[HPO42-]+3[PO43-]
D. [H+]+[Na+]+2[ NH4+]=[OH-] + [H2PO4-]+2[HPO42-]+3[PO43-]
[2001北京竞赛]
65.NaCl溶液中可能混有杂质NaOH、NaHCO3、Na2CO3中的一种或二种,为测定溶液中混有的杂质成分,可进行如下实验操作:分别取二份等体积混合液,用盐酸的标准液(0.10mol·L-1)滴定,以酚酞或甲基橙为指示剂,达到终点时消耗盐酸的体积分别为V1和V2,且V2>V1。则NaCl溶液中混有的杂质可能为
A NaOH B Na2CO3 C Na2CO3、NaHCO3 D NaOH、Na2CO3
[2004东华]
66.四种水溶液:①HCL, ②FeCl3,③Ba(OH)2,④Na2CO 3测得它们的pH依次为3,4,12,8,而溶液中水的电离度依次为α1、α2、α3、α4,则它们的关系正确的是( )
A. α1>α2>α3>α4 B. α1<α2<α3<α4
C. α2>α4>α1>α3 D. α3>α4>α1>α2
67. 有物质的量浓度、体积都相同的NaF溶液和NaCN溶液。已知HF比HCN较易电离。以下说法中正确的是( )
A. c(Na+) + c(H+) = c (F-) + c(OH-) B. 两溶液中的c(Na+) 、c(H+)分别相等
C. c(Na+) = c (CN-) + c(HCN-) D. NaF溶液中的离子总数较少
[1999河南竞赛]
68.用一定浓度的NaOH标准溶液分别中和相同体积和相同pH值的两种酸溶液:一元强酸HA1、一元弱酸HA2(电离度为2%)。则中和HA1和HA2所需NaOH溶液的体积比是
A 50︰1 B 1︰1 C 1︰5 D 1︰50
[2001-2002湖北竞赛]
69.浓度为c mol/L的 NH4Cl稀溶液中,由于NH4+水解,[NH4+]实际浓度略小于c。已知溶液中[NH4+]、[NH3·H2O]、[OH-]三者间存在如下关系:[NH4+][OH-]=K[NH3·H2O],K在温度恒定时是一个常数。
请用c、[H+]及K表示溶液中平衡[NH4+]
A ![]() B
B ![]() C
C 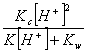 D
D ![]()
70.某二元弱酸(H2A)溶液按下式发生一级和二级电离:
H2A![]() H++HA- HA—
H++HA- HA—![]() H++A2- ,
H++A2- ,
己知相同浓度时的电离度a(H2A)>a(HA-),则[H2A]浓度最大的是
A 0.01mol/L的H2A溶液 B 0.01mol/L的NaHA溶液 C 0.02mol/L的HCl溶液与0.04mol/L的NaHA溶液等体积混合D 0.02mol/L的NaOH溶液与0.02mol/L的NaHA溶液等体积混合
[2003-2004湖南]
71.在pH值为4的FeCl3溶液、pH值为10的Na2CO3溶液和pH值为2的盐酸溶液中,水的电离度分别为α1、α2和α3,则它们的关系为
A α1=α2>α3 B α1<α2<α3 C α1>α2>α3 D 无法判断
72.将相同物质的量浓度的某弱酸(A为弱酸根)溶液与KA溶液等体积混匀,测得混合后溶液pH=10,则下列关系正确的是
A [K+]<[A-] B [A-]>[HA]
C [K+]>[A-] D [HA]+[H+]=[K+]+ [OH]
73.用0.01mol/L H2SO4滴定0.01mol/L NaOH溶液,中和后加水至100mL。若滴定终点判断有误差:①多加了1滴H2SO4;②少加入了1滴H2SO4(1滴溶液的体积约为0.05mL),则①和②两种情况下溶液中[H+]之比的值是 ( )
A 10 B 50 C 5×103 D 104
74.常温下,测得0.100mol/L。的某一元酸(HA)的pH不等于1,0.100mol/L。的某一元碱(BOH)溶液中
![]() 将该两种溶液等体积混合,所得溶液中离子浓度关系正确的是 ( )
将该两种溶液等体积混合,所得溶液中离子浓度关系正确的是 ( )
A.C(A— )>C(B+)>C(H+)>C(OH— ) B.C(B+) > C(A— ) > C(OH— ) > C(H+)
C.C(B+)>C(A—)> C(H+) > C(OH— ) D.C(A— ) > C(B+)> C(H+)=C(OH— )
[2005江苏]
75.经测定某溶液中离子只有Na+、Ac-、H+、OH―四种,且离子浓度大小的排列顺序为:c(Ac-)>c(Na+)>c(H+)>c(OH―)。其可能的情形是( )
A.该溶液由pH=3的HAc与pH=11的NaOH溶液等体积混合而成
B.0.2mol/L的HAc溶液与0.1mol/L的NaOH溶液等体积混合
C.在上述溶液中加入适量NaOH,可能使溶液中离子浓度大小改变为:
c(Ac-)>c(Na+) >c(OH―) >c(H+)
D.该溶液由0.1mol/L的HAc溶液与等物质的量浓度等体积的NaOH溶液混合而成
[浙江竞赛]
76.下列各溶液中,微粒的物质的量浓度关系正确的是( )
(A)0.1mol L-1的(NH4)2SO4溶液中,c(SO42- )>c(NH4+ )>c(H+)>c(OH-)
(B)0.2m01 L-1的Na2CO3溶液中,c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
(C)0.1mol L-1的NH4Cl溶液与0.05mol L-l的NaOH溶液等体积混合,c(Cl- ) >c(Na+ ) >c(NH4+ ) >c(OH- ) >c(H+)
(D)c(NH4+)相等的(NH4)2SO4溶液,(NH4)2CO3溶液和NH4C1溶液,
c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4C1)
77.25℃时,某一元强碱溶液的pH为a,某一元酸HA溶液的pH为b,HA的电离度为1.0%。若将1体积的此强碱溶液与10体积的HA溶液混合,恰好完全反应,则a与b之和为
A、14 B、15 C、16 D、17
78.100mL 0.1mol/L的盐酸与50mL 0.2mol/L的氨水混合,所得溶液的下列关系式正确的是
A.[Cl-]>[NH4+]>[OH-]> [H+] B. [Cl-]=[NH4+]>[OH-]=[H+]
C. [H+]+[Cl-]= [NH4+]+2[NH3·H2O]+ [OH-] D. [H+]+[NH4+]=[Cl-]
79.在0.1摩/升的 Na2S溶液中,下列关系式正确的有
A.[Na+]>2[S2-]>2[HS-]>2[OH-] B.[OH-]=[H+]+[HS-]+2[H2S]
C.[S2-]+[HS-]+[H2S]=0.1摩/升 D.[H+]+[Na+]=[OH-]+[HS-]+[S2-]
80.有一混和液可能由NaOH、NaHCO3、Na2CO3中的一种或两种组成.现取等 体积的两份上述溶液分别以酚酞和甲基橙为指示剂,用同样浓度的盐酸进行滴定,当达到定终点时,消耗盐酸的体积分别为V1mL和V2mL,如,V1<V2<2V1,则上述溶液中的溶质是
A.NaHCO3 B.Na2CO3 C.NaHCO3、Na2CO3 D.Na2CO3、NaOH
答案:
1C. 2B.3C.4B.5D.
6简答如下:
前提:(1)在25℃,水电离的[H+]=1.0×10-7mol/l,PH=7,(2)水的电离是个吸热过程。;
理由:当温度升高到80℃,化学平衡朝电离的方向移动,氢离子浓度增加。
结论:所以,在80℃,水的PH小于7。
7C.8BC.9D.10C.11C.12BD.13A.14B.15B.16AD.17AC.18D.19B.20D.21B.22B.23B.24C.25D.26A.27B.28C.29B.30C.31(1)A,D(2)C,D(3)D,A.32A.33B.34AD.35CD.
36.解答:
(1)采取逆向思维
前提:在25℃时,碱的PH>7.
理由:假设当a=3,则b=6,与题意b>7矛盾.
结论:所以a不可能等于3.
(2)![]()
(2)否,若a=5,[H+]a=10-5mol·L-1,则b=10,[OH-]b
= 10-4mol·L‑1 ,![]() ,不符合题意,故a≠5 (2分)
,不符合题意,故a≠5 (2分)
(3)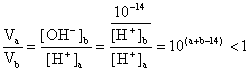
所以(a+b-14)<0,而a=0.5b即3a<14,a<![]() 又pH=b=3a>7,a>
又pH=b=3a>7,a>![]()
所以![]() <a<
<a<![]() (4分)
(4分)
37C.38BC.39C.40BD.41AD.
42
(1)100mL容量瓶(2)>b (3)配制pH=l的HA溶液难以实现
不妥之处在于加入的锌粒难以做到表面积相同
(4)配制NaA溶液,测其pH值>7即证明HA是弱电解质
43AD.44B.
45.答题要点:把小块pH试纸放在表面皿(或玻璃片)上,用醮有待测溶液的玻璃棒点在试纸 的中部,试纸变色后,与标准比色卡比较来确定溶液的pH。
46AD.47AC.48C.49BD.50BD.51A.52CD.53A.54A.55CD.56B.57D.58AD.59AD.60D.61A.62C.63C.64C.65C.66C.67AC.68D.69A.70A.71A.72CD.73D.74B.75AB.76BD.77C.78C.79BC.80D.
