2006届梅州市四校联考高三化学试题
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分.共150分,考试时间120分钟.
相对原子质量:H—1 C—12 N—14 O—16 Mg—24 Si—28 P—31 S—32
Cl—35.5 Fe—56 Cu—64 Ag—108 Ba—137
第一部分选择题(共76分)
![]() 一、选择题(本题包括9小题,每小题4分,共36分。每小题只有一个选项符合题意。)
一、选择题(本题包括9小题,每小题4分,共36分。每小题只有一个选项符合题意。)
1.据报道,科学家已成功合成了少量O4( ),有关O4的说法正确的是
A.O4与O3、O2是同素异形体 B.O4比O2稳定
C.相同质量的O4与O3所含原子个数比为4:3 D.O4的摩尔质量是64g
2.粗碘中通常含ICl和IBr,称为卤素互化物,其性质和卤素相似,都是较强的氧化剂,而且受热时ICl和IBr皆可象I2一样升华。在粗碘中加入下选项中一种物质后,再进行升华可制得精碘,应加入的物质是
 A.H2O B.Zn
C.KI
D. KCl
A.H2O B.Zn
C.KI
D. KCl
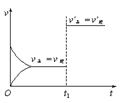
3.对可逆反应:A(g) + B(s) ![]() C(s) + D(g); ΔH>0
C(s) + D(g); ΔH>0
下图所示为正逆反应速率(v)与时间(t)关系的示意 图,如果在t1时刻改变以下条件:①加入A;②加入催化剂;③加压;④升温;⑤减少C,符合图示的条件是
A.①② B.②③ C.③④ D.④⑤
4.把少量NO2气体通入过量小苏打溶液中,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥管,最后收集到的气体是
A.氧气 B.二氧化氮 C.二氧化氮和氧气 D.二氧化氮和一氧化氮
5.关于氢键,下列说法正确的是:
A.氢键是一种特殊的化学键 B.冰、水和水蒸气中都存在氢键
C.没有氢键就没有生命 D.H2O是一种非常稳定的化合物,这是由于氢键所致
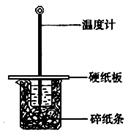 6.某实验小组学生按照课本实验要求,用50 mL0.5 mol/L的盐酸与50 mL0.55 mol/L的NaOH溶液在右图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算中和热。下列说法正确的是
6.某实验小组学生按照课本实验要求,用50 mL0.5 mol/L的盐酸与50 mL0.55 mol/L的NaOH溶液在右图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算中和热。下列说法正确的是
A.实验过程中没有热量损失
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的作用是固定小烧杯
D.若改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L的 NaOH 溶液进行反应,从理论上说所求中和热不相等
7.氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:
![]() Al2O3 + N2 + 3C 2AlN
+ 3CO
Al2O3 + N2 + 3C 2AlN
+ 3CO
下列叙述正确的是
A.在氮化铝的合成反应中,N2是还原剂,Al2O3氧化剂
B.上述反应中每生成2molAlN,N2得到3mol电子
C.氮化铝中氮元素的化合价为-3
D.氮化铝晶体属于分子晶体
8.下列各组离子在无色透明溶液中能大量共存的是
A.K+、HCO3-、I-、Na+ B.H+、Br-、NO.3-、Ag+
C.Na+、MnO4-、SO42-、K+ D.Na+、CO32-、Cl-、H+
9.按下图装置实验,若x轴表示流入阴极的电子的物质的量,则y轴可表示
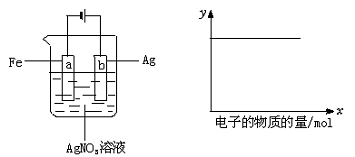
① c(Ag+) ② c(NO3—) ③ a棒的质量 ④ b棒的质量 ⑤ 溶液的pH
A.①③ B.③④ C.①②④ D.①②⑤-
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。 若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
10.在NH3、HNO3、H2SO4的工业生产中,具有的共同点是
A.使用吸收塔设备 B.使用尾气吸收装置
C.使用H2作原料 D.使用催化剂
11.pH=2的两种一元酸HX和HY的溶液分别取50mL,加入过量的镁粉,充分反应后,收集H2的体积在相同状况下分别为V1和V2,若V1>V2,下列说法正确的是
A.HX一定是弱酸 B.NaX水溶液的碱性弱于NaY水溶液的碱性
C.HX一定是强酸 D.反应开始时二者生成H2的速率相同
12.据报道,某地一辆装载有砒霜的货车因故滑下河道,部分砒霜散落到河中。砒霜的主要成分是As2O3,剧毒,可用于制造杀虫剂和灭鼠剂等。As2O3是两性偏酸性氧化物,其无色晶体在193℃升华,微溶于水生成H3AsO3;其对应的盐也有毒性。其中碱金属对应的盐易溶于水,其他金属对应的盐几乎不溶于水。根据以上信息,下列说法不正确的是
A.As2O3是砷的最高价含氧酸的酸酐
B.As2O3的晶体为分子晶体
C.可向河水中投入纯碱,以消除对河水的污染
D.可向河水中撒入生石灰,以消除对河水的污染
13.向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中轻缓地加入绿豆大小的金属钠,可能观察到的现象是

14.在医院施行外科手术时,常用HgCl2稀溶液作为手术刀的消毒剂,已知有如下性质:①HgCl2晶体熔点较低;②HgCl2在熔融状态下不能导电;③HgCl2在水溶液中可发生微弱电离,下列关于HgCl2的叙述中正确的是
A.HgCl2属于离子化合物 B.HgCl2属于共价化合物
C.HgCl2属于非电解质 D.HgCl2属于弱电解质
15.下列电离方程式或离子方程式正确的是
A.NaHCO3电离:NaHCO3==Na++H++CO32-
B.H3PO4电离:H3PO4==3H++PO43-
C.NH4+水解:NH4++H2O![]() NH3·H2O+H+
NH3·H2O+H+
D.CO32-水解:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
16.以NA表示阿伏加德罗常数,下列说法正确的是
A.0.1molH3O+中含有NA个电子
B.标准状况下,11.2L臭氧中含有NA个氧原子![]()
C.2g重氧水(H218O)、含有NA个中子
D.84gNaHCO3晶体中含有NA个CO32-
17.常温时,将Vl mL cl mol/L的氨水滴加到V2 mL c2 mol/L的盐酸中,下叙结论中正确的是
A.若Vl = V2,cl = c2,则混合液中c(NH4+) < c(Cl-)
B.若混合液的pH = 7,则混合液中c(NH4+) = c(Cl-)
C.若Vl = V2,且混合液的pH < 7,则一定有cl < c2
D.若混合液的pH = 7,则clVl =c2V2
18.反应 A+B == C 的反应速率方程式为:v = k c (A) c (B),v为反应速率,k为速率常数。当c (A) = c (B) = 1mol/L时,反应速率在数值上等于速率常数。下列说法正确的是
A.只增大c (A)时,v值增大 B.只增大c (C)时,v值增大
C.只升高温度时,k值不变 D.只升高温度时,k值变小
19.恒温下,容积均为2L的密闭容器M、N中,分别有以下列两种起始投料建立的可逆反应 3A(g) + 2B(g) ![]() 2C(g) + xD(s) 的化学平衡状态,相关数据如下:
2C(g) + xD(s) 的化学平衡状态,相关数据如下:
M:3molA 2molB; 2min达到平衡,生成D1.2mol,测得从反应开始到平衡C的速率为0.3mol/L·min
N:2molC ymolD; 达到平衡时c(A)=0.6mol/L。
下列推断的结论中不正确的是
A.x=2 B.平衡时M中c(A)﹤0.6mol/L
C.y﹥0.8 D.y﹤0.8
第二部分非选择题(共74分)
三、本题共2小题,共20分
20.(12分)某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
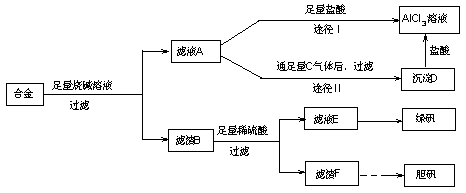
试回答下列问题:
(1) 用的器材已有:滤纸、铁架台、铁圈和烧杯,还要补充的玻璃仪器是
。
(2)由滤液A制得AlCl3溶液有途径Ⅰ和Ⅱ两条,你认为合理的是 ,理由是
。
(3)从滤液E中得到绿矾晶体的实验操作是 。
(4)写出用滤渣F制备胆矾晶体的化学方程式 。
(5)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,也能制得三种物质,你认为后者的方案是否更合理 ,理由是 。
21.(8分) “过氧乙酸”是抗“非典”中广泛用于医院、地面、门窗、汽车等方面的消毒液。下面是市售过氧乙酸商品标签:
| 过氧乙酸 本品包括甲、乙两种溶液,体积各500mL,把甲、乙溶液各1份在玻璃容器中混合后放置24小时后,其中过氧乙酸浓度不少于10%,应用50倍纯水稀释(浓度为0.2%)稀释后才能使用。 |
有关资料:H2O2是极弱的电解质,在酸性介质中才能稳定存在,是一种强氧化剂。过氧乙酸消毒液是由H2O2、H2O、CH3COOH及少量H2SO4混合后,反应生成过氧乙酸(CH3COOOH),反应的化学方程式CH3COOH+ H2O2→CH3COOOH + H2O。 CH3COOOH容易放出原子氧,它与空气中微生物机体作用,达到灭菌目的,是消毒液的主要成份。
(1)某研究性学习小组为了弄清配制过氧乙酸消毒液的甲、乙溶液的主要成分各是什么?进行以下科学探究,请你完成下列相关内容:
① 提出假设:甲溶液的主要成分为
乙溶液的主要成分为 。
②实验验证:取甲、乙两种溶液少许,分别加入几滴 试液,甲溶液的现象为 ,乙溶液的现象为 。
③得出结论:甲溶液的主要成分为
乙溶液的主要成分为 。
(2)该校根据“非典”消毒要求,急需配制0.2%过氧乙酸消毒液1m3,需要购进甲溶液_________瓶,乙溶液____________瓶。
四、本题共2小题,共21分
22.(11分)A、B、C、D均为短周期元素,B、A可形成两种液态化合物,其原子个数比分别为1:1和2:1,且分子中电子总数分别为18和10。B和D能形成一种极易溶于水的碱性气体X,B与C能形成极易溶于水的酸性气体Y,Y分子中的电子数为18。A、B、D能形成一种离子化合物,其水溶液是酸性。请写出:
(1)C的元素符号____________,X跟Y反应的化学方程式___________________________。
(2)用离子方程式解释A、B、D形成的化合物水溶液呈酸性的原因是
_____________________________________________________________。
(3)铋(Bi)跟Cl元素能形成化合物(BiCl3),其水解生成难溶于水的(BiOCl)。BiCl3水解反应的化学方程式为__________________________________。
(4)把适量的BiCl3溶于含有少量Y的水中,能得到的澄清溶液,试分析可能的原因
______________________________________________________________________________。
(5)医药上把BiOCl叫做“次某酸铋”,分析这种叫法的不合理之处。
_____________________________________________________________。
23.(10分) 下图中的每1方格表示有关的一种反应物或生成物。其中A、C为无色体。
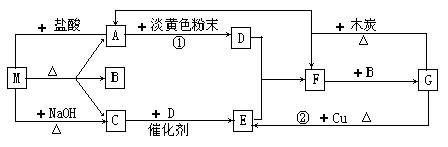
完成下列问题:
(1)物质M可以是 或 ,C是 ,F是 。
(2)淡黄色粉末的电子式是:
(3)反应①的化学方程式:
(4)反应②的离子方程式: 。
五、本题共2小题,共18分
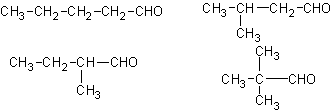
24.(8分)已知四种丁醇在催化剂存在下跟空气反应的情况如下:
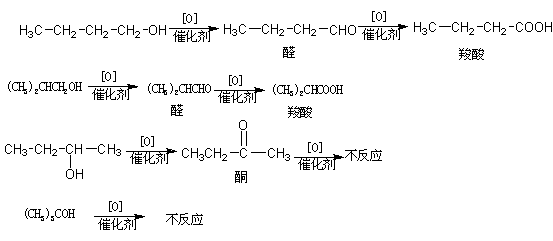 (1)各种戊醇在这样条件下,可能得到多少种酮,请写出其结构简式 。
(1)各种戊醇在这样条件下,可能得到多少种酮,请写出其结构简式 。
(2)各种戊醇在这样条件下,可能得到多少种醛,请写出其结构简式 。
(3)始终不反应的戊醇的结构简式是 。
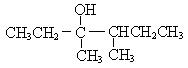
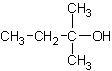
25.(10分)1912年的诺贝尔化学奖授予法国化学家V.Grignard,用于表彰他所发明的Grignard试剂(卤代烃基镁)广泛运用于有机合成中的巨大贡献。Grignard试剂的合成方法是:
RX+Mg![]() RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
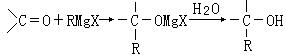
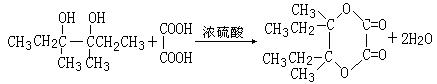
现以2-丁烯和必要的无机物为原料合成3,4-二甲基-3-己醇,进而合成一种分子式为C10H16O4的具有六元环的物质J,合成线路如下,H的一氯代物只有3种。
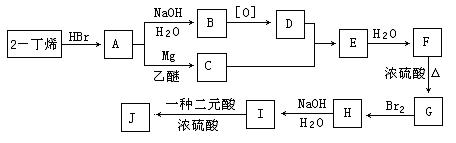
请按要求填空:
(1)F的结构简式是 ;
(2)C+D→E的反应类型是 ,F→G的反应类型是 ;
(3)写出下列化学反应方程式(有机物请用结构简式表示):
A→B ,
I→J 。
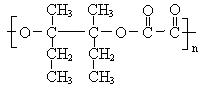
(4)I和该二元酸除了能反应生成J外,还可以在一定条件下发生缩聚反应生成高聚物,试写出此高聚物的结构简式 。
六、本题共2小题,共17分
 26.(7分)右图为某市售盐酸试剂瓶标签上的部分数据。问:
26.(7分)右图为某市售盐酸试剂瓶标签上的部分数据。问:
(1)该盐酸的物质的量浓度为多少?(列式计算)
(2)取该盐酸25.5mL与2.00mol/L的氢氧化钠溶液100mL混合,再将混合后溶液稀释至1.00L,此时溶液的pH约为多少?
27.(10分)CuSO4溶液和强碱反应得碱式硫酸铜,其化学组成为aCuSO4·bCu(OH)2(a、b为正整数,且2<b<6,![]() ),有的还含一定数目的结晶水,其组成随反应条件不同而异。
),有的还含一定数目的结晶水,其组成随反应条件不同而异。
(1)取一种不含结晶水的某碱式硫酸铜样品高温灼烧后只得CuO固体,另取等质量的样品,滴加稀盐酸至恰好完全反应。两次实验中消耗HCl与生成CuO的物质的量之比为3:2,则该碱式硫酸铜的化学组成为__________________。
(2)某含结晶水的碱式硫酸铜aCuSO4·bCu(OH)2·cH2O(c也是正整数),已知a+b+c=9。取一定量样品高温灼烧至质量不再改变,将反应产生的气体通过盛有足量P2O5的U型管,U型管增重1.26g。残留固体冷却后质量为5.60g。通过计算求该含结晶水的碱式硫酸铜的化学组成。
2006届梅州市四校联考高三化学参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
| 答案 | A | C | B | C | C | B | C | A | D | |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 |
| 答案 | D | AD | AC | A | BD | C | AC | AB | A | BD |
三、本题共2小题,共20分
20.(12分)(1)漏斗、(1分)玻璃棒。(1分)
(2)途径Ⅱ更合理;(1分)因为滤液A是NaAlO2溶液,按途径I直接向A加入盐酸得到的AlCl3溶液中含有大量的NaCl杂质;(1分)按途径II,通入c(CO2)气体,得D[Al(OH)3]沉淀,将Al(OH)3溶解于盐酸中得到的是纯净的AlCl3溶液。所以途径II更合理。(1分)
(3)蒸发浓缩、(1分)冷却结晶。(1分)
![]() (4)2Cu + O2
2CuO (1分) CuO + H2SO4 = CuSO4 + H2O,(1分) CuSO4
+ 5H2O = CuSO4·5H2O(1分)(合并后面两个化学方程式,正确的给2分)
(4)2Cu + O2
2CuO (1分) CuO + H2SO4 = CuSO4 + H2O,(1分) CuSO4
+ 5H2O = CuSO4·5H2O(1分)(合并后面两个化学方程式,正确的给2分)
(5)后者的方案不合理。(1分)因为该方案不符合实验方案设计的简约性原则,即操作步骤多、消耗试剂量更大、时间长。(1分)
21(8分)
(1)①(2分)甲溶液的主要成分可能是H2O2、H2O、H2SO4,乙溶液的主要成分可能是CH3COOH、H2O(设成“H2O2、CH3COOH”共存一瓶则不给分),其它合理假设也可给分。
②(2分)紫色石蕊试剂;甲溶液先变成红色,后又褪为无色;乙溶液由无色变成红色。
③(2分)甲溶液的主要成分是H2O2、H2O、H2SO4,乙溶液的主要成分是CH3COOH、H2O
(2)(2分)20、20
四、本题共2小题,共21分
22、(11分)(1)Cl(1分) NH3 + HCl = NH4Cl(2分)
(2)NH4++H2O ![]() NH3·H2O+H+ (2分)
NH3·H2O+H+ (2分)
(3)BiCl3 + H2O = BiOCl + 2HCl(2分)
(4)盐酸抑制了BiCl3的水解。(2分)
(5) BiOCl中的氯元素呈-1价,而次氯酸中的氯元素应呈+1价。故不能叫次氯酸铋。(2分)
23.(10分)(1)NH4HCO3 , (NH4)2CO3, NH3, NO2 (各1分)
(2) ![]()
(3)3CO2+2Na2O2=2Na2CO3+O2 (2分)
(4)3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O (2分)
五、本题共2小题,共18分
24.(8分)(1)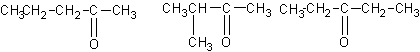
(2)
 (3)
(3) (每式1分,共8分)
(每式1分,共8分)
25.(10分) (1) (2分)
(2)加成反应 消去反应(各1分)
(3)CH3CH2CHBrCH3+NaOH![]() CH3CH2CH(OH)CH3+NaBr
CH3CH2CH(OH)CH3+NaBr
 (各2分)
(各2分)
(4)
(2分)
六、本题共2小题,共17分
26.(7分)(1)![]() (3分)
(3分)
(2) n(HCl)=11.8mol/L×0.0255L=0.300mol
n(NaOH)=2.00mol/L×0.100l= 0.200mol (2分)
混合并稀释后溶液中![]()
pH=-lgc(H+)=1 (2分)
27.(10分)CuSO4溶液和强碱反应得碱式硫酸铜,其化学组成为aCuSO4·bCu(OH)2(a、b为正整数,且2<b<6,![]() ),有的还含一定数目的结晶水,其组成随反应条件不同而异。
),有的还含一定数目的结晶水,其组成随反应条件不同而异。
(1)取一种不含结晶水的某碱式硫酸铜样品高温灼烧后只得CuO固体,另取等质量的样品,滴加稀盐酸至恰好完全反应。两次实验中消耗HCl与生成CuO的物质的量之比为3:2,则该碱式硫酸铜的化学组成为__________________。
(2)某含结晶水的碱式硫酸铜aCuSO4·bCu(OH)2·cH2O(c也是正整数),已知a+b+c=9。
取一定量样品高温灼烧至质量不再改变,将反应产生的气体通过盛有足量P2O5的U型管,U型管增重1.26g。残留固体冷却后质量为5.60g。通过计算求该含结晶水的碱式硫酸铜的化学组成。
27. (10分) (1)该碱式硫酸铜的化学式为 CuSO4·3Cu(OH)2 (4分)
(2)根据题意,1.26g为样品加热生成水蒸气的质量,5.60g为样品分解生成CuO的质量。(1分)
n(CuO):n(H2O)=![]() ∶
∶![]() =0.07∶0.07=1∶1 即a+b=b+c
所以a=c (3分)
=0.07∶0.07=1∶1 即a+b=b+c
所以a=c (3分)
又因![]() <
<![]() <
<![]() a+b+c=9
a+b+c=9
若a=c=1 b=7 不符 a=c=2 b=5 符合
a=c=3 b=3 不符合 a=c=4 b=1 不符合 (2分)
所以该含结晶水的碱式硫酸铜的化学式为 2CuSO4·5Cu(OH)2·2H2O (2分)
