2006年全国模拟探究性专项测试·氧化还原反应
一、选择题
1.(06年宿迁市部分重点中学联合调研,7)据世界卫生组织统计,全球约有8000万妇女使用避孕环,常用避孕环都是含金属铜的。据认为,金属铜的避孕机理之一是:铜与子宫分泌物中的盐酸以及子宫内的空气反应:Cu+HCl+O2=CuCl+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性,能杀死精子。下列说法或表示正确的是
A.氧化产物是HO2 B.HO2在碱中能稳定存在
C.氧化剂是O2 D.1 mol Cu参加反应有2 mol电子发生转移
2.(06年宿迁市部分重点中学联合调研,13)FeS2与HNO3反应的产物有Fe3+和H2SO4,若
反应中FeS2和HNO3的物质的量之比是1∶8,则HNO3的还原产物是
A.NO2 B.NO C.N2O D.N2O3
3.(06年北京东城区期考,8)一定条件下,氨气与一氧化氮发生反应:NH3+NO→N2+H2O
(未配平)。在该反应中,被氧化与被还原的氮原子数之比为
A.2:3 B.3:2 C.4:5 D.5:6
|
A.Na2O2既是氧化剂又是还原剂
B.Na2FeO4既是氧化产物又是还原产物
C.3 mol Na2O2发生反应,有12mol 电子转移
D.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌
5.(06年北京西城区期考,5)在泡沫橡胶的制造中,要利用下面反应放出的氧气:
2H2O2 2H2O+O2↑,该反应中的双氧水
A.仅为氧化剂 B.仅为还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
6.(06年吉林市期考, 3)暴露于空气中不易变质的物质是
A.小苏打 B.石炭酸 C.植物油 D.FeSO4溶液
7.(06年吉林市期考, 9)现有反应xKI+yKIO3+zH2SO4=aI2+bK2SO4+cH2O,其中x+y+z与a+b+c的关系是
A.大于 B.小于 C.等于 D.不能确定
8.(06年吉林市期考, 18)某强酸性溶液中可能存在NO3—、Cl—、I—、Fe3+中的一种或几
种。向溶液中加入溴水,有单质溴被还原,由此推断溶液中
①不含NO3—、也不含Fe3+ ②含有NO3—、I—、Cl—
③含有I—,但不能确定是否含有Cl— ④含有Fe3+
A.①② B.①③ C.①④ D.①③④
9.(06年南通市九校联考,5)将SO2通入CuSO4和NaCl的浓溶液中,溶液颜色变浅,析出白色沉淀,取该沉淀分析,知其中含Cl:35.7%,Cu:64.3%,SO2在上述反应中作用是
A.酸 B.漂白剂 C.还原剂 D.氧化剂
10.(06年盐城市二模,15)铜的冶炼大致可分为:
⑴富集,将硫化物矿进行浮选;
⑵焙烧,主要反应为:2CuFeS2+4O2==Cu2S+3SO2+2FeO(炉渣);
⑶制粗铜,在1200℃发生的主要反应为:2Cu2S+3O2 ==2Cu2O+2SO2;2Cu2O+ Cu2S==6 Cu+SO2↑;
⑷电解精炼。
下列说法正确的是
A.上述灼烧过程的尾气均可直接排空
B.由6mol CuFeS2生成6molCu,上述共消耗15molO2
C.在反应2Cu2O+ Cu2S==6 Cu+SO2↑中,作氧化剂的只有Cu2O
D.电解精炼时,粗铜应与外电源正极相连
11.(06年山东省潍坊市质检,17)将足量的铜屑加入到浓度均为2 mol·L-1的HNO![]() 和H
和H![]() SO
SO![]() 的混合溶液100 mL中,充分反应后,转移电子的物质的量为
的混合溶液100 mL中,充分反应后,转移电子的物质的量为
A.0.6 mol B.0.8 mol C.0.45 mol D.0.4 mol
12.(06年盐城市一模,18)氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为aHClO3===bO2↑+cCl2↑+dHClO4+eH2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法正确的是
A.由反应可确定:氧化性HClO4>HClO
B.变蓝的淀粉碘化钾试纸褪色是因为可能发生了:
5C12+I2+6H2O==12H++10Cl—+2IO3—
C.若氯酸分解所得混合气体,lmol混合气体质量为47.6g,则反应方程式可表示为:
26HClO3 ====15O2↑+8C12↑+10HClO4+8H2O
D.若化学计量数a=8,b=3,则该反应转移电子数为20e—
13.(06年揭阳市统考,7)在硫酸溶液中,NaClO3和Na2SO3按物质的量之比为2:1完全反应,生成棕黄色气体X,则X为:
A.Cl2 B.Cl2O C.ClO2 D.Cl2O3
14.(06年揭阳市统考,16)NaBr、NaI、Na2SO3混合溶液中通入一定量的氯气后,将溶液蒸干并充分灼烧,得到的固体物质中不可能是
A.NaCl 、Na2SO4 B.NaCl、NaBr、Na2SO4
C.NaCl、Na2SO4、I2 D.NaCl、NaI、Na2SO4
15.(06年湖州市期考,8)氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,
被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:
Al2O3 + N2 + 3C ![]() 2AlN + 3CO,下列叙述正确的是
2AlN + 3CO,下列叙述正确的是
A.氮化铝晶体属于分子晶体
B.氮化铝中氮元素的化合价为-3
C.上述反应中每生成2molAlN,N2得到3mol电子
D.在氮化铝的合成反应中,N2是还原剂,Al2O3氧化剂
16.(06年湖州市期考,17)臭氧可使湿润的淀粉KI试纸变蓝,反应为2KI+O3+H2O=2KOH+I2+O2,下列结论正确的是
A.O3在反应中被氧化成O2 B.O2 是还原产物
C.1mol O3在反应中得到2 mol电子 D.H2O既是氧化剂又是还原剂
17.(06年南京市第1次质量检测,16)在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1 mol的混合溶液中加入0.1 mol铁粉,充分搅拌后,Fe溶解,溶液中不存在Fe3+离
子,同时析出0.1 molAg,下列结论错误的是
A.氧化性:Zn2+>Cu2+>Fe3+>Ag+
B.Fe3+的氧化性大于Cu2+
C.溶液中Cu2+与Fe2+物质的量比为1:2
D.1 mol Fe可还原2 molFe3+
18.(06年福建省质检,15)YO3n-和S2-在水溶液中发生如下反应:
YO3n-+3S2-+6H+==Y一+3S↓+3H2O,YO3n-中Y元素的化合价为
A.+4 B.+5 C.+6 D.+7
19.(06年广州市二模,8)在稀硫酸中加入铜粉,铜粉不溶,再加入下列固体粉末:①FeCl2;②Fe2O3;③Zn; ④KNO3。铜粉可溶解的是
A.①② B.②④ C.②③ D.①④
20.(06年广州市二模,10)ClO2是 一种消毒杀菌效率高的水处理剂,实验室可通过以下反应制得:KClO3+H2C2O4+H2SO4→ClO2↑+K2SO4+CO2↑+H2O(未配平).下列有关叙述中,正确的是
A.ClO2是氧化产物
B.还原产物与氧化产物的物质的量之比为1:2
C.H2C2O4的还原性比ClO2强
D.1molKClO3参加反应有1mol电子转移
21.(06年杭州市第一次高考科目教学质检,4)某酒精厂由于管理不善,酒精滴漏到某种化学品上而酿成火灾。该化学品可能是
A.KMnO4 B.Na2CO3 C.(NH4)2SO4 D.CH3COOH
22.(06年2月济南市高三统考,19)![]() 的溶液恰好完全反
的溶液恰好完全反
应,被还原的HNO3的物质的量一定是
A.(b-2a)mol B.![]() C.
C.![]() D.
D.![]()
23.(06年梅州市一检,8)硝酸铵(NH4NO3)在不同条件下分解可以得到不同的产物,下列各组物质中肯定不可能是硝酸铵分解产物的是
A.N2O、H2O B.N2、O2、H2O
C.N2、HNO3、H2O D.NH3、NO、H2
24.(06年南通市高三第一次调研,18)一定条件下CuS与稀HNO3发生反应,所得还原产物为NO,氧化产物为SO42—。现将0.06molCuS加入到50mL4.2mol/LHNO3中,充分反应之后,忽略溶液体积变化,下列说法正确的是
A.被还原的硝酸为0.16mol B.反应后溶液中仍有硝酸剩余
C.反应后溶液的pH=1 D.CuS未全部参加反应
25.(06年苏州市二模,3)某溶液含有相同浓度的Cl—和I—,为了氧化I—,但不使C1—氧化,下列氧化剂中不可选用的是
A.FeCl3溶液 B.酸性KMnO4溶液 C 浓HNO3 D.C12
26.(06年泰安市高三全程整理性检测题,6)铊(T1)是某超导材料的组成元素之一,与铝同族,位于周期表第六周期。T13+与银在酸性溶液中发生反应:T13++Ag→T1++Ag+,下列推断正确的是
A.T1+的最外层有1个电子 B.11能形成+3价和+l价的化合物
C.T13+氧化性比Ag+弱 D.T1+的还原性比Ag强
27.(06年北京崇文区期考,7)有时候,将氧化还原方程式拆开写成两个“半反应”。下面是一个“半反应”式:( )NO3- + ( )H+ + ( )e- =( )NO + ( )H2O ,
该式的配平系数是
A.1,3,4,2,1 B.2,4,3,2,1
C.1,6,5,1,3 D.1,4,3,1,2
28.(湖南省2006届高三 百校大联考 第一次考试,16)将KCl和CrCl3两种固体混合物共熔发生化合反应制得化合物X。将1.892gX中Cr元素全部氧化成Cr2O72-, Cr2O72-可与过量的KI发生氧化还原反应氧化出2.667g I2,反应的离子方程式是:Cr2O72-+6I-+14H+=2Cr3++3 I2+7H2O,如果取溶有1.892g X的溶液,加入过量的AgNO3,可得4.52gAgCl沉淀,则表示X组成的化学式为
A.K3Cr2Cl7 B.K3Cr2Cl5
C.K3Cr2Cl9 D.K2CrCl4
29.(湖南省示范性高中2006届高三联考,7).Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx 与NaClO的物质的量之比为1:16,则X的值是
A.2 B.3 C.4 D.5
30.(06年淮安市高三第一次调查测试,15)已知I一、Fe2+、SO2、Cl一和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为Cl一<Fe2+< H2O2 < I一 <SO2,则下列反应不可能
发生的是 CD
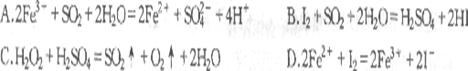
31.(06年南通市二模,3)碘化砹(AtI)可发生下列反应,①2AtI+2Mg==MgI2+MgAt2
②AtI+2NH3(l)==NH4I+ AtNH2。对上述两个反应的有关说法正确的是
A.这两个反应都是氧化还原反应
B.反应①MgAt2既是氧化产物,又是还原产物
C.反应②中AtI既是氧化剂,又是还原剂
D.MgAt2的还原性弱于MgI2的还原性
32.(2006年江苏四市教学情况调查,2)吸进人体内的![]() 有2%转化为氧化性极强的活性氧
有2%转化为氧化性极强的活性氧![]() ,它能加速人体衰老,因而被称为“夺命杀手”。我国科学家尝试用含硒化合物Na2SeO3消除人体内的活性氧,则Na2SeO3所起的作用是
,它能加速人体衰老,因而被称为“夺命杀手”。我国科学家尝试用含硒化合物Na2SeO3消除人体内的活性氧,则Na2SeO3所起的作用是
A.氧化剂 B.还原剂 C.催化剂 D.缓释剂
33.(06年江西高三第一次模拟考试,14)实验室用KClO3和浓盐酸反应制取氯气,化学方程式为KClO3+6HCl=KCl+3Cl2↑+3H2O若生成71g氯气,则被氧化的氯化氢为
A.73g B.![]() ×36.5g C.3×36.5g D.
×36.5g C.3×36.5g D.![]() ×36.5g
×36.5g
34.(06年揭阳市一模,8)据最新报道,科学家发现了如下反应:O2+PtF6=O2(PtF6),已知O2(PtF6)为离子化合物,其中Pt为+5价,对于此反应,下列说法正确的是
A.在此反应中,O2是氧化剂,PtF6是还原剂
B.O2(PtF6)中氧元素的化合价是+1价
C.O2(PtF6)中不存在共价键
D.在此反应中,每生成1mol O2(PtF6)则转移1mol电子
35.(06年荆州市期考,4)某FeCl2 溶液中混有FeI2 杂质,根据已知反应:
①2FeCl3+2KI=2FeCl2+2KCl+I2;②2FeCl2+Cl2=2FeCl3;③F2+2KI(固)=2KF+I2中的有
关事实,要除去其中的FeI2,应选用的试剂是
A.F2 B.过量Cl2 C.FeCl3 D.FeCl2
36.(06年荆州市期考,14)CS2是一种有恶臭的液体,它滴入用H2SO4酸化的KMnO4溶液时,有黄色沉淀析出,并放出CO2气体,当产生0.5molCO2时,转移的电子数目是
A.NA B.2NA C.3NA D.4NA
37.(06年临沂市高三一轮复习验收考试,2)下列化工生产过程中所发生的主要化学反应不属于氧化还原反应的是
A.用氯气和消石灰制漂白粉 B.铝热法冶炼金属钒
C.用油脂制肥皂 D.电解饱和食盐水制烧碱
38.(06年济宁市期考,2)把金属铁加入FeCl3、FeCl2和CuCl2混合溶液中,反应生铁有剩余,则溶液中浓度最大的阳离子是
A.H+ B.Fe3+ C.Fe2+ D.Cu2+
39.(06年高密市三月份教学质量检测,5)下列化工生产过程中所发生的主要化学反应不属于氧化还原反应的是
A.用氯气和消石灰制漂白粉 B.铝热法冶炼金属钒
C.用油脂制肥皂 D.电解饱和食盐水制烧碱
40.(06年高密市三月份教学质量检测,19)在一定温度下,某浓度的硝酸与金属锌反
应生成NO2和NO的物质的量之比为1:3,则要使1 mol金属锌完全反应,需要硝酸的物质
的量为
A.2.8 mol B.2.6 mol C.2.4 mol D.0.8mol
41.(06年汕头市一模,13)相等物质的量的KClO3分别发生下述反应:①有MnO2催化剂存在时,受热分解得到氧气;②若不使用催化剂,加热到470℃左右,得到KClO4(高氯酸钾)和KCl。下列关于①和②的说法不正确的是
A.都属于氧化还原反应 B.发生还原反应的元素相同
C.发生氧化反应的元素不同 D.生成KCl的物质的量相同
42.(06年宿迁市第四次模拟考试,11)研究发现CuSO4和FeS2在一定条件下可发生如下反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4 下列说法正确的是
| A.FeS2中的硫元素全部被氧化 |
| B.5molFeS2发生反应,有10mol电子转移 |
| C.产物中SO42-离子有一部分是氧化产物 |
| D.FeS2只作还原剂 |
43.(06年徐州市第一次质量检测,3).据最新报道,科学家发现了如下反应:
O2 + PtF6 = O2(PtF6),已知O2(PtF6)为离子化合物,其中Pt为+5价,对于此反应,下列
说法正确的是
A.在此反应中,O2氧化剂,PtF6是还原剂
B.O2(PtF6)中氧元素的化合价为+1价
C.在此反应中,每生成1 mol O2(PtF6) 则转移1 mol电子
D.在O2(PtF6)中不存在共价键
44.(2006年扬州市期末调研,15)从矿物学资料查得,一定条件下自然界存在如下反应:![]() ,下列说法正确的是
,下列说法正确的是
A. FeS2只作还原剂,CuSO4只作氧化剂
B. 5mol FeS2发生反应,有7mol电子转移
C.产物中的SO42-离子都是氧化产物
D. Cu2S既是氧化产物又是还原产物
45.(06年扬州市第二次调研,18)FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、
NO2、N2O4、NO和H2O,当NO2、N2O4、、NO的物质的量之比为4﹕1﹕4时,实际参加
反应的FeS与HNO3的物质的量之比为
A.1∶6 B.2∶15 C.2∶3 D.16∶25
二、非选择题
1.(06年宿迁市部分重点中学联合调研,21)(10分)
(1)航天飞机曾用金属铝粉和高氯酸铵混合物作为固体燃料。加热铝粉使其氧化并
放出大量热量,促使混合物中另一种燃料分解。m mol高氯酸铵分解时除产生2m mol水蒸气和m mol氧气外,其他组成元素均以单质形式放出,因而产生巨大的推动力。写出其中涉及到的化学方程式: ;
。
(2)高氯酸铵作为火箭燃料的重要氧载体。高氯酸铵在高压、450℃的条件下迅速分解生成水蒸气、氮气、氯化氢和氧气。
①写出此反应的化学方程式 ;
②反应中生成的氧化产物与还原产物的物质的量之比是 ,每分解1mol高氯酸铵,转移的电子数目是 。
2.(06年北京西城区期考,21)(6分)神舟6号宇宙飞船是靠长征Ⅱ(F)型运载火箭发射升空的。该火箭所用的燃料是偏二甲肼[(CH3)2N—NH2],氧化剂是N2O4,产物是氮气、二氧化碳和水。
(1)火箭点火瞬间,逸出的红棕色气体是 ,产生该气体的化学反应方程式为 。
(2)偏二甲肼在N2O4中燃烧的化学方程式为 ,
当有1mol偏二甲肼燃烧时,转移电子的物质的量为 。
3.(06年揭阳市统考,27)(10分)为测定一置于空气中的某用硫酸酸化的FeSO4溶液
中的Fe2+被氧化的百分率,某同学准确量取pH=1(忽略Fe2+ 和Fe3+的水解)的FeSO4
溶液200mL,加入过量的BaCl2溶液,充分反应后过滤,洗涤干燥,得到沉淀28.0g,再
另取同样的FeSO4溶液200mL,向其中加入过量的NaOH溶液,搅拌使其充分反应,待
沉淀全部变为红褐色后过滤、洗涤并灼烧所得固体,最终得到固体8.0g,
(1)通过计算,填写下表
(2)计算溶液中Fe2+被氧化的百分率。
(3)当Fe2+部分被氧化时,试推导c(Fe2+ 、Fe3+)与c(H+)、c(SO42-)的关系。
4.(06年湖州市期考,19)(8分)某一反应体系有反应物和生成物共五种物质:O2 、
H2CrO4 、Cr(OH)3 、H2O 、H2O2 已知该反应中H2O2只发生如下过程:H2O2→O2
⑴ 该反应中的还原剂是___________________。
⑵ 该反应中,发生还原反应的过程是____________ → ________________。
⑶ 写出该反应的化学方程式,并标出电子转移的方向和数目
_______________________________________________________。
⑷ 如反应转移了0.3mol电子,则产生的气体在标准状况下体积为_______________。
5.(06年深圳市高三第一次调研,22)(10分)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米顺粒(杂质),这种颗粒可用氧化气化法提纯,其反应式为:
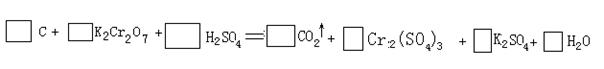 ⑴完成配平上述反应的化学方程式;
⑴完成配平上述反应的化学方程式;
⑵此反应的氧化剂是 ,氧化产物的电子式 ;
⑶H2SO4在上述反应中表现出来的性质是 (填选项编号)(多选倒扣分);
A酸性 B氧化性 C吸水性 D脱水性
⑷上述反应中若产生0.2molCO2气体,则转移电子的物质的量是 mol。
6.(06年泰安市高三全程整理性检测题,25)(7分)在化工分析中常用到滴定度这个概念。滴定度是指每毫升滴定剂标准溶液相当于被测组分的质量,其单位为g/mL。现有一不溶于水的氧化亚铜样品,该样品能溶于用硫酸酸化了的硫酸铁溶液,所发生反应的化学方程式为(未配平):
Cu2O+Fe2(SO4)3+H2SO4→CuSO4+FeSO4+H2O。反应生成的硫酸亚铁用硫酸酸化了的高锰酸钾溶液进行滴定,其滴定反应的化学方程式为(未配平):
KMnO4+H2SO4+FeSO4→Fe2(SO4)3+MnSO4+K2SO4+H2O。
若每升滴定剂溶液中含有0.400molKMnO4,求该KMnO4溶液对Cu2O的滴定度。
7.(06年潍坊市高三统考,18)(17分)某化学研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应,提出了两种可能:
一是发生氧化还原反应:2Fe3++SO2-3+H2O=2Fe2++SO2-4+2H+;
二是发生双水解反应:2Fe3++3SO2-3+6H2O=2Fe(OH)3(胶体)+3H2SO3。
为了证明是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
实验Ⅰ,学生选择的实验用品:Na2SO3浓溶液、BaCl2稀溶液、稀盐酸;试管若干、胶头滴管若干。从选择的药品分析,作者设计这个实验的目的是________________。
实验Ⅱ,取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色液体是___________________。向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是__________________。将溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,反应的离子方程式为_________ __________。另一份加入BaCl2稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式是
_______________________________________。
实验Ⅲ,换用稀释的FeCl3和Na2SO3溶液重复实验Ⅱ、Ⅲ,产生的现象完全相同。由上述实验得出的结论是__________________。若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的化学方程式是_____ _______。
从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:
①________________________________________________________________;
②________________________________________________________________。
8.(湖南省2006届高三 百校大联考 第一次考试,19)NH4NO3在不同条件(温度)下加热分解,可能发生非氧化还原反应,也可能发生氧化还原反应。若NH4NO3在通常条件下加热的分解产物不出下列范围,根据已学知识(化合价升降规律等)判断,下列反应可能的是 (有错选得“0”分)
A.NH4NO3→N2+O2+H2O B.NH4NO3→NH3+HNO3
C.NH4NO3→O2+HNO3+H2O D.NH4NO3→N2+HNO3+H2O
E.NH4NO3→N2+NH3+H2O F.NH4NO3→N2O+H2O
9.(06年江西高三第一次模拟考试,19)(8分)2000年美国《科学》杂志报道,意大利科学家合成了一种新型氧分子,它是由4个氧原子构成的![]() 分子,专家认为它液化后的能量密度比普通氧分子高得多。
分子,专家认为它液化后的能量密度比普通氧分子高得多。![]() 分子的结构如下图所示,是平面型分子,键角为120°。四个氧原子以一个O原子为中心,与另外三个O原子分别构成一个非极性共价键;中间O原子提供三个电子,周围三个O原子各提供1个电子,构成一个
分子的结构如下图所示,是平面型分子,键角为120°。四个氧原子以一个O原子为中心,与另外三个O原子分别构成一个非极性共价键;中间O原子提供三个电子,周围三个O原子各提供1个电子,构成一个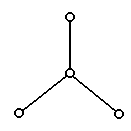 特殊的化学键——四个O原子均等地享有这6个电子,请回答:
特殊的化学键——四个O原子均等地享有这6个电子,请回答:
(1)![]() 固体属于____________晶体(填“原子”、“离子”、“分子”、“金属”)
固体属于____________晶体(填“原子”、“离子”、“分子”、“金属”)
(2)![]() 与氧气的关系是__________,它们之间的转化是否为氧化还原反应_________(填是或否)。
与氧气的关系是__________,它们之间的转化是否为氧化还原反应_________(填是或否)。
(3)![]() 具有强氧化性,能将
具有强氧化性,能将![]() 氧化为
氧化为![]() ,试配平:
,试配平:
![]()
在该反应中,当生成1 mol ![]() ,转移电子的物质的量为________ mol。
,转移电子的物质的量为________ mol。
10.(连云港市2006届高三第二次调研考试,21).(6分)随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。钒元素广泛分散于各种矿物中,钾钒铀矿的主要成分可用化学式表示为K2H6U2V2O15,测定其中钒元素含量的方法是:先把矿石中的钒元素转化为V2O5(钒元素的化合价不变),V2O5在酸性溶液里转化为VO2+,再用草酸等测定钒。总反应可表示为:
![]() □VO2+ + □H2C2O4
+ □H+ □VO2+ + □CO2 + □H2O
□VO2+ + □H2C2O4
+ □H+ □VO2+ + □CO2 + □H2O
⑴请将上述反应配平。
⑵现有钾钒铀矿样品10.2g,用上述方法来测定钒的含量,结果消耗0.9g草酸,那么此钾钒铀矿中钒元素的质量分数是 。若用氧化物的形式表示钾钒铀矿的主要成分,其化学式为 。
11.(06年高密市三月份教学质量检测,23)(9分)某反应体系中有反应物和生成物共六种:H2C2O4、CO2、(VO2)2SO4、VOSO4、H2SO4、H2O,其中(VO2)2SO4是反应物之一。
(1)完成并配平该反应的化学方程式:______________________________________。
(2)反应中的氧化剂是_________,当有1mol H2C2O4参加反应时,转移电子_______mol。
(3)(VO2)2SO4与NaOH发生复分解反应的产物之一是Na3VO4。写出这一反应的化学
方程式:___________________________________________。
12.(06年高密市三月份教学质量检测,26)过氧乙酸(C2H4O3)是一种消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0,涉及下列反应:
![]() ① 2MnO4-+5H2O2+6H+
2Mn2++5O2十8H2O
① 2MnO4-+5H2O2+6H+
2Mn2++5O2十8H2O
![]() ② H2O2+2I-+2H+
I2+2H2O
② H2O2+2I-+2H+
I2+2H2O
![]() ③ C2H4O3+2 I-+2H+ CH3COOH+I2+H2O
③ C2H4O3+2 I-+2H+ CH3COOH+I2+H2O
![]() ④ 2 S2O32-+I2 S4O62-+2I-
④ 2 S2O32-+I2 S4O62-+2I-
取20mL待测液,用硫酸使溶液酸化,再用浓度为1mol·L-1的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为20mL(反应①,滴定过程中KMnO4不与过氧乙酸反应)。
另取20 mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为3 mol·L-1的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为60mL。
(1)已知过氧乙酸分子部分含有与H2O2相同的“结构”,则其结构简式为 。
(2)根据上述实验数据,可计算过氧乙酸物质的量浓度c0= ______________________。
(3)当加入的KI的质量 (填写选择序号)时,可不影响测定过氧乙酸的浓度c0。
(多选或少选均不给分)
A.少量并准确称量 B.少量不准确称量
C. 过量并准确称量 D.过量不准确称量
1. (1)4Al + 3O2 ![]() 2Al2O3 (2分)
2Al2O3 (2分)
2NH4ClO4
![]() N2↑ + 4H2O↑ + Cl2↑
+ 2O2↑; (2分)
N2↑ + 4H2O↑ + Cl2↑
+ 2O2↑; (2分)
化学式错、不配平均不给分,漏条件和“↑”符号扣1分。
(2)① 4NH4ClO4 高压、450℃ 6H2O↑+ 2N2↑+ 4HCl↑+ 5O2↑ (2分)
② 7∶4 (2分); 8NA 或 8×6.02×1023 (2分)
2.(1)NO2(1分) N2O4=2NO2(写“=”或“ ”号均可得分。共2分)
![]() (2)(CH3)2N—NH2+2N2O4 3N2+2CO2+4H2O
(2)(CH3)2N—NH2+2N2O4 3N2+2CO2+4H2O
(偏二甲肼写成C2N2H8或C2H8N2,“→”写成“=”号均可得分,不写条件及配平错误扣1分。共2分)16mol(1分)
3.
4.(每空2分,8分) ⑴ H2O2 ⑵ H2CrO4 Cr(OH)3
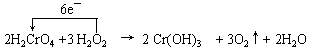 ⑶
⑶
⑷ 3.36L
5.(10分)(1)3、2、8、3、2、2、8H2O (2分); (2)K2Cr2O7(2分)
![]()
(2分) (3)A(2分) (4)0.8mol(2分)
6.(7分)
每毫升KMnO4溶液中含KMnO4的物质的量为
0.400mol·L-1×![]() (1分)
(1分)
设每毫升KMnO4溶液对应Cu2O的质量为x
得关系式:2KMnO4——5Cu2O (列出关系式得2分)
2mol 5×144g
4.00×10-4mol x
x=![]() (计算出结果得3分)
(计算出结果得3分)
即:KMnO4溶液对Cu2O的滴定度为0.144g/mL (1分)
7.实验Ⅰ:检验Na2SO3是否变质(或检验Na2SO3溶液中是否混有Na2SO4)
实验Ⅱ:氢氧化铁胶体(或胶体);先产生红褐色沉淀,后沉淀逐渐溶解,溶液变为黄
色;有气泡产生;Fe3++3SCN-=Fe(SCN)3;Ba2++SO42-=BaSO4↓
Fe3+与SO32-同时发生氧化还原反应和双水解反应2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑
①SO32-有较强的还原性,CO32-没有还原性
②SO32-水解能力较CO32-小
8.A、B、D、F
9.(8分)[(1)、(2)每空1分,(3)配平3分,后一空2分]
(1)分子
(2)互为同素异形体;否
(3)1;4;4;![]() ;4;2;1;4
;4;2;1;4
10.
11.(1)![]() +(VO2)2SO4+
H2C2O4→2CO2↑+2VOSO4+2H2O (3分)
+(VO2)2SO4+
H2C2O4→2CO2↑+2VOSO4+2H2O (3分)
(2)(VO2)2SO4 (1分) 2mol (1分)
(3)(VO2)2SO4+8NaOH→2Na3VO4+Na2SO4+4H2O (2分)
12.(8分)(1) CH3COOOH (2分) (2) 2mol/L (4分) (3) C D (2分)