阳泉一中高考化学复习单元过关《电离平衡》试卷
(时间:50分钟。满分100分)
可能用到的原子量: H: 1 O: 16 N: 14 Na: 23 Cl: 35.5 C: 12 Ca: 40 Cu:64
S: 32 Fe: 56 Mg: 24 P: 31 Zn:65
一、选择题(下列各题只有1-2个选项符合题意。每小题4分,共60分。请将答案填在答题卡上)
1.在100mL0.1mol/L 的醋酸溶液中,欲使醋酸的电离度增大,H+ 浓度减小,可采用的方法是
A 加热 B 加入0.1mol/L 的醋酸溶液100mL
C 加入少量的0.5mol/L的硫酸 D 加入少量的1mol/L 的NaOH溶液
2.把AlCl3溶液蒸干灼烧,最后得到的固体产物是
A AlCl3·6H2O B AlCl3 C Al(OH)3 D Al2O3
3.下列溶液肯定是酸性的是
A 含H+的溶液 B 加酚酞显无色的溶液
C pH<7的溶液 D [OH-]<[H+]的溶液
4.下列叙述正确的是
A pH=3和pH=4的盐酸各10mL混合,所得溶液的pH=3.5
B 溶液中[H+]越大,pH值也越大,溶液的酸性就越强
C 液氯虽然不导电,但溶解于水后导电情况良好,因此,液氯也是强电解质
D 当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数
5.在25℃时,某稀溶液中由水电离产生的[H+]=10-13mol/L。下列有关该溶液的叙述正确的是
A 该溶液一定呈酸性 B 该溶液一定呈碱性
C 该溶液的pH值可能为1 D 该溶液的pH值可能为13
6.下列溶液中,pH>8的是
A 0.1mol/L氨水跟0.1mol/L盐酸等体积混合后的溶液
B 将pH=12的NaOH溶液稀释至100倍后所得到的溶液
C 将pH=5的醋酸溶液稀释至10000倍后所得到的溶液
D [OH-]=10-6mol/L的NaOH溶液10mL加入浓度为10-5mol/L的NaOH溶液100mL后的溶液
7.在相同温度下,在水中分别加入下列物质,若用Kw表示水的离子积,α表示水的电离度,则能使α/Kw值增大的是
A Na2CO3 B NaHSO4 C NaOH D AI2(SO4)3
8.在25℃时,浓度均为1 mol·L-1 的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2(硫酸亚铁铵)三种溶液中,测得其中[NH4+]分别为 a、b、c(mol/L),则下列判断正确的是
A a>b>c B c>a>b C b>a>c D a>c>b
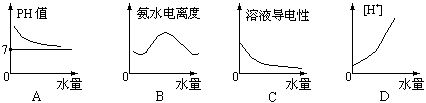
9.25℃时将水不断滴入0.1mol/L的氨水中,下列变化的图象合理的是
10.某酸的酸式盐NaHY在水溶液中,HY-的电离度小于HY-的水解程度。有关的叙述中,正确的是
A H2Y在电离时为:H2Y+H2O![]() HY-+H3O+
HY-+H3O+
B 在该盐的溶液中,离子浓度为:〔Na+〕>〔Y2-〕>〔HY-〕>〔OH-〕>〔H+〕
C 在该盐的溶液中,离子浓度为:〔Na+〕>〔HY-〕>〔OH-〕>〔H+〕
D HY-的水解方程式为:HY-+ H2O![]() H3O++Y2-
H3O++Y2-
11. 设NA为阿伏加德罗常数,下列说法正确的是
A 1L0.1mol/L的Na2CO3溶液中,含Na+0.2 NA个,CO32-0.1 NA个
B 1L0.3mol/L的K2SO4溶液中,含K+和SO42-离子总数为0.9 NA个
C 2L0.6mol/L的Fe2(SO4)3溶液中,含SO42-离子总数为2.4 NA个
D 0.1mol/L的H3PO4溶液中,[H+]∶[PO43-]<3∶1
12.将0.2mol/LCH3COOK与0.1mol/L盐酸等体积混合,溶液中下列微粒物质的量的浓度关系正确的是
A [CH3COO-]=[Cl-]=[H+]>[CH3COOH]
B [CH3COO-]>[Cl-]>[CH3COOH]> [H+]
C [CH3COO-]>[Cl-]>[H+]>[CH3COOH]
D [CH3COO-]+[Cl-]+[OH-]=[H+]+[K+]
13.在等物质的量浓度的两种弱酸的钠盐(NaR、Na![]() )溶液中分别通入适量的CO2,发生如下反应: NaR+CO2+H2O=HR+NaHCO3
)溶液中分别通入适量的CO2,发生如下反应: NaR+CO2+H2O=HR+NaHCO3
2Na![]() +CO2+H2O==2H
+CO2+H2O==2H![]() +Na2CO3
+Na2CO3
把HR和H![]() 在水中电离出H+的能力作比较,正确的判断是
在水中电离出H+的能力作比较,正确的判断是
A HR较强 B H![]() 较强 C 两者相同 D 无法比较
较强 C 两者相同 D 无法比较
14.在相同温度下,等体积等物质的量的浓度的4种稀溶液:①Na2SO4、②H2SO4、③NaHSO4、④Na2S中所含带电微粒数由多到少的顺序是
A ①=④>③=② B ④=①>③>②
C ①>④>③>② D ④>①>③>②
15.有一混合液可能由NaOH、NaHCO3、Na2CO3中的一种或两种组成。现取等体积的两份上述溶液分别以酚酞和甲基橙为指示剂,用同样浓度的盐酸进行滴定,当达到滴定终点时,消耗盐酸的体积分别为V1mL和V2mL,如V1<V2<2V1,则上述溶液中的溶质是
A NaHCO3 B Na2CO3 C Na2CO3、NaHCO3 D Na2CO3、NaOH
阳泉一中高考化学复习单元过关-《电离平衡》
班级 姓名 成绩
选择题答题卡
| 1 |
| 2 |
| 3 |
| 4 |
| 5 |
| 6 |
| 7 |
| 8 |
|
| 9 |
| 10 |
| 11 |
| 12 |
| 13 |
| 14 |
| 15 |
|
| |
二、填空题(共22分)
16.(4分)按要求写出下列离子方程式:
(1)将NH4Cl加入到重水中 。
(2)由FeCl3制Fe(OH)3胶体 。
17. (9分)将明矾晶体溶于水后,在溶液中滴入甲基橙试液,溶液显 色,有关的离子方程式为 ;若在溶液中加入饱和小苏打溶液,则观察到的现象是 ,有关的离子方程式为 。工业上常用明矾和纯碱作膨化剂,因为两者发生了反应,并在受热时生成 气体,有关的离子方程式为 。
18. (3分)已知①ZnCl2·xH2O易溶于水,且其水溶液呈酸性;②SOCl2极易与水发生下列反应:SOCl2+H2O=SO2+2HCl。实验室制取无水氯化锌是将ZnCl2·xH2O与SOCl2混合加热的方法。试回答:
(1) 混合加热时发生的化学方程式:
;
(2)SOCl2的作用是 。
19.(6分)PH=2的某酸HnA(A为酸根)与pH=12的某碱B(OH)m等体积混合,恰好反应生成正盐,混合溶液的pH=8。
(1)反应生成正盐的化学式为 。
(2)该盐中 离子(填离子符号)一定能水解,其水解的离子方程式为 。
三、实验题(共8分)
20.(7分)某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶
液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视_______________。直到因加入一滴盐酸后,溶液由黄色变为橙色,并_______________为止。
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________
(A)酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
(B)滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
 (C)酸式滴定管在滴定前有气泡,滴定后气泡消失
(C)酸式滴定管在滴定前有气泡,滴定后气泡消失
(D)读取盐酸体积时,开始仰视读数,滴定结束时俯
视读数
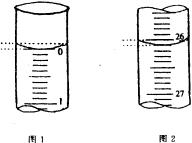
(3)若滴定开始和结束时,酸式滴定管中的液面如
图所示:
则起始读数为_________mL,终点读数为_____________mL;
所用盐酸溶液的体积为______________ mL。
(4)某学生根据三次实验分别记录有关数据如下表:
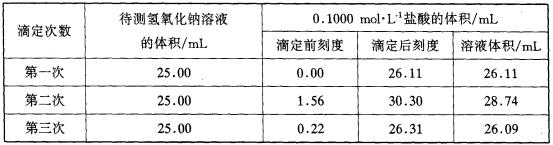
请选用其中合理的数据列式计算该氢氧化钠溶液的物质的量浓度:
c(NaOH)=
四、计算题(共10分)
20.在25℃时,有pH=a的醋酸与pH=b的NaOH溶液,取VaL该醋酸同该NaOH溶液恰好反应,需VbLNaOH溶液,问:
(1)若a+b=14时,则Va/Vb= (填数值);
(2)若a+b=13时,则Va/Vb= (填数值);
(3)若a+b>14时,则Va/Vb= (填表达式),且Va Vb(填>、<或=)。
21.向50mL0.018mol/L的AgNO3溶液中,加入50mL0.02mol/L的盐酸,生成了沉淀。如果溶液中[Ag+]、[Cl-]的乘积是一个常数:[Ag+][Cl-]=1.0×10-10,求:
(1)沉淀生成后溶液中[Ag+]是多少?
(2)沉淀生成后溶液的pH值是多少?