高考化学模拟考试试卷
化学试卷
可能用到的相对原子质量:H—1 He—4 C—12 O—16 Na—23 Br-80 S-32
Cu-64 Na-23 N-14 Al—27 K—39 Fe—56 Cu—64
第Ⅰ卷(选择题 共48分)
一.选择题(本题共5小题, 每小题4分, 共20分, 每小题只有一个选项符合题意)
1.据报道,德国某公司研究出无辐射冷却技术(用水和冰组成的物质代替传统的氟里昂或氨),荣获利国环境大奖。关于这种新制冷剂,以下叙述不正确是 ( )
A、该制冷剂对环境不产生任何污染
B、该制冷剂在不的凝固点附近的温度下发挥作用
C、该制冷剂具有与水不同的化学性质
D、该制冷剂的作用原理与液氨基本相同
2.萘环上的碳原子的编号如(Ⅰ)式,根据系统命名法,(Ⅱ)式可称为2-硝基萘,则化合物(Ⅲ)的名称应是
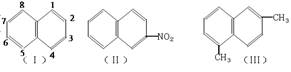
A.2,6-二甲基萘 B.1,4-二甲基萘 C.4,7-二甲基萘 D.1,6-二甲基萘
3.下列说法正确的是 ( )
A、任何酸或碱对水的电离都有抑制作用
![]() B、常温下,碱性溶液中,Na+、S2-、ClO-、NO3-能够大量共存
B、常温下,碱性溶液中,Na+、S2-、ClO-、NO3-能够大量共存
C、化合物 与溴化氢发生加成反应,所得产物最多有四种
D、常温时,能与水反应的金属,不能用氢气还原其氧化物的方法来制备
4.分子式为C4H8的单烯烃在一定条件下,按照烯烃复分解反应最多能生成新的单烯烃多少种? ( )
A、5种 B、6种 C、7种 D、8种
5.最新研究表明,火山喷发中产生的羰基硫(COS)与生命起源有关,下列有关羰基硫的说法肯定错误的是 ( )
A、羰基硫不能作为灭火剂 B、羰基硫的沸点比二氧化碳低
C、羰基硫可被氢氧化钾溶液吸收 D、羰基硫晶体属于含有极性键的分子晶体
二、选择题(本题包括7小题,每小题4分,共,28分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
6.1,5-戊二醛(简称GA),是一种重要的饱和直链二元醛。2%的GA溶液具有广谱、高效、无刺激、无腐蚀等特点,对禽流感、口蹄疫、猪瘟等疾病有良好的防治作用。根据上述信息,判断下列说法中正确的是
A. 戊二醛分子式为C5H10O2,符合此分子式的二元醛有4种
B. 戊二醛不能在加热条件下和新制备的氢氧化铜反应
C.戊二醛不能使酸性KMnO4溶液褪色
D.2%的GA溶液能破坏菌体蛋白质,杀死微生物,具有消毒杀菌作用
7.500ml KNO3和Cu(NO3)2 的混合溶液中C(NO3—)=6.0mol·L-1 ,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标况下),假定电解后溶液体积仍为500mL,下列说法正确的是
A.原混合溶液中C(K+)为2mol·L-1
B.上述电解过程中共转移4mol电子
C.电解得到的Cu的物质的量为0.5mol
D.电解后溶液中C(H+)为2mol·L-1
8.短周期元素A、B、C,原子序数依次递增。已知:A、C同主族,而且三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半。下列叙述正确的是
A.原子半径:A<B<C
B.2.32g四氧化三铁与足量的B完全反应转移0.09mol电子
C.常温下B的硫酸盐溶液pH<7
D.等质量B单质分别与足量A、C单质反应时前者反应放出的热量多
9.已知:⑴胆矾失水的热化学反应方程式为:
CuSO4·5H2O(s)=CuSO4(s)+5H2O(l);△H=+Q1kJ/mol
⑵室温下,无水硫酸铜溶于水的热化学方程式为:
CuSO4(s)= Cu2+(aq)+SO42-(aq);△H=-Q2kJ/mol
⑶胆矾(CuSO4·5H2O)溶于水时,溶液温度降低。
则Q1与Q2的关系是(Q1、Q2为正数)
A.Q1>Q2 B.Q1=Q2 C.Q1<Q2 D.无法确定
10.有一定质量的KNO3样品,在100C下加蒸馏水使之充分溶解,残留固体的质量为250g。该实验在400C下进行时,残留固体质量为120g,700C时为20g。已知KNO3在不同温度下的溶解度:
| 温度 | 100C | 400C | 550C | 700C |
| 溶解度 | 20g | 65g | 100g | 140g |
下列对该样品的推断正确的是
A.样品为纯净物 B.样品中混有不溶于水的杂质
C.样品中混有溶解度较大的杂质 D.当温度在550C左右时KNO3完全溶解
11.现有下列四个图像:
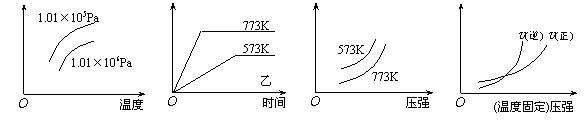 |
下列反应中全部符合上述图像的反应是
A.N2(g)+3H2(g) ![]() 2NH3(g);△H=-Q1kJ/mol(Q1>0)
2NH3(g);△H=-Q1kJ/mol(Q1>0)
B.2SO3(g) ![]() 2SO2(g)+O2(g);△H=+Q2 kJ/mol(Q2>0)
2SO2(g)+O2(g);△H=+Q2 kJ/mol(Q2>0)
C.4NH3(g)+5O2(g) ![]() 4NO+6H2O(g);△H=-808.7
kJ/mol
4NO+6H2O(g);△H=-808.7
kJ/mol
D.C(s)+CO2(g) ![]() 2CO(g);△H=+171.4kJ/mol
2CO(g);△H=+171.4kJ/mol
12.分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:
MxFey(CN)z],研究表明它的结构特性是:Fe2+和Fe3+分别占据立方
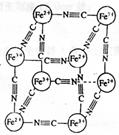 体的顶点,自身互不相邻,而CN—位于立方体的棱上。其晶体中的
体的顶点,自身互不相邻,而CN—位于立方体的棱上。其晶体中的
阴离子晶胞结构如图示,下列说法不正确的是
A.该晶体是离子晶体
B.M的离子位于上述晶胞面心,呈+2价
C.M的离子位于上述晶胞体心,呈+1价,且M+空缺率为
50%(体心中没有M+占总体心的百分比)
D.晶体的化学式可表示为M1Fe2(CN)6,且M为+1价
第Ⅱ卷(非选择题 共102分)
三、填空题(本题包括3小题,共30分)
13.(8分)在0.1mol/LNa3PO4溶液中,存在着多种离子,请你写出四个关于这些离子浓度关系的恒等式:
______________________________
______________________________
_____________________________
______________________________。
14.
![]() (12分)一定温度下,向如图所示的带有可移动活塞的密闭容器中充入2 L SO2 和1 L O2 的混合气体,发生如下反应:2 SO2 (g) + O2 (g) 2SO3
(g) 。
(12分)一定温度下,向如图所示的带有可移动活塞的密闭容器中充入2 L SO2 和1 L O2 的混合气体,发生如下反应:2 SO2 (g) + O2 (g) 2SO3
(g) 。
(1)若活塞可自由移动,平衡后,活塞停止在“2.1”处,容器内,V(SO3)=_____________L;该反应中SO2 的转化率为________。
(2)若开始时,充入容器的起始物质分别是①2 L SO2 和1 L O2 ;②2 L SO3 (g) 和 1 L N2 ;③1 L SO2 、1 L O2 和 1 L SO3 (g),使活塞固定在“3”处,达到平衡后,容器中SO3 (g)的体积分数大小关系是 (用序号和“<”、“=”、“>”表示)。
(3)向(1)平衡后的容器中充入0.2 mol 的SO3,活塞移动后再次达到平衡时,测得此过程中从外界共吸收了1.96 kJ 的热量,写出SO2 发生氧化反应的热化学方程
_____________________________________________________________。
15.(10分)(1)写出第四周期18种元素的元素符号和名称:
元素符号:_________________________________
名称 :_________________________________
(2)原子序数为24、29的原子的电子排布式_________、_________
(3)114号元素所元素周期表中的位置是第____周期、第____族
四、实验题(本题包括2小题,共26分)
16.画出6种用于在化学实验中防倒吸装置(12分)
1._____________、2________________
3、_____________、4、_______________
5、_____________、6、_______________。
17.(14分)工业苯酚纯度的测定过程如下:准确称取0.2g工业用苯酚于盛有5mL10%NaOH溶液的100mL烧杯中,再加少量水溶解,然后定量转入250mL容量瓶中,再用水稀释到刻度,混匀后,准确吸取此溶液20mL于碘量瓶(带玻璃塞)中,再加入物质的量之比为1:5.5的KBrO3-KBr标准溶液10mL于碘量瓶中(其中KBrO3的浓度为0.02mol/L),并加足量的盐酸酸化,用塞子塞紧碘量瓶振荡1-2min,静置5min,此时生成三溴苯酚白色沉淀和Br2,再迅速加入10%KI溶液10mL,摇匀后静置5min,并用少量水冲洗瓶塞及瓶颈上附着物,加2mL0.5%淀粉溶液,用0.05mol/LNa2S2O3标准溶液滴定到终点,记下消耗的Na2S2O3标准溶液的体积为V。已知碘和硫代硫酸钠的反应为I2+2S2O32-=2I-+S4O62-,请回答下列问题:
(1)0.2g苯酚为何先溶于NaOH溶液?
____________________________________________________________________________。
(2)写出所有的化学方程式_______________________________________________________
____________________________________________________________________________。
(3)为何用碘量瓶不用锥形瓶?__________________________________________________。
(4)为何在配制250mLKBrO3-KBr溶液时采用物质的量之比为1:5.5不是1:5?
_________________________________________________________________________。
(5)为什么不直接用浓溴水直接滴定苯酚溶液测工业用苯酚的含量?
__________________________________________________________________________。
(6)工业苯酚的纯度为__________________________________
五.有机题(本题包括两小题,共21分)
18.瑞士昆虫学家保罗•米勒因合成DDT于1948年获得诺贝尔生理医学奖。联合国世界卫生组织曾评价说:“单独从疟疾看,DDT可能拯救了5000万生命”。但进一步的观察与研究表明,DDT是一种难降解的有毒化合物,进入人体内可引起慢性中毒,我国于1983年停止生产和使用DDT。DDT可以用电石为原料经以下途径制得。
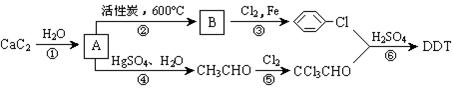
(1)写出A、B的结构简式:A ,B 。
(2)写出第⑤步反应的化学方程式: _________________。
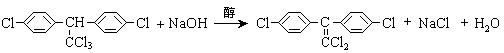
(3)杀虫剂“1605”属于硫代磷酸酯,本身对人畜毒性远强于DDT,但DDT已经被禁用,而“1605”尚未禁用,这是因为 _________。
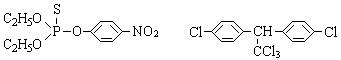
(a)杀虫剂“1605” (b)杀虫剂DDT
由结构简式分析可知:“1605”在使用过程中,不能与 物质混合使用,否则会因
而失效。
(4)DDT有毒性,国际上已禁止使用,因为它在动物体内转化为一种使动物生长失调的物质(![]() )。在实验室中DDT在NaOH醇溶液的作用下也可实现这种转化。表示这种转化的化学方程式为
_________________________。
)。在实验室中DDT在NaOH醇溶液的作用下也可实现这种转化。表示这种转化的化学方程式为
_________________________。
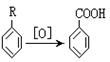 |
19.已知:烷基苯在酸性高锰酸钾的作用下,侧链被氧化成羧基:
高分子化合物G可以通过B和F发生缩聚反应而制得。现通过如下转化关系合成G:
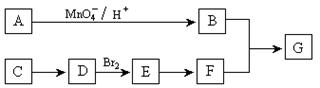 |
其中:
① A是分子式为C8H10的芳香烃,只能生成两种一溴代物,B有酸性。
② 0.01mol的C蒸气(质量为0.46 g)在足量的氧气中完全燃烧,只生成0.88g CO2和0.54g H2O。
请完成下列问题:
(1)A的同分异构体的结构简式为 ,
C的分子式为 。
(2)写出下列反应的化学方程式(有机物用结构简式表示):
C→D: __________________________;
B + F→G: ______________________________。
(3)指出下列反应的反应类型:
D→E: ;E→F: 。
(4)C和F的关系是
① 同系物 ② 同分异构体 ③ 同类物质 ④ 同种物质
六、(本大题包括3小题,共25分)
20、(10分)已知C、D、F、I均为常见气体,E为常见金属,G溶液蒸干并灼热得红棕色粉末H,I是一种能导致温室效应的气体,B由三种元素组成。它们有如下框图关系:
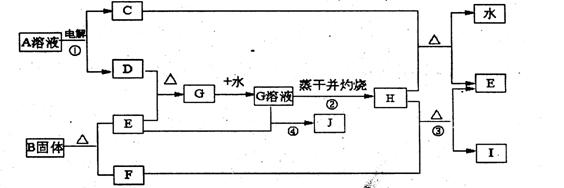
试回答下列问题
(1)反应①阳极的电极反应式 。
(2)反应③的化学方程式 。
(3)反应④的离子方程式 。
(4)反应②蒸发至于并灼烧最终得H而不是无水的G,试用文字和方程式简述其理由:
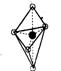
(5)已知B的结构为三角双锥(如右图示),图中○代表F分子,●代表E原子,
写出B的化学式 。
21、(8分)某温度下,一定量的某Na2SO3溶液的溶质质量分数为20%,在该溶液中加入1g Na2SO3·7H2O晶体后成为饱和溶液,此时溶液的体积为15.0mL,溶质质量分数为22%。试求:
(1)该温度下亚硫酸钠的溶解度。
(2)此时亚硫酸钠的物质的量浓度。
22、(7分) 铜与某一浓度的硝酸反应放出混合气体100mL(忽略水蒸气),该混合气体的密度是相同状况下氢气密度的26.7倍,将此气体在密闭条件下用水充分吸收后,体积还有70mL(体积都在标准状况下测定).
(1)计算混合气体各组成的体积.
(2)反应消耗铜多少克?
参考答案:
| 1 | 2 | 3 | 4 | 5 | ||
| C | D | D | C | B | ||
| 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| D | AB | CD | A | BD | BD | B |
![]() 18.(1)CH ≡ CH (1分), (1分)(2)CH3CHO
+ 3Cl2 →CCl3CHO + 3HCl(2分)
18.(1)CH ≡ CH (1分), (1分)(2)CH3CHO
+ 3Cl2 →CCl3CHO + 3HCl(2分)
 (3)“1605”可以水解成小分子(1分)。碱性(1分),水解(1分)。
(3)“1605”可以水解成小分子(1分)。碱性(1分),水解(1分)。
(4)
 (2分)
(2分)
19.(1)(3分)C2H6O(或CH3CH2OH)(1分)
 |
![]() (2)CH3CH2OH
CH2 = CH2 ↑+ H2O(2分)
(2)CH3CH2OH
CH2 = CH2 ↑+ H2O(2分)
(2分)
(3)加成反应(1分);取代反应(1分) (4)③(1分)
20.⑴ 2Cl--2e-==C12↑ (2分) ⑵ Fe2O3+3CO==
|
|
|
|
⑷ FeCl3溶液中存在FeCl3+3H2O![]() Fe (OH)3+3HCl,加热促进水解,又由于生成的氯化氢气体不断挥发,使水解完全,生成的Fe(OH)3灼烧时发生分解2Fe(OH)3====
Fe2O3十3H2O,所以得到的是Fe2O3,得不到无水FeCl3,(共2分,答出要点,但未写出方程式的给1分)
Fe (OH)3+3HCl,加热促进水解,又由于生成的氯化氢气体不断挥发,使水解完全,生成的Fe(OH)3灼烧时发生分解2Fe(OH)3====
Fe2O3十3H2O,所以得到的是Fe2O3,得不到无水FeCl3,(共2分,答出要点,但未写出方程式的给1分)
 ⑸ Fe(CO)5或者FeC5O5 (2分)
⑸ Fe(CO)5或者FeC5O5 (2分)
21.⑴ 28.2 g (4分) ⑵ 1.75 mol/L (4分)
分析:式量判断,极限分析定为三种气体的混合气体.联立方程组.
![]()
![]() +
+![]() +(100-x-y)=70
+(100-x-y)=70
![]()
解得:NO2 N2O4 及NO的体积分别为30mL,30mL,40