高考化学试卷(四)
一、选择题:
每小题只有一个选项符合题意。
可能用到的原子量:
H 1 He 4 C12 N 14 O 16 Na 23
Mg24 Al 27 S32 Cl35.5 Zn 65
1. 由0.2 克氢气、2.8 克氮气、0.4 克氦气和3.2克氧气所组成的混合气体,
在0℃、1.01×10![]() 帕时的体积是 ( )
帕时的体积是 ( )
(A) 7.84升 (B) 8.96升
(C) 15.68升 (D) 17.92升
〖分析〗 在标准状态下,1摩尔的气体的体积都是22.4升。
2. 关于氢元素的叙述,不正确的是( )
(A) 自然界中的氢元素有三种同位素,它们的性质完全相同。
(B) 三种同位素在化学反应中均易失去一个电子而呈现出+1价。
(C) ![]() 的原子失去一个电子后,变成一个质子。
的原子失去一个电子后,变成一个质子。
(D) 氢在周期表中与碱金属同属ⅠA族。
3. 下面说法正确的是( )
(A) 物质在固态时有阳离子就一定有阴离子。
(B) N![]() 表示阿伏加德罗常数,1摩尔Na2O2与水反应只有N
表示阿伏加德罗常数,1摩尔Na2O2与水反应只有N![]() 个电子发生转移。
个电子发生转移。
(C) 标准状况下,0.1摩尔SO3 体积为2240毫升。
(D) 溶液中两种盐反应不会出现气体。
4. 下列各组化合物都属于纯净物的是( )
(A) 电石、萤石、重晶石、金刚石。
(B) 液氨、液溴、溴乙烷、蚁酸。
(C) 冰醋酸、冰晶石、水晶、干冰。
(D) 硬水、硬脂酸、硬化油、电木。
5. 能使酸性高锰酸钾溶液褪色,又能使溴水褪色,且使石蕊试液变蓝色的是( )
(A) 二氧化硫 (B) 苯酚
(C) 丙烯酸 (D) 油酸钠
6. 在常温下,在100克饱和的硫酸铜溶液中,加入5克硫酸铜白色粉末,充分搅拌并静
置后,下列叙述正确的是( )
(A) 溶液浓度和溶液质量均不变 (B) 溶液浓度不变,溶液质量增加
(C) 溶液浓度不变,溶液质量减少 (D) 溶液浓度和溶液质量均增加
7. 既能跟强酸溶液反应,又能跟强碱溶液反应,而且有无色气体放出的是( )
(A) Zn (B) AL(OH)3
(C) KHS (D) CH3CHCOOH
NH2
8. 下面的说法或表示方法不正确的是( )
(A) NaH2PO4、Na2HPO4、Na3PO4不可能在高浓度时存在.
(B) 硫化氢溶于水:H2S + H2O = H3O![]() + HS
+ HS![]()
(C) 硫酸氢钾溶液与醋酸钠共热:
KHSO4 + CH3COONa
![]() KNaSO4
+ CH3COOH
KNaSO4
+ CH3COOH
(D) 在稀NaH2PO4溶液滴入过量的石灰水:
3H2PO![]() + 3Ca
+ 3Ca![]() + 6OH
+ 6OH![]() = Ca2(PO4)3↓+ PO
= Ca2(PO4)3↓+ PO![]() + 6H2O
+ 6H2O
9. 能在水溶液中大量共存,加入OH![]() 至碱性时, 有沉淀生成的一组离子是( )
至碱性时, 有沉淀生成的一组离子是( )
(A) Na![]() 、Ca
、Ca![]() 、Cl
、Cl![]() 、H2PO
、H2PO![]()
(B) K![]() 、Al
、Al![]() 、Cl
、Cl![]() 、HCO
、HCO![]()
(C) Mg![]() 、Al
、Al![]() 、SO
、SO![]() 、AlO
、AlO![]()
(D) Ca![]() 、Fe
、Fe![]() 、Cl
、Cl![]() 、I
、I![]()
10. 某碱金属氧化物的分子量为a,相同价态的该金属的硫酸盐的分子量为b,
则该金属元素的化合价为( )
① ![]() ②
② ![]() ③
③ ![]() ④
④ ![]()
(A) ①、② (B) ②、③
(C) ②、④ (D) ③、④
11. 下列方程式正确的是( )
① 氯气通入氢硫酸中:Cl2 + S![]() = 2Cl
= 2Cl![]() + S↓
+ S↓
② 在醋酸溶液中加入氨水:CH3COOH + OH![]() = CH3COO
= CH3COO![]() + H2O
+ H2O
③ 4FeS2 + 11O2 ![]() 2Fe2O3
+ 8SO2
2Fe2O3
+ 8SO2
④ 2H2S + H2SO3 = 3S↓ + 3H2O
(A) ①、② (B) ②、③
(C) ②、④ (D) ③、④
12. 将4.8克镁粉投入到0.5摩尔稀硝酸中,恰好完全反应,则还原产物( )
① 可能是N2O ② 可能是NO
③ 可能是NH4NO3 ④ 一定是N2O
(A) ①、③ (B) ②、③
(C) ②、④ (D) ③、④
13. 一个![]() 原子的质量为m 克,阿伏加德罗常数为N
原子的质量为m 克,阿伏加德罗常数为N![]() ,下列式子可表示1个
,下列式子可表示1个![]() 原子质
原子质
量的是( )
① ![]() 克 ②
克 ② ![]() 克 ③
克 ③ ![]() 克 ④ mN
克 ④ mN![]() 克
克
(A) ①、② (B) ②、③
(C) ①、③ (D) ③、④
14. 完全燃烧一定质量的无水酒精,放出的热量为Q,完全吸收生成的二氧化碳,
消耗8.0摩/升的氢氧化钠溶液50毫升。则燃烧1摩尔酒精放出的热量是( )
(A) 0.2Q (B) 0.1Q
(C) 5Q (D) 10Q
15. 在3NO2 + H2O = 2HNO3 + NO 的平衡体系中,能使平衡充分向右移动且使反应趋于完全
的是( )
① NO2 ② O2 ③ NaOH ④ SO2
(A) ①、② (B) ②、③
(C) ①、③ (D) ③、④
16. 已知Pb 的原子序数为82,再发现与Pb 同一主族的元素R,它的原子序数应为( )
(A) 90 (B) 100
(C) 114 (D) 132
17. 在某未知溶液中加入CH3COONa晶体后,测得[Na![]() ]:[CH3COO
]:[CH3COO![]() ]
]
接近1:1,对未知溶液的判断正确的是( )
① 可能是强酸性溶液
② 可能是强碱性溶液
③ 可能是中性溶液
④ 未知溶液中可能已有部分CH![]() COO
COO![]() 离子,并且[Na
离子,并且[Na![]() ]:[CH
]:[CH![]() COO
COO![]() ]<1
]<1
(A) ①、② (B) ①、③
(C) ②、③ (D) ②、④
18. 下列物质的稀溶液,用铂电极电解5分钟后,用适量蒸馏水稀释电解后的溶液,
能恢复到电解前状态的是( )
① CuCl![]() ② H
② H![]() SO
SO![]()
③ Na![]() SO
SO![]() ④ AgNO
④ AgNO![]()
(A) ①、② (B) ①、③
(C) ②、③ (D) ②、④
19. 25℃时,0.1摩/升的氢氰酸(HCN)溶液,达到电离平衡时,电离度是0.01%,
下列有关说法中错误的是( )
① 平衡时溶液的PH值等于4
② 平衡时酸电离出的氢离子浓度约为水电离出氢离子浓度的1万倍
③ 若升高温度,溶液的PH值变大
④ 若用体积、浓度均相等的氢氧化钠溶液与之反应,所得溶液的PH值大于7
(A) ①、② (B) ①、③
(C) ②、③ (D) ②、④
20. 在氯化镁溶液中加入少量的以下几种物质,能使氯化镁溶液PH值变大的是( )
① 氯化铵固体 ② 氨水
③ 盐酸 ④ 碳酸钠固体
(A) ①、② (B) ①、③
(C) ②、③ (D) ②、④
21. 在2摩/升的盐酸、硫酸各100毫升中,分别加入适量的铁粉,反应后生成的气体的
质量比为2:3,则在盐酸中加入的铁粉为( )
(A) 2.8 克 (B) 5.6 克
(C) 8.4 克 (D) 16.8 克
22. 下列各组溶液,不用任何试剂,也不能加热就可以加以鉴别的一组是( )
(A) H![]() PO
PO![]() 和 AgNO
和 AgNO![]() (B) BaCl
(B) BaCl![]() 和 H
和 H![]() SO
SO![]()
(C) NaAlO![]() 和 H
和 H![]() SO
SO![]() (D) Ca(OH)
(D) Ca(OH)![]() 和 Na
和 Na![]() CO
CO![]()
23. 有1摩尔以等物质的量混和的饱和一元羧酸与饱和一元羧酸的一元醇酯的混和物,完全
燃烧需2摩尔O![]() ,则此饱和一元羧酸和饱和一元羧酸的一元醇酯不可能是( )
,则此饱和一元羧酸和饱和一元羧酸的一元醇酯不可能是( )
① HCOOH 和 C![]() H
H![]() COOCH
COOCH![]() ② HCOOH 和 HCOOC
② HCOOH 和 HCOOC![]() H
H![]()
③ CH![]() COOH 和 HCOOCH
COOH 和 HCOOCH![]() ④ CH
④ CH![]() COOH 和 CH
COOH 和 CH![]() COOCH
COOCH![]()
(A) ① 和 ③ (B) ② 和 ③
(C) ② 和 ④ (D) ① 和 ②
24. 二硫化碳(CS![]() )能在氧气中完全燃烧生成CO
)能在氧气中完全燃烧生成CO![]() 和SO
和SO![]() , 今用0.228克CS
, 今用0.228克CS![]() 在448
在448
毫升氧气中完全燃烧,反应后气体混和物的体积是(标准状况下) ( )
(A) 112毫升 (B) 224毫升
(C) 336毫升 (D) 448毫升
25. 在调整好的天平左右两盘中各放一只大小和质量均相同的烧杯,两只烧杯中都盛有2摩/升的稀硫酸50毫升,然后分别向烧杯中加入下列各组物质,充分反应后天平仍保持平衡的是( )
(A) 左10克锌,右10克铁
(B) 左10克Na![]() CO
CO![]() , 右10克Na
, 右10克Na![]() SO
SO![]()
(C) 左2克锌,右2克铁
(D) 左0.5克镁,右0.5克铝
26. 体积为V(毫升),密度ρ(克/厘米![]() )的溶液,含有分子量为M的溶质m克,其摩尔浓
)的溶液,含有分子量为M的溶质m克,其摩尔浓
度为c摩/升,质量百分比浓度为w%。下列表示式中正确的是 ( $S*B$ )
(A) ![]() (B)
(B)
![]()
(C) ![]() (D)
(D)
![]()
二、填空题:
|
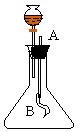
1. 如图所示,在250毫升的锥形瓶中,充满某种无色、有刺激性气味的气体,分液漏斗中装有NaOH溶液并滴加了酚酞指示剂。导管的A端通大气,B端捆有一小气囊。在标准状况下进行如下实验:开启分液漏斗活塞,滴加10毫升溶液时只见气球迅速胀大,溶液也恰好由红色变为无色。 |
则原来在锥形瓶中装有的气体是(填名称)___________________,
发生上述现象的原因是: __________________________________,
分液漏斗中的NaOH溶液摩尔浓度不超过______________________。
〖解答〗:
2. 某同学在实验室里,制备乙烯气体。进行了如下的实验操作:
①、检查了制备装置的气密性。
②、在烧瓶中加入10毫升浓硫酸,再加入无水酒精10毫升后把整个装置固定好。
③、加热至沸腾后,用向上排气法收集乙烯气体。
根据该同学的实验操作和发生的有关现象,填写下列空白:
(1). 该同学在上述①--③的操作中的错误是:
a、_________________________________________________________________,
b、_________________________________________________________________,
c、_________________________________________________________________。
(2). 在加热的烧瓶中,常放入一些碎玻璃片,它的作用是__________________________。
(3). 实验中,所用温度计应放的位置是__________________________________________。
(4). 实验中,烧瓶内的液体常变成棕黑色,再加强热并会有刺激性的气体产生。
写出发生此变化的化学反应方程式__________________________________________。
3. 将足量的硫放在成为盛有空气的瓶子里燃烧,再向瓶内注入少量热的蒸馏水和少量HNO![]() 的溶液,并滴1--3滴
BaCl
的溶液,并滴1--3滴
BaCl![]() 溶液,振荡,发现液体有些浑浊,你对这一现象的解释是(用方程式表示):
溶液,振荡,发现液体有些浑浊,你对这一现象的解释是(用方程式表示):
___________________________________,_______________________________________,
___________________________________,_______________________________________。
4. A,B,C,D四种化合物,它们的化学式都符合RX2型。组成这四种化合物的元素的原子序数都不超过20。构成这四种化合物的化学键为:A,B只有共价键,A熔点很低,B却熔点很高。C只有离子键,D既有离子键又有共价键。
A和C都难与各种氢卤酸反应;B、C都难深于水,D却与水剧烈反应。
A能在空气里烯烧,B、C、D则不能。
B可与某种氢卤酸反应,所产生的气体不能燃烧;
D可与各种氢卤酸反应,所产生的气体极易燃烧。
根据上述进行判断:
(1). 写出四种化合物的分子式:
A______________; B_____________; C_____________; D_____________。
(2). 写出有关化学反应方程式:
a. A在空气中燃烧: _____________________________________________,
b. B与氢卤酸反应: _____________________________________________,
c. C与水反应: _________________________________________________。
5. 实验室制取甲烷气体,进行如下的操作:
1.在干燥的大试管中,放入适量的晶体醋酸钠和NaOH固体的混和物。
2.将制备和收集装置固定好,小心加热,用排水集气法收集一瓶甲烷气体。
3.收集后,停止加热,将导管撤离水面。
请回答下列问题:
(1). 在上述三步实验的操作中,明显错误是什么?
[答]
(2). 请写出制备反应的化学方程式?
[答]
6. 碳氧化物中的一氧化碳(CO)是一种大气污染物。大量形成后,短时间难以消除。
其原因是?
[答]
7. 在一定条件下,CO可与氯化钯(PdCL2)溶液反应,有金属钯生成,溶液呈酸性。
试写出这一反应的方程式?
[答]
三、问答题:
1. 根据酸碱质子理论,酸给出质子后余下的部分就是碱,反过来,碱接受质子后即为酸;酸 <----> 碱+H![]() ,右边的碱是左边酸共轭碱,左边的酸又是右边碱的共轭酸。假定在某些条件下,NH
,右边的碱是左边酸共轭碱,左边的酸又是右边碱的共轭酸。假定在某些条件下,NH![]() 、H
、H![]() O、HF都是酸,写出它们的共轭碱的化学式并将其碱性按递减的顺序排列_________,_________,_________。
O、HF都是酸,写出它们的共轭碱的化学式并将其碱性按递减的顺序排列_________,_________,_________。
〖解答〗
2. 在500℃时,将某有机物的蒸气10毫升与30毫升氧气点燃后,恰好使它完全燃烧,生成的CO2 和水蒸气的体积比为2:3。当恢复到反应前状态时,燃烧后混和气的密度比原混和气体的密度减少![]() ,计算该有机物的分子式。并写出它可能的结构简式和名称。
,计算该有机物的分子式。并写出它可能的结构简式和名称。
〖解答〗
3. 标准状况下体积为1升,碳原子数为n和n+1的两种气态烷烃的混和物,
其质量为1.5克。
(1) 该两种烃是( )和( )。
(2) 体积百分含量各是( )。
(3) 如果没有碳原子数为n和n+1这个条件,还有哪些两种气态烃的组合( )。
4. 向某二价金属M的氢氧化物溶液中加入过量的NaHCO![]() 溶液,反应后生成该二价金属的碳酸盐,过滤后得沉淀物39.4克。此沉淀溶于足量盐酸中,生成的气体在标准状况下为4.48升。取滤液的
溶液,反应后生成该二价金属的碳酸盐,过滤后得沉淀物39.4克。此沉淀溶于足量盐酸中,生成的气体在标准状况下为4.48升。取滤液的![]() 升,恰与70毫升1摩/尔的盐酸完全反应,得到气体1.12升(标准状况)。
升,恰与70毫升1摩/尔的盐酸完全反应,得到气体1.12升(标准状况)。
试计算:(1) 沉淀物的物质的量。
〖解答〗
(2) 金属M的原子量。
〖解答〗
(3) 最初加入的NaHCO![]() 的质量。
的质量。
〖解答〗
参 考 答 案
一、
1. B 〖分析〗 在标准状态下,1摩尔的气体的体积都是22.4升。
2. A 3. B 4. C 5. D 6. C 7. A 8. D
9. A 10. C 11. D 12. A 13. C 14. C 15. B 16. C
17. D 18. C 19. B 20. D 21. C 22. C 23. C 24. D
25. A 26. B
二、
1.〖解答〗: 是氯化氢.
氯化氢与NaOH 溶液反应,瓶内的压强降低,气球与外界相通,所以膨胀。
NaOH与HCl恰好完全反应,溶液呈中性,故酚酞由红变无色。
不超过 12摩尔/升.
2.
(1).〖解答〗
a 应该先加浓硫酸. b 不应后检查气密性 c 未加热到170度。
(2).〖解答〗防止暴沸.
(3).〖解答〗插入反应的液体中.
(4).〖解答〗 C2H5OH + 2H2SO4 = 2C + 5H2O + 2SO2↑.
3.
〖解答〗:
S + O2 = SO2
SO2 + H2O = H2SO3
H2SO3 + HNO3 = H2SO4 + HNO2
H2SO4 + BaCl2 = BaSO4↓+ 2HCl.
4.
(1).〖解答〗
A:CS2 B:SiO2 C: CaF2 D: CaC2
(2).〖解答〗
a. CS2 + 3O2 = CO2 + 2SO2
b. SiO2 + 4HF = SiF4↑+ 2H2O
c. CaC2 + 2HCl = CaCl2 + C2H2 ↑
5.
(1).[答] 1. 不应该用醋酸钠晶体;
2. 不应该用小火加热;
3. 导管不应该后撤离水面。
(2). [答] CH3COONa
+ NaOH ![]() Na2CO3
+ CH4↑
Na2CO3
+ CH4↑
6.[答]原因是CO 的密度与空气相差不多,容易留在空气中;另外,
CO 非常难溶解于水中,也不易与其它物质反应,难于吸收。
7.[答]
化学方程式为:CO + PdCL2 + H2O = Pd + CO2 + 2HCL
三、
1.〖解答〗 NH![]() > OH
> OH![]() > F
> F![]()
2.〖解〗根据物质燃烧生成CO2与H2O蒸气的体积比为 2:3,所以物质碳氢比为1:3。
设有机物A为CmH3mOn
,则 ![]() +
+ ![]() → mCO2 +
→ mCO2 + ![]()
根据题意,
![]()
![]()
当 n=0, m=4 (舍去)
n=1, m=2
n=2, m=0 (舍去)
n=8, m=-2
所以 n=1,m=2 即C2H6O, 可能为乙醇或甲醚。
3.〖解答〗(1) 乙烷和丙烷
(2) 74.3% , 25.7%
(3) 甲烷 58.1% 丁烷 41.9%
4.〖解答〗
(1) M(OH)2 + 2NaHCO3 = MCO3↓+ Na2CO3 + H2O
(2) MCO3 + 2HCl = MCl2 + H2O + CO2↑
沉淀物的物质的量0.2 mol。
金属M的原子量 197 - 60 = 137.
NaHCO3 共 0.2 + 0.05×10 = 0.7 摩尔,即 58.8 克。