高考化学模拟考试试卷
化学(二)
试卷满分150分,完成时间120分钟;
可能用到的相对原子质量:C—12 H—1 O—16 N—14 Cu—64
S—32 I—127
第I卷(选择题,共64分)
一、 选择题(每小题只有一个选项符合题意,每小题4分,共32分)
1.最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”—全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是
A. 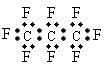 子中三个碳原子可能处于同一直线上
子中三个碳原子可能处于同一直线上
B. 氟丙烷的电子式为:
C.相同压强下,沸点:C3F8<C3H8
D.全氟丙烷分子中既有极性键又有非极性键
2.2004年4月20日,江苏扬州发生氨气泄漏事故。2005年以来,淮安、无锡等地又发生重大液氯泄漏事故。下列有关氯气、氨气的说法正确的是
A.氯气和氨气都是易液化的气体
B.氯气和氨气都是无色、密度比空气大的有毒气体
C.氯气和氨气都是由极性键构成的非极性分子
D.标况下,22.4L氯气和氢气混合气光照反应后,原子总数约为NA
3.市场上出现了各种各样的营养食盐,如:锌营养盐、钙营养盐、硒营养盐、低钠营养盐、加碘营养盐等十多种营养保健盐。下列说法正确的是:
A. 加碘食盐是在食盐中加入了碘单质
B. 钙营养盐是在食盐中加入了氯化钙或碳酸钙等含钙化合物
C. 低钠盐中的钠离子比氯离子少,所以低钠盐是一种带负电的物质
D.各类营养盐的主要成分都是氯化物
4.实验室里可通过以下反应来制取碘:
2NO + O2 = 2NO2,2H+ + 2I- + NO2 = NO + I2 + H2O。
在这一过程中,每制取1mol I2时,所消耗氧化剂的质量为
A.46g B.32g C.16 g D.28g
5.下列物质提纯、检验、保存的方法正确的是
A.液溴保存在橡皮塞的细口瓶中,并加水液封
B.SO2气体中的少量SO3气体,可用浓硫酸洗气除去
C.检验Na2SO4溶液中是否混有NaCl:加入AgNO3溶液,观察是否有白色沉淀
D.除去乙酸中混有的乙醇:加入生石灰后蒸馏
6.下列离子在溶液中能大量共存,加入(NH4)2Fe(SO4)2·6H2O晶体后,仍能大量共存的是
A.Na+ H+ Cl- NO3- B.K+ Ba+ OH- I-
C.Na+ Mg2+ Cl- SO42- D.Cu2+ S2- Br- ClO-
7.在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是
A.加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在
B.溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在
C.先加入盐酸酸化,再加入AgNO3溶液产生白色沉淀,说明有Cl-存在
D.加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
8.醋酸钡[(CH3COO)2Ba·H2O]是一种媒染剂,有关0.1mol/L醋酸钡溶液中粒子浓度比较不正确的是
A.c(Ba2+) >c(CH3COO-)>c(OH-)>c(H+)
B.c(H+)+2c(Ba2+)= c(CH3COO-)+c(OH-)
C.c(H+) = c(OH-)-c(CH3COOH)
D.2c(Ba2+)= c(CH3COO-)+ c(CH3COOH)
二、 选择题(每小题有1~2个选项符合题意,每小题4分,共32分)
9.广义的水解观认为,无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质。根据上述观点,下列说法不正确的是
A. CaO2的水解产物是Ca(OH)2和H2O2 B. NaClO的水解产物之一是HClO
C.PCl3的水解产物是PH3和HClO D.Mg3N2水解生成NH3和Mg(OH)2
10.已知:2Fe2++Br2===2Fe3++2Br-。在100mL FeBr2溶液中通入标准状况下3.36LCl2,Cl2全部被还原,测得溶液中c(Br-)= c(Cl-),则原FeBr2溶液的物质的量浓度是
A.0.75 mol/L B.1.5 mol/L C.2 mol/L D.3 mol/L
11.下列离子方程式正确的是:
A.向NH4HSO4的稀溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全:
NH4+ + H+ + SO42- + Ba2+ + 2OH- = NH3·H2O + BaSO4↓+ H2O
B.少量硝酸银溶液滴入稀氨水中:Ag+ + 2NH3·H2O ==Ag(NH3)2+ + 2H2O
C.向碳酸氢钙溶液中滴入少量澄清石灰水:
Ca2+ + 2HCO3- + 2OH- = CaCO3 + 2H2O + CO32-
D. 向次氯酸钠溶液中通入少量的二氧化硫气体:3ClO-+H2O+SO2=2HClO+SO42-+Cl-
12.锂离子电池的正极材料是锂过渡金属氧化物(例如LiCoO2)混以一定量的导电添加物(例如C)构成的混合导体,负极材料是可插入锂的碳负极。两极的电极反应式:
负极:LixC6→ C6+xLi++e-
 正极:Li0.5CoO2+0.5Li++0.5e-→LiCoO2。
正极:Li0.5CoO2+0.5Li++0.5e-→LiCoO2。
充、放电时电池中的变化简单表示为:LiCoO2![]() xLi++e-
xLi++e-![]() LixC6,其中表示充电过程的是
LixC6,其中表示充电过程的是
A.a-阳极变化、c-阴极变化 B.a-阳极变化、d-阴极变化
C.b-阳极变化、c-阴极变化 D.b-阳极变化、d-阴极变化
13.碘是卤素中原子半径较大的元素,可能呈现金属性.下列事实能够支持这个结论的是
A. 已经制得了I2O5等碘的氧化物
B. 在IBr、ICl等卤素互化物中碘元素表现正价
C. 已经制得了I(NO3)3、I(ClO4)3·2H2O等离子化合物
D. 碘(I2)易溶于KI等碘化物溶液,形成I3-
14.某研究性学习小组为了探索镁粉与溴水反应的机理,做了如下四组实验:①将镁粉投入冷水中,未见任何现象;②将镁粉放入溴水中,观察到只是开始时产生极少量的气泡,但溴水的颜色全逐渐褪色;③将镁粉放入液溴中.未观察到任何明显现象;④向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去。则下列关于镁与溴水的反应机理的论述中正确的是
A.镁粉只直接与溴水中的溴反应 B.镁粉只与溴水中的酸反应
C.产生极少量的气泡是由于镁粉与水反应得到 D.镁粉在水的催化下与溴发生反应
15.Cl2、SO2均能使品红溶液褪色。后者因为品红分子结构中的发色团遇到亚硫酸后结构发生改变,生成不稳定的无色化合物。其漂白原理可用下面的反应方程式表示:
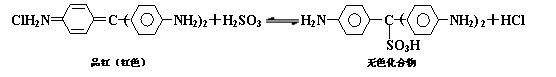 下列说法正确的是
下列说法正确的是
A. 品红溶液中同时通入Cl2、SO2,漂白效果会更好
B. 加热可判断品红褪色是通入SO2还是通入Cl2引起的
C.上述可逆反应中,正反应的△H>0
D.品红分子结构中,19个碳原子都可能在同一平面上
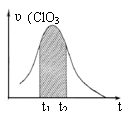 16.KClO3和KHSO3能发生反应:ClO3-+HSO3-→SO42-+ Cl-+ H+(未配平)。已知该反应的速率随c(H+)的增大而加快。右图为用ClO3-在单位时间内物质的量浓度变化表示的该反应υ-t图。下列说法正确的
16.KClO3和KHSO3能发生反应:ClO3-+HSO3-→SO42-+ Cl-+ H+(未配平)。已知该反应的速率随c(H+)的增大而加快。右图为用ClO3-在单位时间内物质的量浓度变化表示的该反应υ-t图。下列说法正确的
A.反应开始时速率增大可能是c(H+)所致
B.纵坐标为υ(Cl-)的υ-t曲线与图中曲线不能完全重合
C.后期速率υ下降的主要原因是反应向逆反应方向进行
D.图中阴影“面积”可以表示t1-t2时间内c(Cl-)增
选择题答案请一律填写在以下指定空格中:
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
答案 | ||||||||
题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
答案 |
第II卷(非选择题,共86分)
三.(本题包括2小题,共24分)
17、(14分) ⑴(4分)下列做法存在安全隐患的是 (选填序号)
A.氢气还原氧化铜实验中,先加热氧化铜后通氢气
B.皮肤上沾有少量浓硝酸时,立刻用大量水冲洗,再涂上稀碳酸氢钠溶液
C.实验室做钠的实验时,余下的钠屑投入到废液缸中
D.制乙烯时,用量程为300℃的温度计代替量程为200℃的温度计,测反应液的温度
E.蒸馏石油时,加热一段时间后发现未加碎瓷片,立刻拔开橡皮塞并投入碎瓷片
F.配制浓硫酸与酒精混合液时,将1体积的酒精倒入3体积的浓硫酸中
(2)(8分)①实验室可利用下图1所示装置来制取气体 (写出两种常见气体的化学式);②已知草酸(乙二酸)在受热时发生如下分解反应:H2C2O4 CO+CO2+H2O 。某同学拟用图1的改进装置图2来验证上述反应中有CO2和H2O生成。已知:草酸晶体的化学式为:H2C2O4·2H2O,熔点为100.1℃,分解温度约为170℃~180℃。试结合所学知识,分析该实验设计中的不足之处(至少指出3处)
。
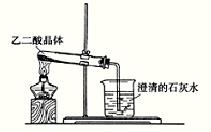
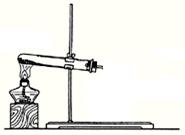
图1 图2
18.(12分) I.课本中介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。注意闻生成物的气味,并观察铜丝表面的变化。
⑴实验室可用化学方法替代“闻生成物的气味”,写出该化学方法的化学反应方程式
。
⑵某同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入乙醛溶液,溴水褪色。该同学为解释上述现象,提出两种猜想:①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应。请你设计一个简单的实验,探究哪一种猜想正确?
。
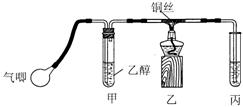 Ⅱ.某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约lmin后鼓入空气。请填写下列空白:
Ⅱ.某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约lmin后鼓入空气。请填写下列空白:
⑴乙醇发生催化氧化的化学反应方程式为
 。
。
⑵实验时,常常将甲装置浸在70℃~80℃的水浴中,目的是 ____;由于装置设计上的缺陷,实验进行时可能会 ____________
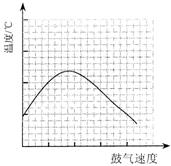
⑶反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步研究表明,鼓气速度与反应体系的温度关系曲线如图所示。
试解释鼓气速度过快,反应体系温度反而下降的原因:
;你认为该实验中“鼓气速度”这一变量可用 来计量___________。
四、(本题包括2小题,共24分)
19. (12分)有A、B、C、D、E五种短周期元素,它们的原子序数依次递增。已知A和C,B和D分别位于同主族,且B、D的质子数之和是A、C质子数之和的2倍;E在同周期元素中原子半径最小。请回答:
(1)A2B和A2D的沸点较高者为 (填化学式)。
(2)由A、B、C、D四种元素形成的无结晶水的化合物甲的溶液与由A、B、E三元素形成的化合物乙的溶液相互间反应的离子方程式可能为: 。
(3)写出由A、B、C三元素所形成的原子个数比为1:1∶1的化合物的电子式 ,其晶体中存在的化学键有 (填化学键名称)。
![]() (4)NH3·H2O的电离方程式为NH3·H2O NH
(4)NH3·H2O的电离方程式为NH3·H2O NH![]() +OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是
。(填a或b)
+OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是
。(填a或b)

(5)利用稀有气体化合物,人们实现了许多制备上的突破。如用XeO3在碱性条件下与NaBrO3反应生成NaBrO4,同时放出Xe,写出上述反应的化学方程式 。
 20.(12分)下图表示各物质之间的转化关系,其中A、B、C、G为单质。②为工业生产中常见反应,E是一种具有漂白作用的盐,Y易潮解,M是一种两性化合物,L是一种白色沉淀。
20.(12分)下图表示各物质之间的转化关系,其中A、B、C、G为单质。②为工业生产中常见反应,E是一种具有漂白作用的盐,Y易潮解,M是一种两性化合物,L是一种白色沉淀。
试回答有关问题:
⑴M的化学式 ,Y在实验室中的用途 (列举一例)。
⑵X的熔点为801℃,实际工业冶炼中常常加入一定量的Y共熔,猜想工业上这样做的目的: 。工业生产中,还常常利用电解X和F的混合物制取 。
⑶反应②的化学方程式是__________________________________。
⑷反应④的离子反应方程式是 。
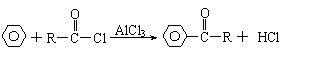 |
五.(本题包括2小题,共16分)
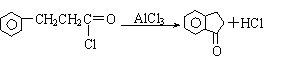
21.(6分)已知“傅-克反应”为:
下面是由苯制有机物“茚”的反应过程(有些步骤已被省去)
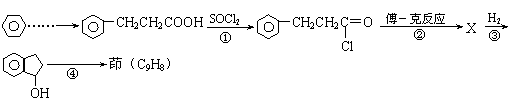 |
请回答下列问题:
⑴①、③反应分别属于 、 反应(填“反应类型”);反应④的
条件是 。
⑵茚的结构简式: 。
⑶写出反应②的化学方程式 。
![]()
![]() 22.(10分)部分有机物之间的转化关系以及转化过程相对分子质量变化关系如下:
22.(10分)部分有机物之间的转化关系以及转化过程相对分子质量变化关系如下:
物质转化关系:R-CH2OH RCHO RCOOH
相对分子质量: M M-2 M+14
已知:物质A中只含有C、H、O三种元素,一定条件下能发生银镜反应,物质C的相对分子质量为104。A与其他物质之间的转化关系如下图所示:
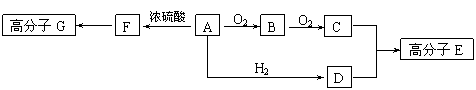 |
请回答下列问题:
⑴F中含有的官能团有 ;G的结构简式 。
⑵一定条件下B发生银镜反应的化学方程式 。
⑶由C、D在一定条件下反应还能生成环状化合物,其化学反应方程式为
。
⑷A的同分异构体很多,写出与A中所含官能团不同,但能与NaOH溶液反应各种异构体的结构简式:
。
六.(本题包括2小题,共22分)
23、(10分)目前一种新型抗酸剂能迅速改善和缓解胃酸过多的症状,它主要由碳酸镁、
氢氧化镁和氢氧化铝组成。现按如下步骤测定药剂中三种主要成分的配比:
⑴取药剂样品,研磨后,加入50mL3.6 mol·L—1盐酸,正好完全反应并收集得到标准状况下224mL气体
⑵过滤,弃去其中不溶性物质(其余成分不参与反应)
⑶取⑵中滤液,加入足量的NaOH溶液后,过滤、洗涤、灼烧,所得固体2.4g。
试求该药剂中三种主要成分的物质的量之比。
24.(12分)某工厂实验室排出的工业废水中含游离氯和强酸。氯气的物质的量浓度为0.015mol/L,氢离子的物质的量浓度为0.001mol/L,废水排出的速度为10.00mL/s。为除去废水中的游离氯,并使废水变为中性,提出如下方案:在废水排出管的前后两处,分别注入一定量的烧碱溶液和亚硫酸钠溶液。已知烧碱溶液的浓度为0.100mol/L,亚硫酸钠溶液的浓度为0.150mol/L。
问:⑴在废水排出管的前后两处,应分别注入 、 溶液,为什么?请用有关离子方程式表示 。
⑵两种溶液的流量应控制多大(mL/s)?写出计算过程。
高考模拟试卷化学(二)
参考答案
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
答案 | D | A | D | C | B | C | B | A |
题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
答案 | C | BC | AB | A | C | D | BD | AD |
17.(1)ACEF
(2)①O2、NH3、CH4等
② 试管口应向上倾斜大约45°,由于草酸晶体的熔点比其分解温度低,所以晶体在分解之前就已熔化流向试管口而无法继续实验;
石灰水变浑浊不一定是草酸晶体受热分解产生的CO2,也可能是乙二酸蒸气溶于石灰水形成的草酸钙沉淀;
不能证明草酸分解有水生成。因为使用的是草酸晶体,加热后,草酸晶体失去结晶水,即有水生成;
分解产生的CO直接排放到大气中,污染环境。(其它合理答案亦可)
18.Ⅰ.
⑴![]()
![]()
或![]()
![]()
⑵用pH试纸检测褪色后溶液的酸碱性。若酸性,则猜想①正确;反之,猜想②正确(或其它合理方法) 疑点 原溴水中的氢溴酸、次溴酸有没有参与反应,若无反应,溶液呈酸性的原因难以确定。
![]() Ⅱ.
Ⅱ.
⑴2CH3CH2OH+O2 2CH3CHO+2H2O
⑵使生成乙醇蒸气的速率加快且较均匀 发生倒吸
⑶过量的气体将体系中的热量带走 单位时间内甲中的气泡数(每空2分,共14分)
19.H2O HSO3-+H+=SO2+H2O HSO3-+HClO= 略 离子键、极性键
a 3NaBrO3+XeO3=Xe+3NaBrO4
20.⑴Al2O3 用作干燥剂
⑵降低X、Y熔化时的温度,节约能源 Cl2、H2和NaOH
⑶2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
⑷Al3++3AlO2-+6H2O=4Al(OH)3↓
21. 取代、加成(1分) 浓硫酸、加热(1分)
取代、加成(1分) 浓硫酸、加热(1分) ![]() (2分)
(2分)
|
22.碳碳双键、醛基(2分)
![]()
![]() (2分)
(2分)
OHC-CH2-CHO+4Ag(NH3)2OH 4Ag+NH4OOC-CH2-COONH4+6NH3+2H2O(2分)
 HOCH2CH2CH2OH+HOOCCH2COOH
HOCH2CH2CH2OH+HOOCCH2COOH
![]() +2H2O(2分)
+2H2O(2分)
CH3CH2COOH CH3COOCH3 HCOOCH2CH3(2分)
23. n(MgCO3):n(Mg(OH)2):n(Al(OH)3)=1∶5∶2
说明:分别算出碳酸镁、氢氧化镁和氢氧化铝的物质的量为0.01mol、0.05mol、0.02mol,算对一个2分,比值2分。
24.(1) Na2SO3 NaOH SO32-+Cl2+H2O=SO42-+2Cl-+2H+ H++OH-=H2O (2)2.1mL·S-1