新教材化学高考模拟题精编详解(4)
| 题号 | 一 | 二 | 三 | 四 | 总分 |
| 分数 |
说明:本套试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分120分.考试时间:90分钟.
可能用到的相对原子质量:Zn:65 S:32 H:1 Cl:35.5
第Ⅰ卷(选择题,共64分)
一、选择题(本题包括16小题,每小题4分,共64分.每小题只有一个选项符合题意.)
1.![]() 为阿伏加德罗常数,下述正确的是( )
为阿伏加德罗常数,下述正确的是( )
A.80g硝酸铵含有氮原子数为2![]()
B.1L 1mol/L的盐酸溶液中,所含氯化氢分子数为![]()
C.标准状况下,11.2L四氯化碳所含分子数为0.5![]()
D.在铜与硫的反应中,1mol铜失去的电子数为2![]()
2.下列叙述正确的是( )
A.越易失电子的原子所形成的简单阳离子,其氧化性一定越强
B.有机化合物一定含有共价键,可能含有离子键
C.同主族金属的原子半径越大,熔点越高
D.干冰和水晶熔化时,所克服的作用力相同
3.光纤通信是一种现代化的通信手段,它可以提供大容量、高速度、高质量的通信服务.目前,我国正在大力建设高质量的宽带光纤通信网络,即信息高速公路.下列说法正确的是( )
①制造光导纤维的主要原料是![]()
②制造光导纤维的主要原料是![]()
③光导纤维传递光信号的基本物理原理是光的全反射
④光导纤维传递光信号的基本物理原理是光的折射
A.①④ B.②③ C.①③ D.②④
4.无机化学中也存在同分异构体,互为同分异构体的一组无机物是( )
A.![]() 与尿素
与尿素![]() B.
B.![]() 与
与![]()
C.![]() 与
与![]() D.
D.![]() 与
与![]()
5.下图是一套检验气体性质的实验装置.向装置中缓慢地通入气体X,若关闭活塞K,则品红试液无变化,而澄清石灰水变浑浊;若打开活塞K,则品红试液褪色.据此判断气体X和洗气瓶内液体Y可能是( )

| A | B | C | D | |
| X |
|
|
|
|
| Y | 浓硫酸 |
饱和溶液 |
溶液 |
饱和溶液 |
6.下列做法中不正确的是( )
A.水银温度计不慎摔破后,在散落的汞滴上覆盖硫粉
B.苯酚溶液不慎沾到皮肤上,立即用酒精洗涤
C.浓硫酸不慎沾在皮肤上,尽快用水冲洗
D.给装在试管中的液体加热时,试管口不能对着自己或他人
7.下列说法正确的是( )
①水在溶液中作氧化剂时1mol水只能得到1mol电子 ②保持温度不变,在![]() 的不饱和溶液中加
的不饱和溶液中加![]() 粉末会使
粉末会使![]() 比值减少 ③
比值减少 ③ 在碱溶液中水解1mol该物质只消耗1mol NaOH ④pH相同,体积相同的盐酸和醋酸分别与锌粉反应,则在单位时间内后者得到的氢气多
在碱溶液中水解1mol该物质只消耗1mol NaOH ④pH相同,体积相同的盐酸和醋酸分别与锌粉反应,则在单位时间内后者得到的氢气多
A.①② B.①④
C.①②③ D.②④
8.使用容量瓶配制溶液时,由于操作不当,会引起误差,下列情况会使所配溶液浓度偏低的是( )
①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了
②用滴定管量取液体时,开始时平视读数,结束时俯视读数
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
A.①③⑤⑥ B.①②⑤⑥ C.②③④⑥ D.③④⑤⑥
9.下列说法正确的是( )
①非金属氧化物一定不是碱性氧化物 ②电解质溶液导电过程属于化学变化 ③醛类既有还原性又有氧化性 ④Mg、Al、Fe、Cu都属于有色金属 ⑤![]() 属于纯净物,又属于复合肥 ⑥稀有气体不活泼的原因是它们原子的最外层都达到8电子稳定结构 ⑦
属于纯净物,又属于复合肥 ⑥稀有气体不活泼的原因是它们原子的最外层都达到8电子稳定结构 ⑦![]() 、
、![]() 、
、![]() 都不能用直接化合法来制取 ⑧NaCl、
都不能用直接化合法来制取 ⑧NaCl、![]() 、Al熔点依次降低
、Al熔点依次降低
A.①②④⑧ B.①②④⑥ C.①②③⑤ D.除④之外
10.已知有如下3个反应:
①![]()
②![]()
③![]()
由此可判断,在通常情况下![]() 、NO、
、NO、![]() 的还原性强弱顺序是( )
的还原性强弱顺序是( )
A.![]() >NO>
>NO>![]() B.NO>
B.NO>![]() >
>![]() C.NO>
C.NO>![]() >
>![]() D.
D.![]() >
>![]() >NO
>NO
11.在100mL 0.01mol·![]() 的纯碱中,不断搅拌并逐滴加入1.2mL 0.05mol·
的纯碱中,不断搅拌并逐滴加入1.2mL 0.05mol·![]() 的盐酸,完全反应后在标准状况下生成二氧化碳的体积为( )
的盐酸,完全反应后在标准状况下生成二氧化碳的体积为( )
A.1.344mL B.2.240mL C.0.672mL D.0mL
12.我国将于今年启动定名为“嫦娥工程”的探月工程.登月的重要意义在于探索月球为人类造福.已知月球上深度3米以内的氦—3有70多万吨,如果用于核反应发电,可供地球上的人类使用7千年.氮—3与氦—4的关系是( )
A.同分异构体 B.同素异形体 C.同位素 D.同一物质
13.由羟基分别跟下列基团相互结合所构成的化合物中,属于醇类的是( )
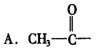 B.
B.![]() — C.
— C.![]() —
—![]() — D.
— D.![]() —
—![]() —
—
14.“混盐”是指一种金属离子与多种酸根离子构成的盐,如氯化硝酸钙![]() 就是一种混盐.“复盐”是指含有多种简单阳离子和一种酸根离子的盐如
就是一种混盐.“复盐”是指含有多种简单阳离子和一种酸根离子的盐如![]() .下列化合物中属于混盐的是( )
.下列化合物中属于混盐的是( )
A.![]() B.
B.![]() C.BiOCl D.
C.BiOCl D.![]()
15.在一定条件下,下列药物的主要成分都能发生①取代反应 ②加成 ③水解 ④中和四种反应的是( )

16.某学生实验完毕后,用下列方法清洗所用仪器:①用稀硝酸洗涤做过银镜反应的试管;②用热的氢氧化钠溶液洗涤盛过油脂的烧杯;③用二硫化碳洗涤沾有硫磺的试管;④用盐酸洗涤盛过饱和石灰水的试剂瓶,则( )
A.除②外都正确 B.除④外都正确 C.只有①、③、④正确 D.全部正确
第Ⅱ卷(非选择题,共56分)
二、(本题包括两小题,共20分)
17.(10分)已知在pH为4~5的溶液中,![]() 几乎不水解,而
几乎不水解,而![]() 几乎完全水解.某学生拟用电解
几乎完全水解.某学生拟用电解![]() 溶液的方法测定铜的相对原子质量.其实验流程如下图所示:
溶液的方法测定铜的相对原子质量.其实验流程如下图所示:

试回答下列问题:
(1)步骤①所加入的A的化学式为________;加入A的作用是__________________
_______________________;沉淀物B是________(填化学式).
(2)步骤②中所用部分仪器如图所示:则A、应接直流电源的________极.B电极上发生的电极反应式为____________________________.

(3)下列实验操作属必要的是________(填字母,下同),属不必要的是________.
A.称量电解前电极的质量
B.电解后电极在烘干前,必须用蒸馏水冲洗
C.剩下电解后电极上的铜,并清洗、称量
D.电极在烘干称重的操作中必须按:烘干→称重→再烘干→再称重进行两次
E.在空气中烘干电极,必须采用低温烘干法
(4)电解后向溶液中加入石蕊试液,观察到的现象是_________________________.
(5)铜的相对原子质量的计算式为________.
(6)步骤②的变化中,从能量转化的角度看是________能转化为________能与______
__能.
18.(10分)某新型无机非金属材料K由两种非金属元素组成,它是一种超硬物质,具有耐磨、耐腐蚀、抗冲击和抗氧化的特性.它是以中学化学中的常见物质为原料来生产的,其生产过程如图所示.其中虚线框内转化是为探究C的组成而设计,G、F、H均难溶于水,且为白色粉末;图中除M、K(均含A元素)外其他字母代表的均为中学化学常见物质.

(1)K可能的晶体类型________,K晶体中A原子周围化学键的键角均相等,键角值为________.
(2)写出化学式:单质B______________;化合物F_______________.
(3)写出下列反应的离子方程式.
反应③______________________________________________________________
反应⑤______________________________________________________________
(4)反应④的化学方程式:___________________________________________________________.
三、(本题包括两小题,共20分)
19.(10分)(1)元素周期表共有________个纵行________个族.
(2)最活泼的金属元素位于周期表中的第________族.
(3)镧系和锕系各有________、________种元素.
(4)碳元素位于周期表中的________周期________族.其氢化物中含氢量最大的一类物质为________(填烷烃、烯烃、炔烃……).分子量最小的氢化物的电子式为________,其空间构型为________.
(5)已知同主族元素在性质上相似,如![]() 、
、![]() 、
、![]() 在水中的溶解度小,有机溶剂中的溶解度大.
在水中的溶解度小,有机溶剂中的溶解度大.![]() 易溶于KI溶液中,而氯气在饱和食盐水中的溶解度却变小,其原因是________________(用简单文字和反应式说明之).
易溶于KI溶液中,而氯气在饱和食盐水中的溶解度却变小,其原因是________________(用简单文字和反应式说明之).
20.(10分)充分燃烧含有碳、氢、氧的一类有机物,消耗氧气的体积与生成二氧化碳的体积之比为9∶8(相同条件下)
(1)该类有机物最简通式是下列各式的________(填代号).
A.![]() B.
B.![]() C.
C.![]()
D.![]() E.
E.![]() F.
F.![]()
(2)符合该通式的某有机物的相对分子质量为136,则其化学式为:________;若该有机物属于酯类且分子中含有苯环.则其可能的同分异构体有________种,写出其中不能发生银镜反应的同分异构体的结构简式______ __.
四、(本题包括两小题,共16分)
21.(8分)硫化锌是一种难溶于水的化合物,当溶液中氢离子浓度为0.734mol/L时,硫化锌沉淀即可完全溶解.
(1)若以硫化锌来制取![]() 时,不能使用的稀强酸是________,原因是____________________________.
时,不能使用的稀强酸是________,原因是____________________________.
(2)写出以硫化锌为原料,实验室制取![]() 的离子方程式.
的离子方程式.
(3)若要将100mL水中的0.970g硫化锌沉淀全部溶解,至少应加入密度为1.19g/![]() 溶液质量分数为36.5%的盐酸多少毫升?(设溶液体积可以相加)
溶液质量分数为36.5%的盐酸多少毫升?(设溶液体积可以相加)
22.(8分)X、Y、Z、W为常见的四种单质,常温下X是固体,Y是液体,Z是无色气体.W为黄绿色气体.其反应关系如下,其中B的溶液显强酸性.

(1)根据反应推断X、Y、Z的化学式 X_____ ___ Y____ ____ Z___ _____
(2)指出X的元素在元素周期表中的位置:________
(3)写出A溶于水后加入X的离子方程式:________
(4)写出C与过量W反应的离子方程式:________
参考答案
一、 1.A B由于盐酸为强电解质,溶于水无HCl分子存在,C标况下![]() 为液体.
为液体.![]() 的分子数大于0.5
的分子数大于0.5![]() .D.铜与硫反应生成硫化亚铜,因此,1mol铜失去的电子数为
.D.铜与硫反应生成硫化亚铜,因此,1mol铜失去的电子数为![]() .
.
2.B 3.B
4.C 根据同分异构体的概念即分子式相同而结构不同,易选C.
5.B 根据题所给实验的操作x应能使品红溶液褪色,因与Y溶液反应能产生的气体能使石灰水变浑浊.
6.C 浓![]() 沾在皮肤上应尽快用布擦去,并用
沾在皮肤上应尽快用布擦去,并用![]() 溶液冲洗.
溶液冲洗.
7.D 溶液浓度越大,其水解度越小,故②正确.pH相同体积相同的盐酸和醋酸其物质的量浓度盐酸<醋酸.因此与锌粉反应,醋酸放出的氢气多.④正确.
8.A 9.C
10.D 由氮元素的化合价决定,低价还原性,高价氧化性.
11.D ![]() n(HCl)=0.00006mol
n(HCl)=0.00006mol ![]()
![]()
![]() 过量.
过量.
12.C 同种元素的不同原子互称为同位素.
13.C 链烃基与羟基相连的叫醇,苯环与羟基相连的叫酚.
14.A ![]() 相当于
相当于![]() 的混合物.
的混合物.
15.B 由所含官能团判断.
16.D 实验仪器的清洗.
二、 17.(1)CuO;与![]() 反应,调节溶液的pH在4~5之间使
反应,调节溶液的pH在4~5之间使![]() 完全水解.
完全水解.![]()
(2)负 ![]()
(3)A、B、D、E;
(4)溶液变为红色;
(5)![]()
(6)电,化学,内
18.(1)原子晶体 109°28′ (2)B.![]() F.
F.![]()
(3)③![]() ⑤
⑤![]()
(4)④![]()
三、 19.(1)18 16;(2)ⅠA;(3)15;(4)2 ⅣA 烷烃, 正四面体型
正四面体型
(5)![]()
![]() HCl+HClO 饱和食盐水中
HCl+HClO 饱和食盐水中![]() 浓度大,使上述平衡向生成
浓度大,使上述平衡向生成![]() 的方向移动,所以
的方向移动,所以![]() 的溶解度减小.
的溶解度减小.
20.[答案](1)C (2)![]() 6
6 

[解析]该有机物为![]() ,则
,则

即有机物为![]()
若![]() 的相对分子质量为136则:25n+18m=136
的相对分子质量为136则:25n+18m=136
![]()
∴m=2 n=4
分子式为![]() 属于酯类且含有苯环的同分异构体有:
属于酯类且含有苯环的同分异构体有:

四、
21.(1)
![]() 硝酸氧化ZnS生成
硝酸氧化ZnS生成![]() 或S (2)
或S (2)![]()
(3)![]()
![]()
设需加入xmL盐酸,ZnS消耗0.02mol HCl
![]() 可使ZnS完全溶解 x=8.35mL
可使ZnS完全溶解 x=8.35mL
22.(1)X:Fe,Y:![]() ;Z:
;Z:![]() (2)第四周期第Ⅷ族
(2)第四周期第Ⅷ族
(3)![]() (4)
(4)![]()