试卷类型:A
2003年MAM高考化学仿真试题(七)
MAM: M-March A-April M-May
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。第Ⅰ卷1至4页,第Ⅱ卷5至8页。共150分,考试时间120分钟。
第Ⅰ卷(选择题 共74分)
注意事项:
1.答第Ⅰ卷前,考生务必将自己的姓名、准考证号、考试科目、试卷类型(A、B)用铅笔涂写在答题卡上。
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。不能答在试卷上。
3.考试结束后,考生将本试卷和答题卡一并交回。
可能用到的相对原子质量:K—39 C—12 O—16 Ca—40 Ba—137 Cl—35.5 Na—23 N—14
一、选择题(本题包括8小题,每小题3分,共24分;每小题只有一个选项符合题意)
1.航天技术测得三氧化二碳(C2O3)是金星大气层的成分之一,下列关于C2O3的说法中错误的是
A.C2O3与CO2都是碳的氧化物
B. C2O3与CO2都是碳酸的酸酐
C. C2O3与CO都具有还原性
D. C2O3与C充分燃烧的产物都是CO2
2.我国城市中的大气污染物主要有
A.CO2、Cl2、N2、酸雨 B.HCl、SO2、N2、粉尘
C.SO2、NO2、CO、烟尘 D.NH3、CO2、CO、雾
3.具有下列特点的物质,一定属于纯净物的是
A.由同一种分子组成的物质
B.由同一种原子组成的物质
C.所有分子都是由相同种类、相同数目的原子构成
D.由同一种元素组成的物质
4.钛金属常称为未来钢铁。钛元素的同位素![]() Ti、
Ti、![]() Ti、
Ti、![]() Ti、
Ti、![]() Ti中,中子数不可能是
Ti中,中子数不可能是
A.24 B.26 C.28 D.30
5.用化学方法不能实现的是
A.生成一种新分子 B.生成一种新离子
C.生成一种新原子 D.生成一种新单质
6.“氮的固定”是指
A.植物从土壤中吸收含氮养料
B.将空气中的氮气转变为含氮化合物
C.豆科植物根瘤菌将含氮化合物转变为植物蛋白质
D.将氨转变为硝酸及其他氮的化合物
7.某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或两种,现将6.9 g样品溶于足量水中,得到澄清溶液。若再加入过量的CaCl2溶液,得到4.5 g沉淀,对样品所含杂质的正确判断是
A.肯定有KNO3和Na2CO3,没有Ba(NO3)2
B.肯定有KNO3,没有Ba(NO3)2,可能还有Na2CO3
C.肯定没有Na2CO3和Ba(NO3)2,可能有KNO3
D.无法判断
8.下列说法正确的是
A.将pH=2的酸溶液稀释10倍,溶液的pH一定变为3
B.将pH=2的盐酸溶液和pH=4的盐酸溶液等体积混合后,溶液的pH变为3
C.将pH=12的Ba(OH)2溶液稀释10倍,溶液的pH变为13
D.将pH=a的盐酸与pH=b的NaOH溶液等体积混合后,若pH=7,则a+b=14.
二、选择题(本题包括10小题,每小题5分,共50分;每小题有一个或两个选项符合题意)
9.用NA表示阿伏加德罗常数,下列说法正确的是
A.常温常压下,22.4 L Cl2含有2NA的氯原子
B.标准状况下,1 L庚烷完全燃烧后,所生成的气体分子数为![]() NA
NA
C.由D和![]() O组成的水11 g中所含中子数为6NA
O组成的水11 g中所含中子数为6NA
D.1.2 g金属镁变为Mg2+所失去的电子数为0.1NA.
10.在0.1 mol·L-1的硫酸铵溶液中,下列关系中正确的是
A.2c(SO![]() )=c(NH
)=c(NH![]() )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
B.c(SO![]() )>c(NH
)>c(NH![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
C.c(NH)>c(SO![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
D.c(NH![]() )>c(SO
)>c(SO![]() )>c(H+)>c(NH3·H2O).
)>c(H+)>c(NH3·H2O).
11.为除去粗盐中的Ca2+,Mg2+,SO![]() 及泥沙,可将粗盐溶于水,再进行下列五项操作:①过滤 ②加过量NaOH溶液
③加适量盐酸 ④加过量Na2CO3溶液
⑤加过量BaCl2溶液,正确的操作顺序是
及泥沙,可将粗盐溶于水,再进行下列五项操作:①过滤 ②加过量NaOH溶液
③加适量盐酸 ④加过量Na2CO3溶液
⑤加过量BaCl2溶液,正确的操作顺序是
A.①④②⑤③ B.④①②⑤③
C.②⑤④①③ D.⑤②④①③
12.下列混合物分离方法错误的是
A.食盐固体与碘晶体——加热
B.食盐水与淀粉溶液——渗析
C.氢氧化铁与氯化铁溶液——电泳
D.碳酸氢铵与氯化铵固体——加热
13.有关胶体的叙述,正确的是
A.胶体溶液带电,所以能产生电泳
B.用丁达尔现象可区别胶体溶液和真溶液
C.胶体的分散质能透过滤纸,但不能通过半透膜
D.胶体溶液具有粘性,呈凝胶状,故叫胶体
14.最近,科学家在实验室成功地在高压下将CO2转化为类似SiO2的原子晶体结构,下列关于CO2晶体的叙述中不正确的是
A.晶体中C、O原子个数比为1∶2
B.该晶体的熔点、沸点高,硬度大
C.晶体中C—O—C键角为180°
D.晶体中C、O原子,最外层都满足8电子结构
15.科学家最近发现一种由钛原子和碳原子构成的气态团簇分子,如图7—1所示:图中顶角和面心的原子都是钛原子,棱的中心和体心的原子都是碳原子。该分子的化学式是
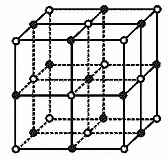
图7—1
A.Ti13C14 B.Ti14C13 C.Ti4C5 D.TiC
16.在一定条件下,合成氨反应达到平衡后混合气体中NH3的体积分数为25%,若反应前后条件保持不变,则反应后缩小的气体体积与原反应物体积的比值是
A.![]() B.
B.
![]() C.
C.
![]() D.
D.
![]()
17.工业制取CuSO4不是直接用铜和浓H2SO4反应,而是将Cu和少量Ag的混合物浸在稀H2SO4中,并不断从容器下部吹入细小的空气泡,这样做的优点是
①不产生污染大气的SO2 ②提高H2SO4的利用率 ③节省能源 ④提高铜的利用率
A.①② B.②③ C.①④ D.①②③
18.制备卤素磷酸钙萤花粉所用的高纯氯化钙中混有镁离子,除去的方法是把氯化钙的水溶液加热到90℃~95℃,在不断搅拌下加入适当的沉淀剂,使镁离子生成沉淀过滤除去,此沉淀剂最好选用下列的
A.氢氧化钙乳浆 B.碳酸钠溶液
C.碳酸氢钠溶液 D.氢氧化钠溶液
第Ⅱ卷(非选择题 共76分)
注意事项:
1.第Ⅱ卷共4页,用钢笔或圆珠笔直接答在试题卷中。(除题目有特殊规定外)
2.答卷前将密封线内的项目填写清楚。
| 题号 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 总分 |
| 分数 |
三、(本题包括2小题,共18分)
19.(12分)用18.4 mol·L-1的浓H2SO4,配制100 mL浓度为1 mol·L-1的稀H2SO4,其操作可分为以下各步:
A.用量筒量取5.4 mL浓H2SO4,缓缓注入装有约50 mL蒸馏水的烧杯里,并用玻璃棒搅拌;
B.用约30 mL蒸馏水,分成三次洗涤烧杯和玻璃棒,将每次洗液都移入容量瓶里;
C.将稀释后的H2SO4小心地移入容量瓶里;
D.检查100 mL容量瓶口部是否发生滴漏;
E.将蒸馏水直接加入容量瓶,至液面接近环形刻度线0.5~1 cm处;
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液;
G.用胶头滴管向容量瓶里逐滴滴入蒸馏水,至液面最低点恰好和环形刻度线相切。
据此填写:
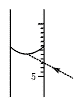
图7—2
(1)正确的操作顺序是(用字母填写): 。
(2)进行A步操作时,应选择下列量器
①10 mL量筒 ②50 mL量筒 ③500 mL量筒 ④1000 mL量筒中的(填序号) 。如果对装有浓H2SO4的量筒读数如图7—2所示,配制的稀H2SO4的浓度将(偏高、偏低、无影响) 。
(3)进行A步操作后,必须 后,才能进行C步操作。
20.(6分)如图7—3所示装置是化学实验中常见的仪器,它除用于洗气外,还有其他用途。
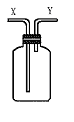
图7—3
(1)在医院给病人输氧时,往往在氧气钢瓶与病人呼吸面具之间安装有水的该装置,用于观察气泡产生的情况,以便调节供氧速率,此时氧气应从 管口导入。
(2)当用此装置收集NO时,应采取的主要操作步骤是:
(Ⅰ) 。
(Ⅱ) 。
四、(本题包括4小题,共42分)
21.(12分)已知A、B为可溶性盐,通过实验,出现下图所示的一系列变化,并观察到一些实验现象。根据这些变化及现象,回答下列问题:
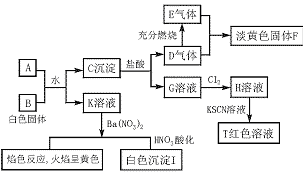
图7—4
(1)写出下列物质或溶质的化学式:A. ,B. ,E. 。
(2)写出下列变化的方程式:
A+B: ,
D+E: ,
![]() G H:
。
G H:
。
22.(6分)已知氯乙烷跟氢氧化钠的乙醇溶液共热可得到乙烯,这种反应属于“消去反应”。现由环己烷制取1,2,3,4—四氯环己烷,即:
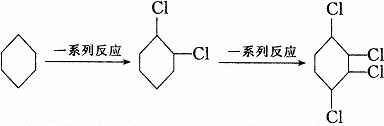
(1)在上述一系列反应中,所涉及的有机化学反应类型有 ,其对应反应的次数是 。
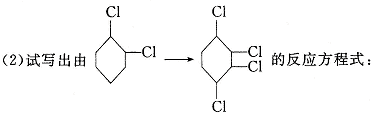 。
。
23.(12分)质子数均在20以内的A、B、C、D四种元素原子的核电荷数依次增大,其单质可发生如下转化:
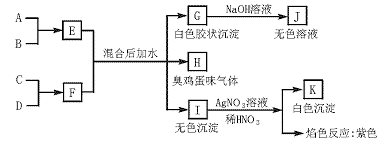
请回答下列问题:
(1)写出E、J的化学式:E 、J ;
(2)写出B和D形成化合物的电子式: ;
(3)写出FeCl3溶液和过量的H反应的离子方程式 ;
(4)A与1 mol B恰好完全反应时,失去电子的物质的量是 ;
(5)D与B的上周期同主族元素可形成原子数目比为1∶2的化合物L,L在太空宇航和潜水领域有着广泛的用途。L与CO2发生反应的化学方程式是 。
24.(12分)为了将混有Na2SO4\,NaHCO3的NaCl提纯,并制得纯净的NaCl溶液,某学生设计如下实施方案:
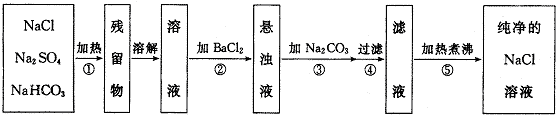
(1)操作①盛放药品可选用 。(填仪器名称)
(2)操作②为什么不用Ba(NO3)2溶液,其理由是 。
(3)进行操作②后,判断SO![]() 已除尽的方法是
。
已除尽的方法是
。
(4)操作③的目的是 ,为什么不先过滤后加Na2CO3溶液,其理由是 。
(5)此设计方案是否严密,说明理由:
五、(本题包括2小题,共16分)
25.(8分)将10 mol·L-1的盐酸逐滴加入到100 g BaSO4和BaCO3混合物中,直到气体放尽为止,蒸干后固体的物质增重2.75 g,问:
(1)原混合物中BaCO3的质量分数是多少?
(2)用去盐酸多少毫升?
26.(8分)在25℃,101kPa条件下,将15 L O2通入10 L CO和H2的混合气中,使其完全燃烧,干燥后,恢复至原来的温度和压强。计算:
(1)若剩余气体的体积是15 L,则原CO和H2的混合气中:
V(CO)= L,V(H2)= L。
(2)若剩余气体的体积为a L,则原CO和H2混合气中V(CO)∶V(H2)= 。
(3)若剩余气体的体积为a L,则a 的取值范围是 。
