2003年MAM高考化学仿真试题(四)
MAM: M-March A-April M-May
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。第Ⅰ卷1至4页,第Ⅱ卷5至8页。共150分,考试时间120分钟。
第Ⅰ卷(选择题 共74分)
注意事项:
1.答第Ⅰ卷前,考生务必将自己的姓名、准考证号、考试科目、试卷类型(A、B)用铅笔涂写在答题卡上。
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。不能答在试卷上。
3.考试结束后,考生将本试卷和答题卡一并交回。
一、选择题(本题包括8小题,每小题3分,共24分;每小题只有一个选项符合题意)
1.酸雨被称为“空中死神”,你认为减少酸雨产生的途径可采取的措施是
①少用煤作燃料;②把工厂烟囱造高;③燃料脱硫;④在已酸化的土壤中加石灰;⑤开发新能源
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤
2.在西部大开发中,“西气东输”工程引人瞩目,“西气”的主要成分是
A.CH4 B.CO C.H2 D.NH3
3.某光洁的铂丝蘸取某无色溶液,在无色灯焰上灼烧时观察到黄色火焰,则下列有关叙述正确的是
A.只含Na+ B.一定含Na+,可能含K+
C.既含Na+,又含K+ D.可能含Na+或K+中的一种
4.最近科学界合成一种“二重结构”的球形物质分子,是把足球型C60分子容纳在足球型Si60分子中,外面的硅原子与里面的碳原子以共价键结合。下列关于这种物质的叙述中正确的是
A.是混合物 B.是化合物
C.不含极性键 D.其晶体是原子晶体
5.据报道,1999年新合成出114号元素的一种同位素,该同位素的质量数为298,以下叙述中不正确的是
A.该元素属第七周期
B.该元素位于ⅢA族
C.该元素为金属元素,性质与82Pb相似
D.该同位素原子含114个电子和184个中子
6.下列实验中用错试剂的是
A.用稀盐酸清洗做焰色反应的镍铬丝 B.用酒精萃取碘水中的碘
C.用稀硝酸洗去残留在试管壁上的铜 D.用碱石灰吸收氨气中的水蒸气
7.下列事实不能用勒夏特列原理解释的是
A.氨水应密闭保存,放置低温处
B.在FeCl2溶液中加入铁粉防止氧化变质
C.生产硝酸中使用过量空气以提高氨气的利用率
D.实验室用排饱和食盐水法收集氯气
8.下列实验过程中无明显现象的是
A.CO2通入CaCl2溶液中 B.SO2通入酸性Ba(NO3)2溶液中
C.MgCl2溶液滴入肥皂水中 D.NH3通入AlCl3溶液中
二、选择题(本题包括10小题,每小题5分,共50分;每小题有一个或两个选项符合题意)
9.NA为阿伏加德罗常数,下列叙述中正确的是
A.80 g硝酸铵中含有氮原子数为2NA
B.1 L 1 mol·L-1的盐酸溶液中,所含氯化氢分子数为NA
C.在标准状况下,11.2 L CCl4含分子数0.5 NA
D.2.3 g钠在化学反应中失电子数为0.1 NA
10.丙烯醛的结构简式为:CH2==CHCHO,下列关于它的性质叙述中错误的是
A.能使溴水褪色
B.能与氢气充分反应生成1—丙醇
C.能发生银镜反应,表现出氧化性
D.在一定条件下能被空气氧化
11.烧过菜的铁锅未及时洗涤(残液中含NaCl等),第二天便出现了红色锈斑(Fe2O3·xH2O)。下列反应表示整个过程可能发生的变化,其中不符合事实的是![]()
A.2H2O+O2+4e-====4OH- B.Fe====Fe3++3e-
C.Fe3++3OH-====Fe(OH3)↓ D.4Fe(OH)2+O2+2H2O====4Fe(OH)3
12.目前人们正研究开发一种高能电池——钠硫电池,它是由熔融的钠和硫为两极,以
|
|
A.放电时,钠作负极,硫作正极
B.放电时,钠发生还原反应
C.充电时,钠与外电源正极连接,硫与负极连接
D.充电时,阳极发生反应为:S![]() -2e-====xS
-2e-====xS
13.一种气态烷烃和一种气态烯烃组成的混合物共10 g,混合气体的密度是相同状况下H2密度的12.5倍,让混合气体通过盛有溴水的试剂瓶时,试剂瓶的质量增加了8.4 g,组成该混合气体的可能是
A.乙烷和乙烯 B.乙烷和丙烯
C.甲烷和乙烯 D.甲烷和丙烯
14.下列各组离子在溶液中可以大量共存,且加入氨水后也不产生沉淀的是
A.Na+ Ba2+ Cl- NO![]() B.H+ NH
B.H+ NH![]() Al3+ SO
Al3+ SO![]()
C.K+ AlO![]() NO
NO![]() OH- D.H+ Cl-
CH3COO-
NO
OH- D.H+ Cl-
CH3COO-
NO![]()
15.下列离子方程式正确的是
A.钠和冷水反应 Na+2H2O====Na++2OH-+H2↑
B.氯气与水反应 Cl2+H2O====2H++Cl-+ClO-
C.硫酸铝溶液和小苏打溶液反应 Al3++3HCO![]() ====Al(OH)3↓+3CO2↑
====Al(OH)3↓+3CO2↑
D.向Ca(ClO)2溶液中通入SO2 Ca2++2ClO-+SO2+H2O====CaSO3↓+2HClO
16.向含a mol AlCl3的溶液中滴入含b mol NaOH的溶液,充分反应后沉淀的物质的量不可能为
A.3b mol B.13b mol C.(4a-b) mol D.a mol
17.浅绿色的Fe(NO3)2溶液中存在着如下平衡:Fe2++2H2O![]() Fe(OH)2+2H+,若在此溶液中加入盐酸,则溶液的颜色
Fe(OH)2+2H+,若在此溶液中加入盐酸,则溶液的颜色
A.变黄 B.变得更浅 C.颜色变深 D.不变
18.将20 mL 1 mol·L-1的NaOH溶液和10 mL 1 mol·L-1醋酸溶液混合后蒸干并强热,最后得到的固体是
A.NaOH B.CH3COONa
D.NaOH与CH3COONa混合物 D.Na2CO3
第Ⅱ卷(非选择题 共76分)
注意事项:
1.第Ⅱ卷共4页,用钢笔或圆珠笔直接答在试题卷中。(除题目有特殊规定外)
2.答卷前将密封线内的项目填写清楚。
| 题 号 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 总 分 |
| 分 数 |
 三、(本题包括2小题,共20分)
三、(本题包括2小题,共20分)
|
(1)试管乙中观察到的现象是 。
(2)加入浓硫酸的目的是 。
(3)该实验用到的球形管除冷凝作用外,另一重要作用是 。
(4)试管乙中饱和Na2CO3溶液的作用是 。
20.(12分)某课外活动小组模拟呼吸面具中原理(过氧化纳与潮湿的CO2反应),设计了用下列仪器来制取氧气并测量氧气的体积。

图4—2
图中量气装置E是由甲、乙两根玻璃管组成,它们由橡皮管连通,并装入适量水。甲管有刻度(0~50 mL);乙管可上下移动以调节液面高度。
实验室可供选择的药品还有:稀硫酸、盐酸、过氧化钠、大理石、水。试回答:
(1)上述装置的连接顺序是(填各接口编号,其中连接胶管及夹持用具均省略) 。
(2)装置C中放入的反应物是 。
(3)装置A的作用是 。装置B的作用是 。
(4)为了较准确地测量氧气体积,除必须检查各个装置气密性外,在读取反应前后甲管中液面高度,求其差值的过程中,应注意 和 。(填字母编号)
a.视线与凹液面最低处持平
b.等待片刻,待乙管中液面不再上升时立即读数
c.读数时应上下移动乙管,使甲、乙两管液面持平
d.读数时不一定使甲、乙两管液面持平
四、(本题包括3小题,共26分)
21.(6分)为方便某些计算,常可将98%的浓硫酸表示为硫酸水合物形式(H2SO4·19H2O)或SO3水合物形式(SO3·![]() H2O),则98%的浓磷酸表示为磷酸水合物形式为
,表示为五氧化二磷水合物形式为
。
H2O),则98%的浓磷酸表示为磷酸水合物形式为
,表示为五氧化二磷水合物形式为
。
22.(10分)KClO3和浓盐酸在一定温度下反应会生成黄绿色易爆物二氧化氯,其表达式为: KClO3+ HCl(浓)![]() KCl+ ClO2↑+
Cl2↑+ .
KCl+ ClO2↑+
Cl2↑+ .
(1)请完成上述方程式(未知化学式及计量数填入框内)。
(2)浓盐酸在反应中显示出来的性质是:(填写编号) 。
①只有还原性 ②具有还原性与酸性 ③只有氧化性 ④具有氧化性和酸性
(3)产生0.1 mol Cl2,则转移电子物质的量为 mol。
(4)ClO2具有很强的氧化性,因此常被用作消毒剂,其消毒效率(以单位质量得到的电子数表示)是Cl2的 倍。
|
①O2==== 2O ②O2+O====O3 则
(1)写出以上①②反应的总方程式 。
(2)氧气与臭氧互称为 。
|
①CF2Cl2====Cl+CF2Cl;② ;③O+ClO====Cl+O2
写出以上②、③反应的净结果 。
上述反应过程中,Cl是 (填序号)。
A.反应物 B.生成物 C.中间产物 D.催化剂
五、(本题包括2小题,共16分)
24.(6分)在某些酶的催化下,人体内葡萄糖的代谢有如下过程:
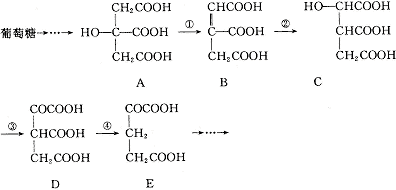
(1)过程①是 反应,过程②是 反应,过程③是 反应(填写反应类型名称)。
(2)过程④的另一种生成物是 (写化学式)
(3)上述物质中 和 互为同分异构体。
25.(10分)工业上可用甲苯生产对羟基苯甲酸乙酯 ![]()
(一种常用的化妆品防霉剂),其生产过程如下图(反应条件未全部注明)所示:
(1)有机物A的结构简式为 。
(2)反应物的化学方程式(要注明反应条件)为: 。
(3)反应②的类型属 反应,反应④属于 反应。
(4)反应③的方程式(反应条件不要写,要配平)为: 。
(5)在合成路线中,设计第③步反应的目的是: 。

六、(本题包括2小题,共14分)
26.(6分)298 K时,向V L真空容器内通入了n mol SO2和m mol H2S。
(1)若n=2,当m= 时,反应后容器内气体密度最小。
(2)若2n>m,则反应后氧化产物与还原产物的差为 g。
(3)若5 n=m,且反应后氧化产物与还原产物的质量差为48 g,则n+m= 。
27.(8分)在100 mL 2 mol·L-1稀硫酸中加入0.1 mol的镁铝混合物,然后再滴加1 mol·L-1的NaOH溶液。请回答:
 (1)若在滴加NaOH溶液过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示。当V1=160 mL时,金属粉末中n(Mg)= mol,V2= mL。
(1)若在滴加NaOH溶液过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示。当V1=160 mL时,金属粉末中n(Mg)= mol,V2= mL。
|
(3)若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol·L-1的硫酸溶解此混合物后,再加入450 mL 1 mol·L-1的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是 。