2006年揭阳市高考化学综合测试题
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分;
第Ⅰ卷(选择题 共67分)
可能用到的原子量:H 1 C 12 N 14 O 16 Cu 64 S 32 Na 23 Mn 55
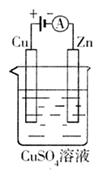
K 39 Cl 35.5
一、选择题(本题包括9小题,每小题3分,共27分。每小题只有一个选项符合题意。)
1.纳米是长度单位,1纳米等于1×10-9米,物质的颗粒达到纳米级时,具有特殊的性质。例如,将单质铜制成“纳米铜”时,“纳米铜”具有非常强的化学活性,在空气中可以燃烧。下列对“纳米铜”的有关叙述正确的是( )
A.常温下,“纳米铜”比铜片的金属性强
B.常温下,“纳米铜”比铜片更易失电子
C.常温下,“纳米铜”与铜片的还原性相同
D.常温下,“纳米铜”比铜片的氧化性强
2.某固体化合物A不导电,但熔化或溶于水中能完全电离。下列关于A的说法中,正
确的是
A.A可能是共价化合物 B.A与金刚石的晶体类型相同
C.A中不可能有共价键 D.A溶于水中时一定破坏了A中的离子键
3.下列有关阿伏加德罗常数的叙述正确的是( )
A.0.1mol碳酸钠溶于水所得溶液中所含阴离子数小于0.3×6.02×1023个
B.通常状况下,0.5×6.02×1023个甲醛分子所占体积大于11.2L
C.1mol冰醋酸中含有6.02×1023个CH3COO—
D.标准状况下,含4molHCl的浓盐酸与足量MnO2反应可生成22.4LCl2
4.已知可充电电池在充电时作电解池,放电时作原电池。镍氢可
![]() 充电电池上有两极(如右图所示),一极旁标有“+”,另一极旁标
充电电池上有两极(如右图所示),一极旁标有“+”,另一极旁标
有“一”。下列关于标有“一”的一极的说法中正确的是
A.充电时作阳极,放电时作正极 B.充电时作阳极,放电时作负极
C.充电时作阴极,放电时作负极 D.充电时作阴极,放电时作正极
5.右图是立方烷(cunane)的球棍模型,下列有关说法不正确的是
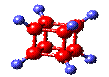 A.他的一氯代物只有一种同分异构体
A.他的一氯代物只有一种同分异构体
B.他的二氯代物有两种同分异构体
C.他是一种极性分子
D. 他与苯乙烯(C6H5-CH=CH2)互为同分异构体
6.下列关于氨气的说法正确的是
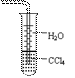 A.氨可以用浓硫酸干燥也可用无水CaCl2干燥
A.氨可以用浓硫酸干燥也可用无水CaCl2干燥
B.氨水能导电,所以NH3是电解质
C.沸点:NH3<PH3<AsH3
D.用水吸收NH3用右图装置可防止倒吸
7.已知某温度下蒸馏水中的c(H+)=1×10-6mol/L,在此温度下将甲酸和氢氧化钠溶液混合,所得溶液的pH=7,此溶液中( )
A.c(HCOO-)>c(Na+) B.c(HCOO-)<c(Na+)
C.c(HCOO-)=c(Na+) D.无法确定c(HCOO-)与c(Na+)的关系
8.运用元素周期律分析下面的推断,其中错误的是 ( )
A.铍的氧化物的水化物可能有两性
B.单质砹为有色固体;HAt不稳定;AgAt感光性很强,不溶于水也不溶于稀硝酸
C.硫酸锶是难溶于水的固体
D.硒化氢是无色、有毒、比H2S稳定的气体
9.某校化学小组学生测定硫酸铜晶体里结晶水的含量。若实验测得硫酸铜晶体中结晶水的含量偏低,造成此结果可能的原因有 ( )
①加热前所用的坩埚未完全干燥 ②加热明有少量固体溅出
③被测样品中含有加热易挥发的杂质 ④在空气中冷却后称量
⑤加热至样品还有淡淡的蓝色时就冷却称量
A.①④ B.②④ C.③⑤ D.④⑤
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。
若正确答案只包括一个选项时,该题为0分;若正确答案包括两个选项,只选一个且正
确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
10.下列分离或提纯物质的方法错误的是 ( )
| 物质 | 杂质 | 试剂及主要操作 | |
| A | C6H6 | Br2 | 加苯酚,过滤 |
| B | CO2 | SO2 | 通过盛有KMnO4溶液的装置洗气 |
| C | 硬脂酸钠 | 甘油,水 | 加NaCl盐析 |
| D | CO2 | CO | 点燃 |
11.已知热化学方程式2SO2(g)+
O2(g)![]() 2
SO3(g) △H= -Q kJ/mol(Q>0),则下列说法正确的是( )
2
SO3(g) △H= -Q kJ/mol(Q>0),则下列说法正确的是( )
A.2molSO2(g)和1mol O2(g)所具有的内能大于2 molSO3(g)所具有的内能
B.将2molSO2(g)和1mol O2(g)置于一密闭容器中充分反应后放出QKJ的热量
C.升高温度,平衡向逆反应移动,上述热化学方程式中的Q值减小
D.如将一定量SO2(g)和 O2(g)置于某密闭容器中充分反应后放热QKJ,则此过程中有2molSO2(g)被氧化
12.下列离子方程式书写正确的是( )
A.足量镁粉加入氯化铁溶液中:Mg+2Fe3+==Mg2++2Fe2+
B.氯化亚铁溶液中通入硫化氢气体:Fe2++H2S==FeS↓+2H+
C.向大量的硫酸氢钾溶液中加入少量的氢氧化钡溶液:
H++SO42-+Ba2++OH-==BaSO4↓+H2O
D.铁粉溶于足量稀硝酸中:Fe+4H++NO3-=Fe3++NO↑+2H2O
13.下列各种溶液中,一定能大量共存的离子组是
A.含有大量Fe3+的溶液中:Mg2+、Al3+、NO3-、SO42-
B.由水电离的c(H+)=10-14mol·L-1 的溶液中:K+、Na+、Ca2+、HCO3-
C.pH=0的溶液中:Fe2+、NO3-、SO42-、Al3+
D.使紫色石蕊试液变蓝色的溶液中:Na+、ClO-、SO32-、SO42-
14.右图是某有机物的球棍模型,下列关于该有机物的性质叙述中错误的是( )
 A.能与NaOH发生反应,但不能与盐酸反应
A.能与NaOH发生反应,但不能与盐酸反应
B.能合成高分子化合物
C.能发生加成反应
D.能发生水解反应
15.A、B、C、D为四种短周期元素,已知A、C同主族,B、D同周期;A的气态氢化物比C的气态氢化物稳定;B的阳离子比D的阳离子氧化性强;B的阳离子比C的阴离子少一个电子层。下列叙述正确的是 ( )
A.原子序数:A>B>C>D B.单质熔点:D>B,A>C
C.原子半径:D>B>C>A D.简单离子半径:D>B>C>A
16.下列实验操作中正确的是( )
A.检测溶液pH的操作是:将湿润的pH试纸置于表面皿上,用玻璃棒蘸取溶液,滴在pH试纸的中部,待试纸变色后与对应的标准比色卡比较。
B.容量瓶检漏的操作是:在容量瓶中注入适量的水,塞上玻璃瓶塞,左手五指托住瓶底,右手食指顶住瓶塞,反复倒置,观察是否漏水。
C.用标准酸溶液滴定未知碱溶液的操作是:右手摇动锥形瓶,左手控制活塞,两眼注视锥形瓶中溶液颜色的变化。
D.将大块的白磷切成小块的操作是:用镊子将白磷取出,用滤纸吸干白磷表面的水分,用刀快速切割。
17.将25.6g KOH和KHCO3的混合物在250℃时煅烧,冷却后发现混合物的质量减少4.9g,则混合物中KOH和KHCO3的组成为(n为物质的量) ( )
A.n(KOH)>n(KHCO3) B.n(KOH)<n(KHCO3)
C.n(KOH)=n(KHCO3) D.组成为任意比
18.在容积不变的密闭容器中,一定条件下进行如下反应:
NO(g)+CO(g)=0.5N2(g)+CO2(g); △H=-373.2kJ/mol。
|
A.加催化剂
B.向密闭容器中加入氩气
C.降低温度
D.增大反应物中NO的浓度
19.t℃时,甲、乙两个烧杯中各盛有100g(密度为1.10g/cm3)相同浓度的KCl溶液。现将甲烧杯中的溶液蒸发掉35.0g H2O,恢复到t℃时,析出KCl固体5.0g;乙烧杯中的溶液蒸发掉45.0gH2O,恢复到t℃时,析出KCl固体10.0g。下列说法正确的是 ( )
A.原溶液的质量分数为20%
B.t℃时,KCl的溶解度为50.0g
C.原溶液的物质的量浓度为3.0mol/L
D.乙烧杯中剩余KCl溶液的质量分数大于甲烧杯中剩余KCl溶液的质量分数
第Ⅱ卷(非选择题 共83分)
三、(本题包括2小题,共24分)
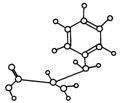
20.(12分)化学课外活动小组设计了如图所示的一套气体发生、收集和尾气吸收装置,以探究该装置的多功能。

(1)甲同学认为利用装置Ⅱ可直接收集NH3、H2,但不能收集O2,其理由是:_______________________________________________________________________。
(2)乙同学认为装置Ⅰ可作为实验室制氧气的快速发生器,对装置Ⅱ稍作改进后即可作为O2的收集装置,乙同学对装置Ⅱ的改进方法是:_______________________,制O2时在装置Ⅰ中的a中加入________________,b仪器中加入__________________ 。
 (3)丙同学认为装置Ⅱ经乙同学改进后只需在装置Ⅱ之后连一尾气吸收装置即可收集SO2气体。试将吸收SO2的尾气吸收装置画在方框内。
(3)丙同学认为装置Ⅱ经乙同学改进后只需在装置Ⅱ之后连一尾气吸收装置即可收集SO2气体。试将吸收SO2的尾气吸收装置画在方框内。
(4)丁同学认为利用装置Ⅰ和装置Ⅲ可进行验证Cl2的氧化性比Br2强的实验,进行此项实验时在装置Ⅰ中的a仪器中
加入_______________试剂,b仪器中加入______________ 试
剂,装置Ⅲ中应加入_______________试剂,根据装置Ⅲ中观察到的__________________________________________________
___________________________________实验现象即可得出Cl2的氧化性比Br2强的结论。
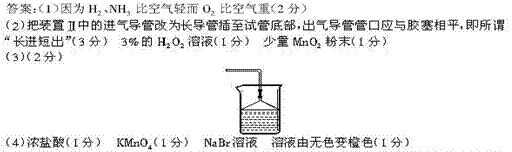 |
21.(12分)为了检验Pb(NO3)2热分解的产物,有人用下图中的装置进行实验(图中铁架台、铁夹和加热设备均略去)。实验时在试管中放入研细的Pb(NO3)2晶体,实验结束后,试管中得到黄色粉末(PbO),U型管下部有少量液体X,集气瓶收集到无色气体Y,回答下列问题:
(1)在装置中试管和U型管上的橡皮塞最好用锡箔包住,用橡皮管连接的两玻璃管口要相互紧靠,原因是 。
(2)液体X可能是 , 气体Y可能是 。
(3)导气管口不再有气泡冒出时,停止反应,这时在操作上应注意 。
(4)用简单的实验证实(2)中的判断:①对X的判断; ② 对Y的判断(要求:怎样从水槽中取出集气瓶,实验方法、现象、结论)。
答案:(1) NO2能腐蚀橡胶(2) N2O4, O2 (3) 将导气管拿出水槽
(4) ① 将U型管拿出,有红棕色气体产生,证明 N2O4 ![]() 2NO2 ΔH =+Q 有NO2的存在 ②. 用毛玻璃片盖住集气瓶口,拿出水槽放在桌面上,将带火星的木条放入集气瓶,木条复燃,说明是氧气。
2NO2 ΔH =+Q 有NO2的存在 ②. 用毛玻璃片盖住集气瓶口,拿出水槽放在桌面上,将带火星的木条放入集气瓶,木条复燃,说明是氧气。
四、(本题共2小题,共 22分)
22.(12分)(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是 。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。
肼—空气燃料电池放电时:
正极的电极反应式是 。
负极的电极反应式是 。
(3)下图是一个电化学过程示意图。
|
①锌片上发生的电极反应是 。
②假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼
一空气燃料电池理论上消耗标标准状况下的空气 L(假设空气中氧气体积含量为20%)
(4)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式是 。
22.(共12分,每空2分)
(1)N2H4(1)+O2(g)=N2(g)+2H2O(1);△H=-624kJ/mol
(2)O2+2H2O+4e-=4OH-
N2H4+4OH--4e-=4H2O+N2↑
(3)①Cu2++2e-=Cu ②112
(4)ClO-+2NH3=N2H4+Cl-+H2O
23、(10分)2000年在河南发现世界级特大金红石 (含TiO2) 矿床。钛和钛合金及其重要化合物,在许多领域具有广泛、重要的应用,被称为21世纪的金属。
(1) 钛元素的同位素有:![]() ,则下列说法正确的是 ( )
,则下列说法正确的是 ( )
A、据此可计算出钛元素的相对原子质量为48
B、钛元素的五种同位素化学性质均不相同
C、钛元素在元素周期表中位于第四周期
D、钛与铁 (26Fe) 同为第VIII族元素
(2)TiO2(二氧化钛) 是高级的白色颜料,它可用下列反应制得:
第一步:FeTiO3+2H2SO4 ===== TiOSO4+FeSO4+2H2O
此时,钛铁矿中的Fe2O3也与H2SO4发生反应,可加入铁屑使其还原成Fe2+,写出此过程的离子反应方程式: 。
第二步:TiOSO4+2H2O
![]() TiO2·H2O
+H2SO4; △H
> 0
TiO2·H2O
+H2SO4; △H
> 0
制二氧化钛的关键是第二步水解反应。为使第二步反应进行得更完全,可采用下列 措施。
A、加酸 B、加碱 C、加热 D、加压
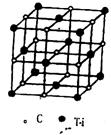 (3) 最近发现一种由钛原子和碳原子构成的气态团簇分子,如图所示,则它的化学式为
(3) 最近发现一种由钛原子和碳原子构成的气态团簇分子,如图所示,则它的化学式为
23、(10分) (1) C (2分);
(2) Fe2O3+6H+=2Fe3++3H2O,2Fe3++Fe=3Fe2+ (各2分) B、C (2分)
(3) Ti14C13 (2分)
五、(本题共2小题,共 18分)
24.(8分)苹果酸是一种常见的有机酸,其结构为:
![]() OH
OH
HOOC—CH—CH2—COOH
(1)苹果酸分子所含官能团的名称是 、 。
(2)苹果酸不可能发生的反应有 (选填序号)。
①加成反应 ②酯化反应 ③加聚反应 ④氧化反应
⑤消去反应 ⑥取代反应
(3)物质A(C4H5O4Br)在一定条件下可发生水解反应,得到苹果酸和溴化氢。由A制取苹果酸的化学方程式是 。
24.(共8分,每空2分)
(1)羟基 羧基
(2)①③ (写对1个给1分,多写或写错没有分)
![]()
![]()
![]() Br
OH
Br
OH
(3)HOOC—CH—CH2—COOH+H2O HOOC—CH—CH2—COOH+HBr(不写条件不扣分)
25.(10分)有机物A(C8H8O2)为一种无色液体。从A出发可发生如下一系列反应
 |
请回答:
(1)A和F的结构简式:A , F 。
(2)反应②的离子反应方程式: 。
反应④的化学反应方程式: 。(请注明示踪18O原子)
(3)A的同分异构体甚多,其中属于羧酸类的化合物,且含有苯环结构的异构体有____种。
![]()
 25. (10分) (1)(各2分 )
CH3COO-
25. (10分) (1)(各2分 )
CH3COO-
![]() (2))C6H5O— + CO2 + H2O
C6H5O— + HCO3—
(2分)
(2))C6H5O— + CO2 + H2O
C6H5O— + HCO3—
(2分)
C2H518OH +CH3COOH=====CH3CO18OC2H5 + H2O (2分)
(3)4(2分)
六、(本题共2小题,共 21分)
26.(8分)已知KMnO4、MnO2在酸性条件下将草酸钠(Na2C2O4)氧化,离子反应为:
2MnO4—+5C2O42—+16H+==2Mn2++10CO2↑+8H2O
MnO2+C2O42—+4H+==Mn2++2CO2↑+2H2O
为测定某软锰矿中MnO2的质量分数,准确称取1.20g软锰矿样品,加入2.68g无水草酸钠固体,再加入足量的稀硫酸(杂质不反应),充分反应后将所得溶液转移到250mL容量瓶中, 用蒸馏水稀释至刻度,摇匀后从中取出25.00mL,再用0.02mol/L KMnO4溶液滴定。当滴入20.00mLKMnO4溶液时恰好完全反应。
求该软锰矿中MnO2的质量分数。
26.(8分)解 :
5C2O![]() ~ 2MnO
~ 2MnO![]()
5 2
x mol 0.02×20×10-3 mol
x= 1×10-3 mol (2分)
∴用于与MnO2反应的C2O![]() 为:
为:
(![]() — 1×10-3mol×
— 1×10-3mol×![]() ) =0.01mol
(2分)
) =0.01mol
(2分)
∵MnO2 ~ C2O![]()
1 1
y mol 0.01 mol
y = 0.01 mol (2分)
∴MnO2%=![]() ×100%=72.5%
(2分)
×100%=72.5%
(2分)
27.(13分)某复盐的组成可表示为:![]() ,R为-2价含氧酸根.为了确定该盐的组成,进行如下实验:
,R为-2价含氧酸根.为了确定该盐的组成,进行如下实验:
(1)准确称取4.02 g样品加热到失去全部结晶水,冷却后称量,质量为2.94 g.
(2)将剩余固体溶于适量水,滴加盐酸,无现象,再滴加足量![]() 溶液,产生白色沉淀.过滤,将沉淀烘干,称质量为4.66 g.
溶液,产生白色沉淀.过滤,将沉淀烘干,称质量为4.66 g.
(3)向上述溶液中加入过量NaOH溶液,产生白色沉淀,过滤,将沉淀烘干,称质量为0.58g,再将固体高温灼烧后冷却,称得剩余固体质量是0.40 g.
请通过计算回答下列问题:
(1)确定R的化学式. R的化学式______________.
(2)求x、y、z的值. x=________,y=________,z=_________.
(3)确定A是什么元素. A元素的名称是_____________.
(4)该复盐的化学式为______________.
(5)要确定某化合物是否含A元素,最简单方法是______________.
27.(1)由于向溶液中滴加盐酸,无现象,再滴加![]() 溶液,产生白色沉淀.所以,R必定是硫酸根;R的化学式为
溶液,产生白色沉淀.所以,R必定是硫酸根;R的化学式为![]()
(2)4.02 g样品中含结晶水的物质的量为![]()
4.02 g样品中含硫酸根的物质的量为![]()
![]()
![]()
b+34 18 18
0.58 g (0.58-0.40)g
解得 b=24,∴ B是镁元素
4.02 g样品中含硫酸镁的物质的量为![]()
4.02 g样品中含另一种硫酸盐的物质的量为0.02 mol-0.01 mol=0.01 mol
x∶y∶z=0.01∶0.01∶0.06=l∶1∶6
∴ x=1;y=1;z=6
(3)A的原子量为![]() ,∴ A是钾元素
,∴ A是钾元素
A元素的名称是钾
(4)复盐的化学式为![]()
(5)焰色反应