08高考化学易错易漏选择题专题训练(三)
总分共64分 测试时间30分钟
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1、下列物质中,均直接由原子构成的是
①二氧化碳 ②二氧化硅 ③铁蒸气 ④金刚石 ⑤单晶硅
⑥白磷 ⑦硫磺 ⑧氨 ⑨钠 ⑩氖晶体
A、②③④⑤ B、②③④⑤⑨⑩ C、②③④⑤⑩ D、②④⑤⑥⑦⑨⑩
2、下列变化属于物理变化的是
A、浓硫酸镁溶液与蛋白质溶液混合 B、石墨转变为金刚石
C、稀硫酸溶液导电 D、块状纯碱在干燥空气中变成粉末
3、下列各组中,两种气体的分子数一定相等的是
A、温度相同,体积相同的O2 和N2 B、压强相同,体积相同的O2和N2
C、体积相等,密度相等的CO和NO D、质量相等,密度不等的C2H4和N2
4、必须加入氧化剂才能实现的是
A、Cl2 → NaClO B、Fe2+ → Fe3+ C、H2S → S D、Na2SO3 → Na2SO4
5、用铁酸钠(Na2FeO4)对来自河湖的淡水消毒净化是城市饮用水处理新技术,下列对用于饮用水净化处理的分析正确的是
A.Na2FeO4的溶液显强碱性,能消毒杀菌
B.在Na2FeO4中Fe为+6价,具有强氧化性,能消毒杀菌
C.Na2FeO4的还原产物Fe3+易水解为Fe(OH)3 胶体,可使水中悬浮物凝聚沉降
D、Na2FeO4的还原产物Fe2+易水解为Fe(OH)2 胶体,可使水中悬浮物凝聚沉降
6、用H2 还原mgCuO,当大部分固体变红时停止加热,冷却后称量,知残留固体质量为 ng,共用去WgH2 ,则被还原的CuO的质量为
A、40Wg B、g C、5(m-n)g D、mg
7、(2007全国卷重庆考题)11.如题11图所示,下列叙述正确的是
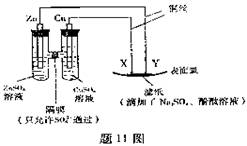 A.Y为阴极,发生还原反应
A.Y为阴极,发生还原反应
B.X为正极,发生氧化反应
C.Y与滤纸接触处有氧气生成
D.X为滤纸接触处变红
8、某一元弱酸稀溶液和某一元强碱稀溶液等体积混合后,其pH等于7.0。则下列叙述正确的是
A.酸液的物质的量浓度大于碱液的物质的量浓度
B.酸液中H+的浓度大于碱液中的OH-的浓度
C.酸液的物质的量浓度小于碱液的物质的量浓度
D.酸液中H+浓度小于碱液中H+的浓度
二、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个或两个选项符合题意。若正确答案包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就0分。)
9、根据热化学方程式:S(s)+O2(g) = SO2(g);△H=-297.23kJ/mol,分析下列说法中正确的是
A、S(g)+O2(g) = SO2(g);△H= -Q kJ/mol。Q的值大于297.23
B、S(g)+O2(g) = SO2(g);△H= -Q kJ/mol。Q的值等于297.23
C、1molSO2 的键能总和大于1molS和1mol O2的键能总和
D、1molSO2的能量总和大于1molS和1molO2的能量总和
10、已知298K时,2SO2(g)+O2(g)![]() 2SO3(g);△H = -197kJ·mol-1。在相同温度和压强下,向密闭容器中通入2molSO2和1molO2,达到平衡时放出的热量为Q1;向另一个体积相同的容器中通入1molSO2 、0.5molO2
和1molSO3 ,达到平衡时放出热量为Q2。则下列关系正确的是
2SO3(g);△H = -197kJ·mol-1。在相同温度和压强下,向密闭容器中通入2molSO2和1molO2,达到平衡时放出的热量为Q1;向另一个体积相同的容器中通入1molSO2 、0.5molO2
和1molSO3 ,达到平衡时放出热量为Q2。则下列关系正确的是
A.Q2<Q1< 197kJ B.Q2=Q1=197kJ C.Q1<Q2<197kJ D.Q1=Q2<197kJ
11、(2007全国高考江苏卷 )15.下列溶液中各微粒的浓度关系不正确的是
A.0.1 mol·L-1 HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+)
B.1 L 0.l mol·L-1CuSO4·(NH4)2SO4·6H2O的溶液中:
c(SO42-)>c(NH4+))>c(Cu2+)>c(H+)>c(OH-)
C.0.1 mol·L-1NaHCO3溶液中:
c(Na+)+c(H+)+c(H2CO3)=c(HCO3-)+c(CO32-)+c(OH-)
D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:
c(Na+)>c(HX)>c(X-)>c(H+)>(OH-)
12、(2007全国卷天津考题 )l2.下列有关工业生产的叙述正确的是
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的C12进入阳极室
D.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
13、下列事实可以证明氨水是弱碱的是
A、0.1mol/L的氨水可以使酚酞试液变红 B、0.1mol/L的氯化铵溶液的pH约为5
C、在相同条件下,氨水溶液的导电性比强碱溶液弱 D、铵盐受热易分解
14、一定条件下,可逆反应C(s) + CO2(g)![]() 2CO(g);△H>0,达到平衡状态,现进行如下操作:
2CO(g);△H>0,达到平衡状态,现进行如下操作:
①升高反应体系的温度; ②增加反应物C的用量;
③缩小反应体系的体积; ④减少体系中CO的量。
上述措施中一定能使反应的正反应速率显著加快的是
A、①②③④ B、①③ C、①② D、①③④
15、(2007全国卷广东考题 )15下列各溶液中,微粒的物质的量浓度关系正确的是
A 1.0mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
B 1.0mol/LNH4Cl溶液:c(NH4+)=c(Cl-)
C 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:
c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-)
16、已知化学键能:Si—Si:M KJ/mol O=O:N KJ/mol Si—O:Q KJ/mol,
则Si (s) + O2 (g) ==SiO2 (s); ΔH=
A.—(4Q—2M—N)KJ/mol B.+(4Q—2M—N)KJ/mol
C.—(2Q—M—2N)KJ/mol D.+(2Q—M—2N)KJ/mol
参考答案:
1.C
2.A
3.D
4.B
5.C
6.C
7.C
8.A
9.C
10.A
11.D ①可用稀盐酸来鉴别 ②可用氢氧化钡来鉴别
③可用新制的氢氧化铜来鉴别
加入氢氧化铜后,能溶解的是乙酸、甲酸,继续加入少量的氢氧化铜并加热到沸腾,如果出现红色沉淀的是甲酸,另一个是乙酸;
加入氢氧化铜后,不能溶解的是乙醛和甲酸甲酯
12.AB
13.BC
14.B
15.BD
16.A分析:晶体硅是原子晶体,每摩尔的晶体硅中含2mol Si—Si
二氧化硅也是原子晶体,每摩尔的二氧化硅晶体中含4mol Si—O
ΔH= —(4Q—2M—N)KJ/mol