选择题强化训练(11)
一、选择题(本题包括8小题,每小题4分,共32分.每小题只有一个选项符合题意.)
1、19世纪中叶,门捷列夫的突出贡献是
(A)提出原子学说 (B)发现元素周期律 (C)提出分子学说 (D)发现氧气
2、下列各组微粒中,核外电子总数相等的是
(A)K+和Na+ (B)CO2和NO2 (C)CO和CO2 (D)N2和CO
3、将某溶液逐滴加入Fe(OH)3溶胶内,开始时产生沉淀,继续滴加时沉淀又溶解,该溶液是
(A)2 mol·L-1H2SO4溶液 (B)2 mol·L-1NaOH溶液
(C)2 mol·L-1MgSO4溶液 (D)硅酸溶胶
 |
4、已知酸性大小:羧酸>碳酸>酚.下列含溴化合物中的溴原子,在适当条件下都能被羟基(-OH)取代(均可称为水解反应),所得产物能跟NaHCO3溶液反应的是
5、钢铁发生吸氧腐蚀时,正极上发生的电极反应是
(A)2H+ +2e - = H2↑ (B)Fe2++2e - = Fe (C)2H2O+O2+4e-=4OH- (D)Fe3+ +e- = Fe2+
6、为实现中国2000年消除碘缺乏病的目标,卫生部规定食盐必须加碘,其中的碘以碘酸钾(KIO3)形式存在.已知在溶液中IO3-可和I-发生反应:IO3- + 5I- + 6H+ = 3I2 + 3H2O,据此反应,可用试纸和一些生活中常见的物质进行实验,证明在食盐中存在IO3-.可供选用的物质有:①自来水,②蓝色石蕊试纸,③碘化钾淀粉试纸,④淀粉,⑤食糖,⑥食醋,⑦白酒.进行上述实验时必须使用的物质是
(A)①③ (B)③⑥ (C)②④⑥ (D)①②④⑤⑦
7、密度为0.91 g·cm-3的氨水,质量百分比浓度为25%(即质量分数为0.25),该氨水用等体积的水稀释后,所得溶液的质量百分比浓度
(A)等于12.5% (B)大于12.5% (C)小于12.5% (D)无法确定
8、有一系列有机物:CH3CH=CHCHO;CH3CH=CH-CH=CHCHO;CH3(CH=CH)3CHO……,在该系列有机物中,分子中碳元素的质量分数的极大值为
A、95.6% B、92.3% C、85.7% D、75%
二、选择题(每小题有1~2个正确答案,每小题5分,10小题共50分)
9、甲基丙烯酸甲酯是世界上年产量超过100万吨的高分子单体,旧法合成的 反应是:
(CH3)2 C=O+HCN—→(CH3)2 C(OH)CN
|
![]()
![]() 90年代新法的反应是: CH3C≡CH + CO + CH3OH CH2=C(CH3)COOCH3
90年代新法的反应是: CH3C≡CH + CO + CH3OH CH2=C(CH3)COOCH3
与旧法比较,新法的优点是
(A)原料无爆炸危险 (B)原料都是无毒物质
(C)没有副产物,原料利用率高 (D)对设备腐蚀性较小
10、下列叙述中,正确的是
(A)含金属元素的离子不一定都是阳离子
(B)在氧化还原反应中,非金属单质一定是氧化剂
(C)某元素从化合态变为游离态时,该元素一定被还原
(D)金属阳离子被还原不一定得到金属单质
11、某溶液含有较多的Na2SO4和少量的Fe2 (SO4)3若用该溶液制取芒硝,可供选择的操作有:
①加适量H2SO4溶液,②加金属Na,③结晶,④加过量NaOH溶液,⑤加强热脱结晶水,⑥过滤.正确
的操作步骤是
(A)②⑥③ (B)④⑥①③ (C)④⑥③⑤ (D)②⑥①③⑤
12、下列各组离子,在强碱性溶液中可以大量共存的是
A、I-、AlO2-、Cl-、S2- B、Na+、K+、NH4+、Ba2+
C、Br-、S2-、Cl-、CO32- D、SO32-、NO3-、SO42-、HCO3-
13、已知铍(Be)的原子序数为4.下列对铍及其化合物的叙述中,正确的是
(A)铍的原子半径大于硼的原子半径 (B)氯化铍分子中铍原子的最外层电子数是8
(C)氢氧化铍的碱性比氢氧化钙的弱 (D)单质铍跟冷水反应产生氢气
14、分别取等质量80℃的甲、乙两种化合物的饱和溶液,降温至20℃后,所析出的甲的质量比乙的大(甲和乙均无结晶水).下列关于甲、乙溶解度的叙述中肯定正确的是
(A)20℃时,乙的溶解度比甲的大 (B)80℃时,甲的溶解度比乙的大
(C)温度对乙的溶解度影响较大 (D)温度对甲的溶解度影响较大
15、下列反应的离子方程式正确的是
(A)氨气通入醋酸溶液中 CH3COOH+NH3=CH3COONH4
(B)澄清的石灰水跟盐酸反应 H++OH-=H2O
(C)碳酸钡溶于醋酸 BaCO3+2H+=Ba2++H2O+CO2↑
(D)金属钠跟水反应 2Na+2H2O=2Na++2OH-+H2↑
16、向50mL 18 mol·L-1H2SO4溶液中加入足量的铜片并加热.充分反应后,被还原的H2SO4的物质的量
(A)小于0.45 mol (B)等于0.45 mol (C)在0.45 mol和0.90 mol之间 (D)大于0.90 mol
17、0.1 mol·L-1NaOH和0.1 mol·L-1NH4Cl溶液等体积混合后,离子浓度大小正确的次序是
(A)[Na+]>[Cl-]>[OH-]>[H+] (B)[Na+]=[Cl-]>[OH-]>[H+]
(C)[Na+]=[Cl-]>[H+]>[OH-] (D)[Cl-]>[Na+]>[OH-]>[H+]
18、下列说法正确的是(N0表示阿伏加德罗常数的值)
(A)在常温常压下,11.2 L N2含有的分子数为0.5 N0
(B)在常温常压下,1 mol Ne含有的原子数为N0
(C)71 g Cl2所含原子数为2 N0
(D)在同温同压时,相同体积的任何气体单质所含的原子数相同
19、CaC2和MgC2都是离子化合物.下列叙述中正确的是
![]()
![]() A、MgC2和CaC2都能跟水反应生成乙炔; B、C22-的电子式为[:C C:]2-
A、MgC2和CaC2都能跟水反应生成乙炔; B、C22-的电子式为[:C C:]2-
C、CaC2在水中以Ca2+和C22-形式存在; D、MgC2的熔点低,可能在100℃以下。
20、将0.1 mol下列物质置于1 L水中充分搅拌后,溶液中阴离子数最多的是
(A)KCl (B)Mg(OH)2 (C)Na2CO3 (D)MgSO4
21、在室温下等体积的酸和碱的溶液,混合后pH值一定小于7的是
(A)pH=3的硝酸跟pH=11的氢氧化钾溶液 (B)pH=3的盐酸跟pH=11的氨水
 (C)pH=3的硫酸跟pH=11的氢氧化钠溶液
(D)pH=3的醋酸跟pH=11的氢氧化钡溶液
(C)pH=3的硫酸跟pH=11的氢氧化钠溶液
(D)pH=3的醋酸跟pH=11的氢氧化钡溶液
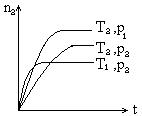
![]() 22、反应2X(g) + Y(g) 2Z(g) ;⊿<0,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是
22、反应2X(g) + Y(g) 2Z(g) ;⊿<0,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是
(A)T1<T2,P1<P2 (B)T1<T2,P1>P2
(C)T1>T2,P1>P2 (D)T1>T2,P1<P2