2001北京市著名重点中学高考模拟试卷精选化学(第九模拟)
第Ⅰ卷 (选择题 共83分)
一、选择题(本题包括5小题,每小题3分,共15分。每小题只有一个选项符合题意)
1.氮元素在自然界的存在形态是 [ ]
A.只有游离态
B.只有化合态
C.只有氮气
D.既有游离态又有化合态
2.将SO2气体徐徐通入悬浮着棕色PbO2的热水中,一段时间后,将发生的现象是 [ ]
A.悬浮物消失,溶液无色
B.悬浮物由棕色变白色
C.有臭鸡蛋气味的气味逸出
D.析出浅黄色沉淀
3.可用酒精灯直接加热的一组仪器是 [ ]
A.蒸发皿、圆底烧瓶
B.试管、烧杯
C.容量瓶、锥形瓶
D.坩埚、蒸发皿
4.以下现象与电化腐蚀无关的是 [ ]
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比软铁芯(几乎是纯铁)容易生锈
C.铁质器件附有铜质配件,在接触处易生铁锈
D.银质奖牌久置后表面变暗
5.已知1 mol白磷变成1 mol红磷放出18.39KJ热。下列两个反应:4P(白、固)+5O2(气)=2P2O5(固)+Q1,4P(红、固)+5O2(气)=2P2O5(固)+Q2,其中Q1与Q2的关系正确的是 [ ]
A.Q1=Q2
B.Q1>Q2
C.Q1<Q2
D.无法比较
二、选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
6.有关CO的叙述,正确的是 [ ]
A.CO是甲酸的酸酐
B.CO中毒是由于呼吸道受刺激而引起的
C.CO与N2是等电子体
D.CO与一些过渡金属在低温下很容易化合
7.某离子X2+的最外层电子数为2。当把固体XCl2溶于水配成溶液时,需加入少量的单质X和盐酸。由此判断下列结论正确的是
[ ]
A.X(OH)2是强碱
B.X元素的最高价氧化物的水化物显强酸性
C.X元素常见的化合价为+2和+4
D.XCl2溶液显酸性
8.下列反应中有电子转移,同时溶液的颜色又发生改变的是
[ ]
A.三氯化铁溶液中加入一定量的锌粉
B.铁片放入硫酸铜溶液中
C.三氯化铁溶液中加入氢氧化钠溶液
D.氢氧化钠溶液中加入铝片
9.下列叙述中错误的是 [ ]
A.在离子晶体中不可能存在非极性键
B.含有阳离子的晶体中,不一定含有阴离子
C.在共价化合物的分子晶体中,只能含有共价键
D.在原子晶体中不可能存在极性共价键
10.下列措施肯定能使化学反应速率增大的是 [ ]
A.增加反应物的量
B.增大压强
C.升高反应温度
D.使用催化剂
11.下列四种溶液中,由水电离生成的氢离子浓度之比①∶②∶③∶④是 [ ]
①pH=0的盐酸;②0.1mol/L的盐酸;③0.01 mol/L的NaOH溶液;④pH=11的NaOH溶液
A.1∶10∶100∶1000
B.0∶1∶12∶11
C.14∶13∶12∶11
D.14∶13∶2∶3
12.下列离子方程式表达正确且为复分解反应的是 [ ]
A.硫酸铵溶液中滴入氢氧化钡溶液:
![]()
B.硫代硫酸钠溶液中滴入稀硫酸:
![]()
C.等物质的量浓度的硫酸铝溶液与烧碱溶液按体积比1∶8混合:
![]()
D.将氯化铁溶液滴入氢硫酸中
2Fe3++3H2S====Fe2S3↓+6H+
13.在相同条件下(T=500℃),相同体积的甲、乙两容器,甲容器充入1gSO2和1gO2,乙容器充入2gSO2和2gO2。下列叙述中错误的是 [ ]
A.化学反应速度乙>甲
B.平衡后O2的浓度乙>甲
C.SO2的转化率乙>甲
D.平衡后O2的体积百分含量乙>甲
三、选择题(本题包括9小题,每小题4分,共36分。每小题只有一个选项符合题意。)
14.元素A不存在同位素,阴离子A2-有x个电子,若A元素的原子质量数为m,则n gA2-阴离子所含中子的物质的量为 [ ]
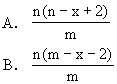
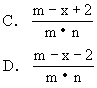
15.工业上用NH3和CO2合成尿素[CO(NH2)2],已知下列物质在一定条件下均能与水反应生成H2和CO2,若从原料充分利用的角度应选择什么最好? [ ]
A.CO
B.石脑油(C5H12~C6H14)
C.CH4
D.焦炭
16.在某温度下,将2 mol A和3 mol B充入一密闭容器中,发生反应:
aA(气)+B(气) ![]() C(气)+D(气)
C(气)+D(气)
5 min后达到平衡。已知各物质的平衡浓度的关系为:
[A]a[B]=[C][D]
若在温度不变的情况下将容器的体积扩大为原来的10倍,其A的转化率不发生变化,则B的转化率为 [ ]
A.60%
B.40%
C.24%
D.4%
![]()
含离子浓度最小的是 [ ]
A.蒸馏
B.加热煮沸
C.用石灰纯碱法
D.用离子交换法
18.将含有0.400 molCu(NO3)2和0.400 mol KCl的水溶液1L,用惰性电极电解一段时间后,在一个电极上能析出0.300 mol铜,此时在另一电极上放出的气体在标准状况下的体积约为 [ ]
A.3.36L
B.大于5.6L小于6.72L
C.6.72L
D.大于3.36L小于5.6L
19.某态烃0.5 mol能与1 mol HCl完全加成,加成后的产物分子内的氢原子又可被3 molCl2取代,则此气态烃可能是 [ ]
A.CH≡CH
B.CH2===CH2
C.CH3—C≡CH
D.CH2===C(CH3)2
20.在铁与铜的混合物中,加入一定量的稀硝酸,充分反应后剩有部分金属;再向其中加入一定量的稀硫酸,充分反应后还剩有金属。加入稀硫酸前的溶液中 [ ]
A.只有Fe2+
B.既有Fe2+,又有Cu2+
C.一定含有Fe2+、不含Fe3+,可能含Cu2+
D.Fe2+、Cu2+、Fe3+都有
21.在O2中灼烧0.44g硫和铁组成的化合物,使其中的硫全部变为SO2,把这些SO2全部转化为H2SO4,这些H2SO4可以用20mL0.5 mol/L的NaOH溶液完全中和,则原化合物的化学式为 [ ]
A.FeS
B.FeS
C.Fe2S3
D.Fe3S4
22.下列物质中①CH3(CH2)2CH3②CH3(CH2)3OH ③(CH3)2CHCH2Cl ④C(CH3)4 ⑤CH3(CH2)2CH3其沸点由高到低排列的顺序是 [ ]
A.③②④①⑤
B.②③①④⑤
C.②③④①⑤
D.③②①④⑤
第Ⅱ卷 (非选择题 共67分)
四、(本题包括2小题,共20分)
23.(6分)可用于分离或提纯物质的方法有:
①分馏 ②盐析 ③过滤 ④重结晶 ⑤升华 ⑥渗析 ⑦电解 ⑧加热分解 ⑨蒸馏
下列各组混合物的分离或提纯应选用上述哪种方法最合适?
A.除去Ca(OH)2溶液中悬浮的CaCO3微粒
B.除去Fe(OH)3胶体中混有的Cl-
C.除去乙醇中溶解的微量食盐
D.分离石油中各种不同沸点范围的成分
E.除去固体碘中混有的少量碘化钠
F.除去氧化钙中的碳酸钙
24.(14分)某学生拟用50mLNaOH溶液吸收CO2气体,制备Na2CO3溶液,为了防止通入CO2气体过量,生成NaHCO3,他设计了如下实验步骤:①用25ml NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;②小心煮沸溶液1—2分钟;③在得到溶液中加入另一半(25mL)NaOH溶液,使溶液充分混合。
(1)他能否制得较纯净的Na2CO3?____。理由是____。
(2)按他的设计,第①步实验装置如下(图9-1):

①装置A使用的试剂是石灰石和盐酸溶液,可否使用纯碱代替石灰石?____,原因是____。
②装置B使用的试剂是____,作用是____。
③为了便于后续实验的煮沸、混合等操作,装NaOH溶液的容器还可使用____(填仪器名称)。
④有人认为实验步骤②、③的顺序对调,即先混合,再煮沸,更合理,你认为对吗?____,为什么?____。
五、(本题包括2小题,共17分)
25.(9分)关于“电解氯化铜溶液时的pH变化”问题,化学界有以下两种不同的观点:
观点一:“理论派”认为电解氯化铜溶液后溶液的pH升高。
观点二:“实验派”经过反复、多次、精确的实验测定,证明电解氯化铜溶液时pH的变化如图9-2曲线关系。
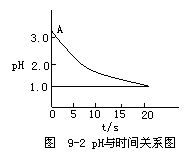
请回答下列问题:
(1)电解前氯化铜溶液的pH处于A点位置的原因是____(用离子方程式说明)。
(2)“理论派”所持观点的理论依据是____。
(3)“实验派”的实验结论是____。他们所述“精确实验”是通过____确定的。
(4)你持何种观点?你所持观点的理由是____(从化学原理加以简述)。
26.(8分)将n mol木炭粉和1 mol氧化亚铁在反应器中混合,隔绝空气加强热。
(1)可能发生的化学反应有:
①FeO+C=Fe+CO↑ ②2FeO+C=2Fe+CO2↑
③FeO+CO=Fe+CO2↑ ④____
![]()
物是____。
(3)若n>4,充分反应后,反应器中的固体物质是,____气体产物是____。
(4)若反应的气体产物是混合物,n的取值范围是____。
(5)若反应的气体产物是混合物,且混合物中CO和CO2的物质的量相等,则n的值为____。
六、(本题包括2小题,共15分)
27.(10分)1993年4月,我国卫生部宣布禁止使用萘作卫生球,因为萘有毒,且易腐蚀化纤产品。提倡用樟脑代替萘,樟脑是我国特产,有愉快香味和强心功效。樟脑的结构简式为C。若已知环状有机物A可简写成B,如下所示。

回答问题:
(1)樟脑的化学式为____。
(2)写出樟脑的一种无甲基、含环烷烃基、能发生银镜反应的同分异构____。
(3)樟脑是从樟树中用水蒸馏出来的,工业上现用α-蒎烯合成,试填写下列方框中有机物的结构简式。

28.(5分)吗啡是严格查禁的毒品。吗啡分子含C 71.58%、H 6.67%、N 4.91%、其余为O。已知其分子量不超过300。试求:(1)吗啡的分子量;(2)吗啡的分子式。
(1)吗啡的分子量是____,分子式是____。
(2)海洛因的分子量是____,分子式是____。
七、(本题包括2小题,共15分)
29.(6分)在20℃NaCl的溶解度为36.0克,取一定量该温度下的饱和NaCl溶液,用惰性电极进行电解,当阳极析出气体11.2升(标准状况下)时,NaCl完全电解,所及溶液的密度为1.20 g·mol-1,试计算:
(1)电解时,所取饱和食盐水的质量;
(2)电解后溶液中NaOH的物质的量浓度;
(3)要使溶液恢复原状态,需加入多少克什么物质。
30.(9分)有CuO和木炭粉组成的混合物4.24g,在高温下充分反应后,剩余固体混合物呈红色,质量为3.36g;若反应后产生的气体能全部被过量的澄清的石灰水吸收,得沉淀2.00g。试通过计算指出所得固体产物的组成及质量分数。