高考化学选择易错题2
1.阿伏加德罗常数约为6.02×1023 mol-1,下列叙述中正确的是
A.1mol∶CH2 所含的电子数目为6NA
B.在含196g H2SO4的浓硫酸溶液中加入足量的锌粉使其充分反应,则反应结束时,转移电子数约为4×6.02×1023个
C.在25℃时,1克纯水中含H+的个数为6.02×1013
 D.常温下含有NA个NO2、N2O4分子的混合气,温度降至标准状况,其体积约为22.4L
D.常温下含有NA个NO2、N2O4分子的混合气,温度降至标准状况,其体积约为22.4L
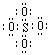
2.冰晶石(化学式为Na3AlF6)的结构单元如右图所示,已知冰晶石熔融时电离方程式为Na3AlF6 =3Na+ + AlF6—●位于大立方体顶点和面心 ○位于大立方体的12条棱的中点和8个小立方体的体心那么大立方体的体心处▽所代表的微粒是
 A.Na+ B.Al3+
C.F—
D.AlF6—3.SO42-和 S2O82-结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。下列说法正确的是
A.Na+ B.Al3+
C.F—
D.AlF6—3.SO42-和 S2O82-结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。下列说法正确的是
A.SO42-的电子式为
B.S2O82-中没有非极性键
C.S2O82-比SO42-稳定
D.S2O82-有强氧化性
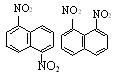 4.在一定条件下,萘可以被硝硫混酸硝化生成二硝基物,它是 1,5-二硝基萘和1,8-二硝基萘的混合物。后者可溶于质量分数大于98%的硫酸,而前者不能。利用这一性质可以将这两种异构体分离。将上述硝化产物加入适量的98%硫酸,充分搅拌,用耐酸漏斗过滤,欲从滤液中得到固体1,8-二硝基萘,应采取的最佳方法是
4.在一定条件下,萘可以被硝硫混酸硝化生成二硝基物,它是 1,5-二硝基萘和1,8-二硝基萘的混合物。后者可溶于质量分数大于98%的硫酸,而前者不能。利用这一性质可以将这两种异构体分离。将上述硝化产物加入适量的98%硫酸,充分搅拌,用耐酸漏斗过滤,欲从滤液中得到固体1,8-二硝基萘,应采取的最佳方法是
A.蒸发浓缩结晶 B.向滤液中加水后过滤
C.用Na2CO3溶液处理滤液 D.将滤液缓缓加入水中后过滤
5.已知在酸性条件下有以下反应关系:
①KBrO3能将KI氧化成I2或KIO3,本身被还原为Br2;②Br2能将I—氧化为I2; ③KIO3能将I—氧化为I2,也能将Br—氧化为Br2,本身被还原为I2。 向KI的硫酸溶液中滴加少量KBrO3溶液后,所得产物除水外还有
A.Br2、Br—、I2 B.Br—、I2 C.Br—、I2、IO3— D.Br—、IO3—
6.磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性。制备时将FeSO4和Fe2(SO4)3的溶液等物质的量混合,滴入稍过量的氢氧化钠溶液,随后加入油酸钠溶液,即可生成黑色、分散质粒子直径在5.5nm~36nm的磁流体。下列说法正确的是
A.所得的分散系属于胶体,可发生丁达尔效应
B.所得的分散系中,分散质的主要成分为FeO
C.该分散系进行电泳实验时,阳极周围黑色加深
D.往油酸钠水溶液中滴加浓溴水振荡,溴水褪色并有固体析出
![]() 7.某些电解质分子的中心原子最外层电子未达饱和结构,其电离采取结合溶液中其他离子的形式,而使中心最外层电子达到饱和结构。例如:硼酸分子的中心原子B最外层电子并未达到饱和,其在水中的电离过程为:下列判断正确的是
7.某些电解质分子的中心原子最外层电子未达饱和结构,其电离采取结合溶液中其他离子的形式,而使中心最外层电子达到饱和结构。例如:硼酸分子的中心原子B最外层电子并未达到饱和,其在水中的电离过程为:下列判断正确的是
A.往水中加酸或碱后,一定抑制水的电离
B.硼酸是两性化合物,它属于三元弱碱,一元弱酸
C.硼酸溶液与NaOH溶液反应的离子方程式为:H3BO3+OH-=[B(OH)4]-
D.1mol H3BO3在浓H2SO4催化下,最多与3 mol C2H5OH发生酯化,生成B(OCH2CH3)3
8.已知Al和Ga是同族元素,且都是两性元素,并知Al(OH)3的碱性比Ga(OH)3大。若将等物质的量的Al和Ga溶于NaOH溶液中,然后再通入CO2,则
A.Ga(OH)3先沉淀 B.Al(OH)3和Ga(OH)3同时沉淀
C.Al(OH)3先沉淀 D.无法判断两种沉淀的先后顺序
 9.现有H2SO4、BaCl2、K2CO3、FeSO4和氯水五种溶液,有如图所示的相互反应,图中每条连线两端的物质可以发生反应。下列判断不合理的是
9.现有H2SO4、BaCl2、K2CO3、FeSO4和氯水五种溶液,有如图所示的相互反应,图中每条连线两端的物质可以发生反应。下列判断不合理的是
A.Y一定是K2CO3 B.X一定是H2SO4
C.Z可能是氯水 D.M、N必定各为BaCl2、FeSO4中的一种
10.下列三种有机物是某些药物中的有效成分。
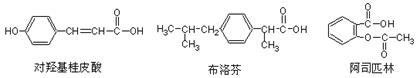
下列说法正确的是
A.三种有机物都能发生水解反应
B.三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种
C.将等物质的量的三种物质加入氢氧化钠溶液中,对羟基桂皮酸消耗氢氧化钠最多
D.使用FeCl3溶液和稀酸可以鉴别这三种有机物
11.一些烷烃的燃烧热(KJ/mol)如下表:
| 化合物 | 燃烧热 | 化合物 | 燃烧热 |
| 甲烷 | 891.0 | 正丁烷 | 2878.0 |
| 乙烷 | 1560.8 | 异丁烷 | 2869.6 |
| 丙烷 | 2221.5 | 2-甲基丁烷 | 3531.3 |
下列表达正确的是
A.热稳定性:正丁烷>异丁烷
B.乙烷燃烧的热化学方程式为:
2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g) ΔH=-1560.8KJ/mol
C.正戊烷的燃烧热大约在3540 KJ/mol左右
D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
12.科学家致力于CO2“组合转化”的技术研究,把过多的 CO2转化为有益于人类的物质,如将CO2和H2混合,在一定条件下以1∶3的比例发生反应,生成某种重要的化工原料和水,该化工原料可能是
A.烷烃 B.烯烃 C.炔烃 D.芳香烃
13.经X射线证明,PCl5在晶体状态时,由分别是正四面体和正八面体的两种离子构成,关于PCl5在晶体的推断正确的是
A.由[ PCl3 ]2+ 和[ PCl7 ]2-离子构成,且数目之比为1:1
B.由[ PCl4 ]+ 和[ PCl6 ]—离子构成,且数目之比为1:1
C.PCl5固体是离子晶体
D.PCl5晶体具有良好的导电性
14.常温下,将一元酸HA的溶液与一元碱BOH的溶液等体积混合。若所得溶液显酸性,下列有关判断一定正确的是
A.若混合前酸、碱溶液的PH之和等于14,则HA是弱酸
B.若酸、碱溶液的物质的量浓度相等,则BOH是弱碱
C.水的电离程度:混合后溶液>纯水>BOH溶液
D.混合后溶液离子浓度关系:c(B+)>c(A-)>c(H‑)>c(OH-)
15.绿色化学己成为当前化学研究的热点和前沿,旨在从源头上消除污染,实现经济和社会可持续发展。而常温离子液体(ionic liquid)(也有称常温熔融盐)以其优异的理化特性最有可能使上述理想变为现实。1914年报道的第一种离子液体硝酸乙基铵〔(C2H5NH3)NO3〕离子液体其熔点为12℃。已知C2H5NH2结合质子的能力比NH3略强,下列有关硝酸乙基铵的说法正确的是
A.离子液体可以作为电池的电解质
B.硝酸乙基铵水溶液呈碱性
C.硝酸乙基铵水解的离子方程式或表示为:C2H5NH3++H2O=C2H5NH2+H3O+
D.同温度下相同物质的量浓度的硝酸乙基铵溶液和硝酸铵溶液前者的pH值小
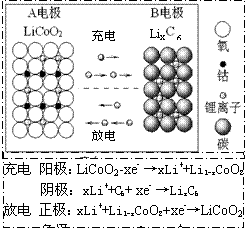 16.锂离子电池主要利用碳的还原和氧化进行工作,比传统的镉镍电池、氢镍电池性能更优越(如右图)。则下列叙述正确的是
16.锂离子电池主要利用碳的还原和氧化进行工作,比传统的镉镍电池、氢镍电池性能更优越(如右图)。则下列叙述正确的是
A.充电过程中,B极被氧化
![]() B.该电池充放电的总反应式为:
B.该电池充放电的总反应式为:
LiCoO2+C6 Li1-xCoO2+LixC6
C.放电时A极是负极,Li发生还原反应
D.放电时B极是负极,C6X-发生氧化反应
17.把Ca(OH)2放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s)![]() Ca2++
2OH-下列说法正确的是
Ca2++
2OH-下列说法正确的是
A.恒温下向溶液中加CaO,溶液的pH升高
B.给溶液加热,溶液的pH升高
C.向溶液中加入Na2CO3溶液,其中固体质量增加
D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
18.已知Cu(NO3)2受热分解的化学反应方程式为: Cu(NO3)2==2CuO+4NO2+O2 ,某人将少量的Cu(NO3)2固体放入试管中加热,然后用带火星的木条放入试管中,木条复燃,则下列说法正确的是
A.NO2能支持燃烧
B.NO2不能支持燃烧
C.木条复燃是因为硝酸铜分解产生了氧气的缘故
D.木条复燃是因为硝酸铜分解产生了氧气和二氧化氮共同作用的结果
![]() 19.对于以下给出的可逆反应:A+2B 2C(正反应放热),已知C是气体,达平衡后同时升高温度并降低压强,又达到新的平衡。若第二次平衡时混和物中C的含量与第一次平衡相同,则下列推断正确的是
19.对于以下给出的可逆反应:A+2B 2C(正反应放热),已知C是气体,达平衡后同时升高温度并降低压强,又达到新的平衡。若第二次平衡时混和物中C的含量与第一次平衡相同,则下列推断正确的是
A.A不一定是气态物质 B.A一定是气态物质
C.B一定不是气态物质 D.B一定是气态物质
20.下列实验操作或叙述正确的是
①用pH试纸测得氯水的pH为2
②不宜用瓷坩埚灼烧氢氧化钠或碳酸钠固体
③为了提高纯锌与稀硫酸反应的速率,可向稀硫酸中滴入几滴CuSO4溶液;
④用蒸馏水润湿PH试纸溶液的PH一定有误差
⑤向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,可以制得Fe(OH)3胶体
⑥实验室配制氯化亚锡溶液时,可先将氯化亚锡溶解在盐酸中,再加入蒸馏水稀释,最后加入少量锡粒
⑦向饱和 NaCl 溶液中滴加浓硫酸制备 HCl
⑧亚硫酸钠与浓硫酸反应制备SO2
