高考化学模拟试卷(三)
化 学
本试卷分第一卷(选择题)和第二卷(非选择题)两部分,全卷满分150分。考试时间120分钟。
可能用到的原子量:H—1;Li—7;C—12;N—14;O—16;Fe—56;Cu—64
第I卷(选择题,共74分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1、今年是第37个“世界地球日”,宣传主题是“善待地球——珍惜资源、持续发展”。下列活动或行为不符合这一主题的是
A、发展循环经济,构建资源节约型社会及清洁生产技术
B、采用绿色化学生产工艺,建立环境友好型化工体系
C、大力开发可再生资源,推广用乙醇汽油代替传统的燃油
D、设计化学实验方案时,提倡用尽可能多的样品和试剂以提高实验效果
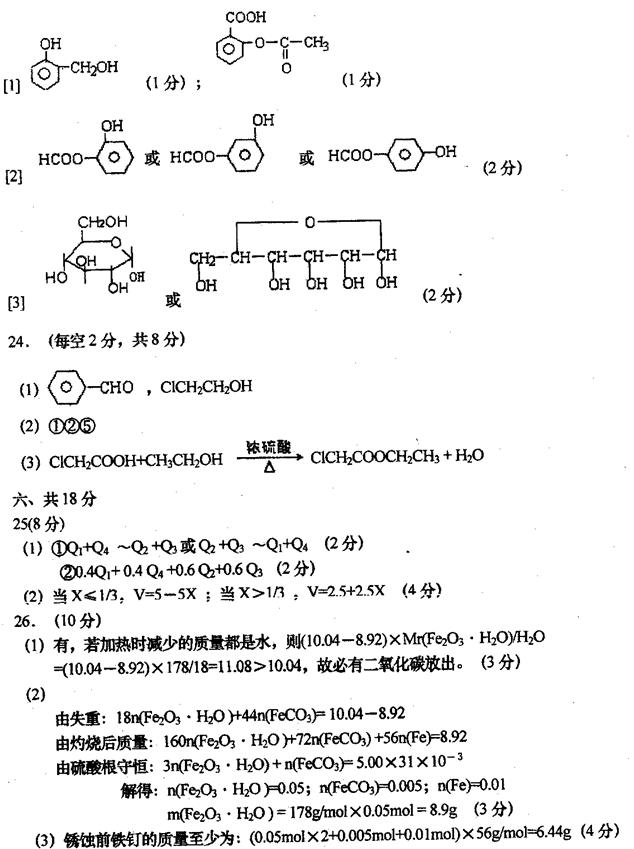
 2、2006年3月2日英国《泰晤士报》报道说,英国食品标准局在对英国与法国贩售的芬达汽水、美年达橙汁等230种软饮料检测,发现含有高量的致癌化学物质——苯,报道指出汽水中如果同时含有苯甲酸钠(防腐剂,C6H5COONa)与维生素C(抗氧化剂,结构式如图)可能会相互作用生成苯、苯与血癌(白血病)的形成也有密不可分的关系。下列说法一定不正确的是
2、2006年3月2日英国《泰晤士报》报道说,英国食品标准局在对英国与法国贩售的芬达汽水、美年达橙汁等230种软饮料检测,发现含有高量的致癌化学物质——苯,报道指出汽水中如果同时含有苯甲酸钠(防腐剂,C6H5COONa)与维生素C(抗氧化剂,结构式如图)可能会相互作用生成苯、苯与血癌(白血病)的形成也有密不可分的关系。下列说法一定不正确的是
A、苯是非极性分子
B、苯在一定条件下能发生取代反应和加成反应
C、维生素C在碱性溶液中能稳定存在
D、维生素C可溶于水
3、最近俄罗斯科学家用铪和钨两种核素精确测定了地球和月球的年龄,得出月球至少比地球早700万年形成,它们是根据182 72Hf(铪—182)和182 74W(钨—182)两种核素的含量比例得出的。下列有关铪—182和钨—182的关系说法正确的是
A、互为同位素 B、都属于镧系元素 C、中子数相等 D、原子质量几乎相同
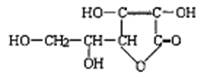
 4、桶烯(Barrelene)结构简式如右图所示,有关说法不正确的是
4、桶烯(Barrelene)结构简式如右图所示,有关说法不正确的是
A、桶烯分子中所有的原子在同一平面内
B、桶烯在一定条件下能发生加聚反应
C、桶烯与苯乙烯(C6H5CH=CH2)互为同分异构体
D、桶烯中的一个氢原子被氯原子取代,所得产物只有两种
5、下列实验方案设计正确的是
A、分解高锰酸钾制氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤
B、失去标签的硝酸银溶液、稀盐酸、氢氧化钠溶液、氯化铝溶液可选用碳酸铵溶液作鉴别试剂
C、用铜丝代替铂丝做焰色反应
D、在裂化汽油中加入酸性高锰酸钾、振荡后若紫色褪去即可证明其中含甲苯等苯的同系物
6、下列各组离子在指定条件下,一定能大量共存的是
A、能使红色石蕊试纸显蓝色的溶液:K+、Fe2+、SO42—、NO3—、Cl—
B、能使碘化钾淀粉试纸变蓝的溶液:Na+、NH4+、S2—、Br—
C、水电离出的c(H+)=10—12mol/L的溶液:Ba2+、Na+、NO3—、Cl—
D、加入铝条有氢气放出的溶液:Na+、NH4+、HCO3—、NO3—
7、用NA表示阿伏加德罗常数,下列说法正确是
A、每molFeS2在沸腾炉中完全燃烧,转移44NA个电子
B、标准状况下B2H6和C2H4的混合气体22.4L,所含电子数约为16NA
C、138.8gNa2SO4与Na2SO3的混合物,若含1mol硫原子,则含3.5NA个氧原子
D、1LPH=9的CH3COONa溶液中,由水电离出的氢离子数为10—9NA个
8、断裂一个给定的键时所消耗的能量称为离解能,提供下列烷烃的C—H键的离解能:
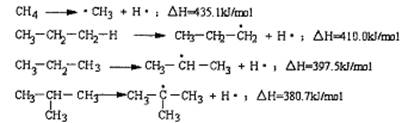
根据提供数据判断下列说法不正确的是
A、离解能愈小,C—H键易断裂,氢原子越易被取代
B、在光照条件下丙烷与氯气发生取代反应CH3CH2CH2Cl与CH3CHClCH3的物质的量之比为1:1
C、异丁烷与氯气发生取代反应,(CH3)3CCl占一氯代物的物质的量分数大于105
D、C2H6中C—H的离解能介于410.0 kJ /mol~435.1kJ/mol
二、选择题(本题包括10小题,第9-16题每小题4分,第17、18题每小题5分,共42分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
9、下列离子方程式书写正确的是
A、NaHSO3溶液显酸性是因为:HSO3—+H2O==SO32—+H3O+
![]() B、尼泊金酸(
)与碳酸氢钠溶液反应:
B、尼泊金酸(
)与碳酸氢钠溶液反应:
![]()
![]() +2HCO3——→
+ CO2↑+2H2O
+2HCO3——→
+ CO2↑+2H2O
C、电解饱和食盐水时阴极电极反应式为:2H++2e—==H2↑
D、1L2mol/L的FeBr2溶液中通入2.5molCl2:2Fe2++4Br—+3Cl2==6Cl—+2Fe3++2Br2
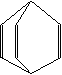
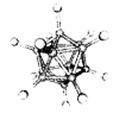 10、中子俘获治疗癌症(缩写为NCT)是一种新的化疗方法,化疗时用到的药物BSH,合成时必须经过中间体Na2B12H12,它可有B2H6和NaBH4以二甘二甲醚为溶剂,在180℃时合成的,已知B12H122—粒子结构如右图。有关B12H122—的说法不正确的是
10、中子俘获治疗癌症(缩写为NCT)是一种新的化疗方法,化疗时用到的药物BSH,合成时必须经过中间体Na2B12H12,它可有B2H6和NaBH4以二甘二甲醚为溶剂,在180℃时合成的,已知B12H122—粒子结构如右图。有关B12H122—的说法不正确的是
A、该离子中硼原子间构成20个正三角形
B、一个B12H122—粒子中含有30个硼硼键
![]() C、Na2B12H12属共价化合物
C、Na2B12H12属共价化合物
D、合成Na2B12H12反应可表示为5 B2H6+2NaBH4 Na2B12H12+13H2
11、锂钒氧化物电池的能量密度远远超过其它材料电池,其成本低,便于大量推广,且对环境无污染。电池总反应式为:V2O5+xLi==LixV2O5。下列说法不正确的是
A、正极材料为锂,负极材料为V2O5
B、向外供电时,锂离子在凝胶中向正极移动
C、正极的电极反应式为:V2O5 + xe—== LixV2O5
D、负极的电极反应式为:xLi—xe—==xLi+
12、X、Y是周期表前二十号元素,已知X、Y之间原子序数相差3,X、Y易形成化合物M。下列有关说法正确的是
A、X、Y可能都是金属
B、若X的单质常温下是气体,则Y的单质常温下也是气体
C、若X、Y处于同一周期,则化合物M可能是非极性分子
D、X、Y两元素周期数差1,属于离子化合物的M只有三种
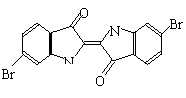 13、泰雅紫是古代地中海沿岸出产的一种贵重燃料,罗马帝王用法律规定,只有皇族与教主可穿这种紫色衣袍。当时人们是从小的紫蜗牛中提取它的,制备1.5g泰雅紫需要多达12000只紫蜗牛,现知其结构为如右图所示的含溴有机化合物,下列说法不正确的是
13、泰雅紫是古代地中海沿岸出产的一种贵重燃料,罗马帝王用法律规定,只有皇族与教主可穿这种紫色衣袍。当时人们是从小的紫蜗牛中提取它的,制备1.5g泰雅紫需要多达12000只紫蜗牛,现知其结构为如右图所示的含溴有机化合物,下列说法不正确的是
A、泰雅紫分子的分子式为:C16H8N2Br2O2
B、泰雅紫不存在同分异构体
C、泰雅紫属于烃的衍生物
D、检验泰雅紫中溴元素可直接加入硝酸银溶液,看是否有浅黄色沉淀
14、二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂。常温下是一种橙黄色有恶臭的液体,它的分子结构与H2O2类似,熔点为193K,沸点为411K,遇水很容易水解,产生的气体能使品红褪色,S2Cl2可由干燥氯气通入熔融的硫中制得,下列有关说法正确的是
A、S2Cl2分子空间构型为正四面体形
B、固态时S2Cl2属于原子晶体
C、S2Cl2水解的化学方程式可能为:2S2Cl2 +2H2O== 4HCl + SO2↑ + 3S↓
![]() D、S2Cl2的电子式为:
D、S2Cl2的电子式为:
15、铜的冶炼大致可分为:
⑴富集,将硫化物矿进行浮选;
⑵焙烧,主要反应为:2CuFeS2+4O2==Cu2S+3SO2+2FeO(炉渣);
⑶制粗铜,在1200℃发生的主要反应为:2Cu2S+3O2 ==2Cu2O+2SO2;2Cu2O+ Cu2S==6 Cu+SO2↑;
⑷电解精炼
下列说法正确的是
A、上述灼烧过程的尾气均可直接排空
B、由6mol CuFeS2生成6molCu,上述共消耗15molO2
C、在反应2Cu2O+ Cu2S==6 Cu+SO2↑中,作氧化剂的只有Cu2O
D、电解精炼时,粗铜应与外电源正极相连
16、青石棉(crocidolite)是世界卫生组织确认的一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一,青石棉的化学式为:Na2Fe5Si8O22(OH)2,青石棉用稀硝酸溶液处理时,还原产物只有NO,下列说法正确的是
A、青石棉是一种易燃品且易溶于水
B、青石棉的化学组成用氧化物的形式可表示为:Na2O·3FeO ·Fe2O3·8SiO2 ·H2O
C、1mol Na2Fe5Si8O22(OH)2与足量的硝酸作用,至少需消耗6L3mol/LHNO3溶液
D、1mol Na2Fe5Si8O22(OH)2与足量氢氟酸作用,至少需消耗5.5L2mol/LHF溶液
17、在恒温恒容的密闭容器中,发生反应3A(g)+B(g)
![]() xC(g)。
xC(g)。
Ⅰ、将3molA和2molB在一定条件下反应,达平衡时C的体积分数为a;
Ⅱ、若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。
下列说法正确的是
A、若Ⅰ达平衡时,A、B、C各增加1mol,则B的转化率将一定增大
B、若向Ⅰ平衡体系中再加入3molA和2molB,C的体积分数若大于a,可断定x>4
C、若x=2,则Ⅱ体系起始物质的量应当满足3 n(B) =n(A)+3
D、若Ⅱ体系起始物质的量当满足3 n(C) +8n(A)==12 n(B)时,可断定x=4
18、将amol/L的Na2CO3溶液与bmol/L的NaHCO3溶液等体积混合,所得溶液中粒子浓度间的关系及相关判断不正确的是
A、c(Na+)+ c(H+)>c(CO32—)+ c(HCO3—)+ c(OH—)
B、c(Na+)>c(CO32—)+ c(HCO3—) +c(H2CO3)
C、若c(Na+)> c(HCO3—) >c(CO32—)>c(OH—)>c(H+),则一定a<b
D、若c(CO32—)+2 c(OH—)==2c(H+)+ c(HCO3—)+3 c(H2CO3),则可确定a=b
第Ⅱ卷(非选择题 共76分)
三、(本题包括2小题,共22分)
19、(14分)试完成下列两小题:
⑴(4分)化学实验必须注意安全,下列做法存在安全隐患的是 (选填序号)
A、氢气还原氧化铜实验中,先加热氧化铜后通氢气
B、蒸馏石油时,加热一段时间后发现未加碎瓷片,立刻拔开橡皮塞并投入碎瓷片
C、实验室做钠的实验时,余下的钠屑投入到废液缸中
D、配制浓硫酸与酒精混合液时,将1体积的酒精倒入3体积的浓硫酸中
E、皮肤上沾有少量浓硝酸时,立刻用大量水冲洗,再涂上稀碳酸氢钠溶液
F、制乙烯时,用量程为300℃的温度计代替量程为200℃的温度计,测反应液的温度
⑵(10分)间接碘量法测定胆矾中铜含量的原理和方法如下:
已知:在弱酸性条件下,胆矾中Cu2+与I—作用定量析出I2,I2溶于过量的KI溶液中:
I2+I-==I3-,又知氧化性:Fe3+>Cu2+>I2>FeF63-
析出I2可用cmol/LNa2S2O3标准溶液滴定:2S2O32-+I3-==S4O62-+3I-。
准确称取ag胆矾试样,置于250mL碘量瓶(带磨口塞的锥形瓶)中,加50mL蒸馏水、5mL3mol/LH2SO4溶液,加少量NaF,再加入足量的10%KI溶液,摇匀。盖上碘量瓶瓶盖,置于暗处5min,充分反应后,加入1~2mL0.5%的淀粉溶液,用Na2S2O3标准溶液滴定到蓝色褪去时,共用去VmL标准液。
①实验中,在加KI前需加入少量NaF,推测其作用可能是
②实验中加入,你认为硫酸的作用是
③本实验中用碘量瓶而不用普通锥形瓶是因为:
④硫酸铜溶液与碘化钾溶液反应生成白色沉淀(碘化亚铜)并析出碘,该反应的离子方程式为:
⑤根据本次实验结果,该胆矾试样中铜元素的质量分数ω(Cu)=
![]() 20、(8分)溴乙烷是重要的化工原料,实验室制取溴乙烷(沸点38.4℃)的原理及步骤如下:
20、(8分)溴乙烷是重要的化工原料,实验室制取溴乙烷(沸点38.4℃)的原理及步骤如下:
⑴反应原理:C2H5OH+NaBr+H2SO4 NaHSO4+C2H5Br+H2O
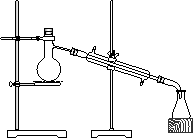 ⑵主要反应装置见下图
⑵主要反应装置见下图
⑶操作步骤:
① 在100mL圆底烧瓶中加入10mL95%乙醇、28mL78%硫酸,
然后加入研细的13g溴化钠。
② 加入几粒碎瓷片,小心摇动烧瓶使其均匀。将烧瓶与直形
冷凝管相连,冷凝管下端连接尾接管。
③ 小心加热,使其充分反应,再进行蒸馏,直到无溴乙烷
流出为止。
④再将锥形瓶中液体冷却后倒入亚硫酸钠溶液中洗涤分液。
试回答下列问题:
①本实验用的是78%的硫酸,为何不用浓硫酸?
②亚硫酸钠溶液的作用是
③该实验中会产生许多生成有机物的副反应,写出化学方程式:
(举一例)
④本次实验只收集到5mL溴乙烷,比理想产量约10mL少,原因是溴乙烷易挥发的缘故,为了减少其损失,你认为可采取什么措施?
四、(本题包括2小题,共18分)
21、(8分)氨是最重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国人哈伯在1905年发明的,其合成原理为:N2(g)+3H2(g)![]() 2NH3(g);△H=—92.4kJ/mol他因此获得了1918年诺贝尔化学奖。试回答下列问题:
2NH3(g);△H=—92.4kJ/mol他因此获得了1918年诺贝尔化学奖。试回答下列问题:
⑴合成氨工业中采取的下列措施可用勒夏特列原理解释的是 (填序号)
A、采用较高压强(20Mpa~50Mpa)
B、采用500℃的高温
C、用铁触媒作催化剂
D、将生成的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2和H2
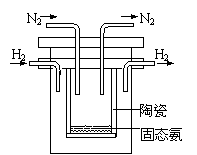
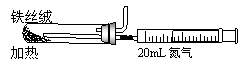 ⑵右图是实验室模拟工业法合成氨的简易装置。
⑵右图是实验室模拟工业法合成氨的简易装置。
简述检验有氨气生成的方法 。
⑶在298K时,将10molN2和30molH2放入合成塔中,
 为何放出的热量小于924kJ?
为何放出的热量小于924kJ?
⑷1998年希腊亚里斯多德大学的Marnellos和Stoukides采用
高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高
转化率的电化学合成氨。其实验装置如图。
阴极的电极反应式 。
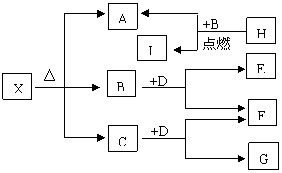 |
22、(10分)已知X是一种盐,H是常见金属单质,
F、I是常见的非金属单质,E、G都是工业上
重要的碱性物质,它们有右图所示的关系,
试回答下列问题:
⑴G的化学式为
⑵写出下列反应的化学方程式
①
②
⑶X在医药上用作解酸剂,与盐酸作用时,生成B的物质的量与消耗盐酸的物质的量之比为3:8,则X的化学式为: X与盐酸反应的化学方程式为: 。
五、(本题包括2小题,共18分)
23、(10分)试完成下列两小题:
Ⅰ、C1化学是指从一个碳原子的化合物(如CH4、CO、CO2、CH3OH、HCHO等)出发合成各种化学品的技术。从煤、天然气制合成气再进一步制备各种化工产品和清洁燃料,已成为当今化学工业发展的必然趋势。其中甲醇是C1化学的基础。
①CO和H2按一定比例可生成乙二醇,则n(CO)/n(H2)= (填数字)。
 ②若汽油平均组成用CmHn表示,则合成汽油应控制n(CO)/n(H2)=
(用m、n表示)
②若汽油平均组成用CmHn表示,则合成汽油应控制n(CO)/n(H2)=
(用m、n表示)
③甲醇在一定条件下与CO、H2作用生成A,A发生加聚可生成高分子 ,写出生成A的化学方程式
Ⅱ、已知醇、醛在一定条件下能发生缩合反应,示例如下:
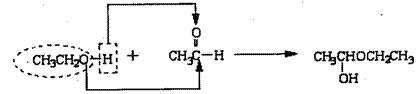 |
已知:
①1827年人们就发现有机物A,它的分子式为C13H18O7,与一分子水作用,水解生成B和C;
②B能发生银镜反应,B也可由淀粉水解得到,B的分子式为C6H12O6;
③C遇氯化铁溶液能发生显色反应,1molC与足量钠反应可生成1molH2;
④C在适当的条件下用适当氧化剂演化,可得D,D的分子式为C7H6O3,相对分子质量D比C大14;
⑤D有两个取代基,但不是间位,它与Br2在催化剂作用下发生一溴取代,产物有四种,D能与碳酸氢钠溶液反应;
⑥D与乙酸酐[(CH3CO)2O]反应,可得到常见药物E和乙酸,E能与碳酸氢钠反应放出二氧化碳。
试回答下列问题:
⑴写出结构简式:C E
⑵写出与D互为同分异构体,含有苯环且含有酯结构的结构简式: (只需写一种);
⑶B通常以六元环状结构存在,写出B的环状结构简式: 。
24、(8分)杨梅酯是制作冰制食品、糖果等的香料,可用A、E两种烃为原料,经如下路线合成
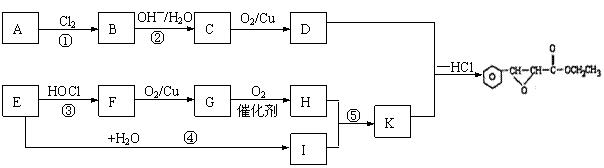 |
试回答下列问题:
⑴写出结构简式:D: ,F:
⑵上述属于取代反应的有 (选填序号)
⑶写出反应⑤的化学方程式:
六、(本题包括2小题,共18分)
25、(8分)丁烷在一定条件下可以按两种方式裂化:C4H10→C2H6+C2H4;C4H10→CH4+C3H6,现对发生裂化反应后的裂化气(不含丁烷)进行研究。
⑴探究裂化气的热值: 已知:
| 气体 | CH4 | C2H6 | C2H4 | C3H6 |
| 燃烧热(kJ/mol) | Q1 | Q2 | Q3 | Q4 |
①若44.8L(标准状况)裂化气充分燃烧放出热量QkJ,则Q的取值范围介于: ~ (用Q1、Q2、Q3、Q4表示,下同)。
②若将44.8L气体(标准状况)缓缓通过盛有足量溴的四氯化碳溶液中,发现洗气瓶增重33.6g,则44.8L(标准状况)气体完全燃烧放出的热量Q= kJ。
⑵测量与H2加成反应后气体总体积与氢气的体积分数关系:
另取裂化气与H2混合得5L混合气体,已知其中H2的体积分数ψ(H2)=X,在一定条件下使其充分反应,反应后气体的体积为VL。请列出V与X的函数关系式。
26、(10分)某资料说铁锈的成分为Fe2O3·H2O和FeCO3的混合物。根据此记载,某实验兴趣小组设计下列实验来验证其中是否含有碳酸亚铁。
①取一高度腐蚀的干燥铁钉,称其质量为10.04g,在氮气保护下,充分加热,冷却后称得质量为8.92g。
②将①得到的残渣投入到5.00mol/L的硫酸中,不断添加硫酸直至残渣完全溶解时,恰好用去硫酸31.00mL。整个过程无气体放出。试回答下列问题:
⑴铁锈中是否含有碳酸亚铁?理由是?
⑵锈蚀的铁钉中含Fe2O3·H2O多少克?
⑶锈蚀前铁钉的质量至少多少克?