高考化学模拟试题
可能用到的相对原子质量:H:1 C:12 O:16 Na:23 S:32 Cl:35.5 Fe:56 Cu:64 Ag:108 I:127
第Ⅰ卷(选择题 共64分)
一.选择题(本题包括8小题,每小题4分,共32分。每小题只有1个选项符合题意)
1. “春蚕到死丝方尽,蜡炬成灰泪始干”,这一诗句中的“丝”和“泪”分别是指
A.蛋白质,烃 B.蛋白质,硬化油
C.淀粉,油脂 D.纤维素,脂肪
2.生活中碰到的某些问题,常涉及到化学知识,下列分析不正确的是
A.Mg(OH)2和Al(OH)3热分解生成的气态水可覆盖火焰、驱逐O2、稀释可燃气体,分解产物MgO
和Al2O3能较快地与塑料燃烧过程中产生的酸性及腐蚀性气体反应,所以它们可以作为未来发展
方向的无机阻燃剂。
B.用灼烧并闻气味的方法区别纯棉织物和纯毛织物。
C.某雨水样品采集后放置一段时间,pH值由4.68变为4.28,是因为水中溶解了较多的CO2。
D.蒙古牧民喜欢用银器盛放鲜牛奶有其科学道理:用银器盛放鲜牛奶,溶入的极微量的银离子,可杀死牛奶中的细菌,防止牛奶变质。
3.下列有关阿伏加德罗常数的叙述正确的是
A.17g OH—含有9×6.02×1023个电子
B.标准状况下,0.5×6.02×1023个甲醛分子所占体积约是11.2L
C.120g熔融硫酸氢钠中含有2×6.02×1023个阳离子
D.标准状况下,含4molHCl的浓盐酸与足量MnO2反应可生成22.4LCl2
4.在相同温度时,100mL 0.01mol/L氨水与10mL 0. 1mol/L氨水相比较,前者一定大于后者的是
A.pH值 B.OH-离子的物质的量
C.NH3•H2O分子的物质的量 D.完全中和时消耗相同浓度盐酸的体积
5.下列依据热化学方程式得出的结论正确的是
A.已知C(石墨, s)=C(金刚石, s); ΔH>0 则金刚石比石墨稳定。
B.已知C(s)+O2(g)= CO2(g);ΔH1 C(s)+1/2O2(g)= CO(g);ΔH2 则ΔH1>ΔH2
C.已知2H2(g)+ O2(g)= 2H2O(g);ΔH=-483.6kJ/mol 则氢气的燃烧热为241.8 kJ/mol。
D.已知NaOH(aq)+HCl(aq)= NaCl(aq) + H2O(l);ΔH=-57.3kJ/mol 则含20gNaOH的稀溶液与稀盐酸完全中和,放出28.65kJ的热量
6.下列各组物质间反应可能包括多步反应,其总的离子方程式正确的是
A.在硫酸工艺流程中,对尾气中的SO2用过量的氨水吸收的反应
2 NH3·H2O + SO2 = 2NH4+ + SO32- +H2O
B.FeCl2在空气中被氧化 4Fe2+ + O2 + 2H2O = 4Fe3+ + 4OH-
C.工业上制备漂粉精的反应 Cl2 + 2OH- = Cl- + ClO- + H2O
D.FeBr2 (aq) 中通入少量Cl2 2Fe2+ + 4Br— + 3Cl2 = 2Fe3+ + 2 Br2 + 6Cl—
7.下列实验报告记录的实验现象正确的是
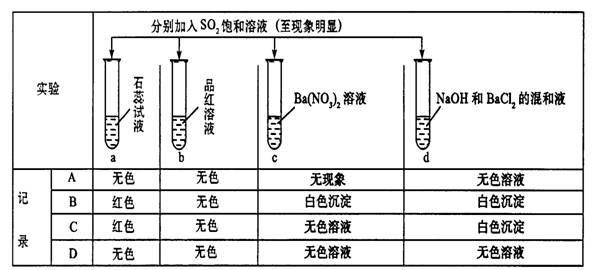 |
8. 在环境检测中常用检气管法来测定空气中S02的含量,原理是S02与KIO3发生反应,用一种有机物作指示剂,其可能反应如下(未配平):
①KIO3 + SO2 + H2O → I2 + H2SO4 + KHSO4 ②KIO3 + SO2 + H2O → KI + H2SO4
则下列说法正确的是
A.检气管法是按照反应①原理设计的
B.检气管法是按照反应②原理设计的
C.反应①②均可以设计成检气管法,但考虑到相同量KIO3 ①消耗SO2少,所以检气管法是按①设计的
D.反应①②均可以设计成检气管法,但考虑到相同量KIO3 ②消耗SO2多,所以检气管法是按②设计的
二.选择题(本题包括8小题,每小题4分,共32分,每题有一个或两个选项符合题意。只有一个选项的,多选不给分;有两个选项的,选对一个给2分,选错一个该题不给分)
9.下列各项的叙述中都包含两个数值,前一数值大于后一数值的是
A.单质碘中的分子间作用力和二氧化碳的分子间作用力
B.NaCl晶体中与一个Cl-紧邻的Na+数和CsCl晶体中与一个Cl-紧邻的Cs+数
C.破坏晶体硅中1 mol Si—Si键所消耗的能量和破坏金刚石中1 mol C—C键所消耗的能量
D.同温度下在100克水中最多能溶解的无水CuSO4和CuSO4·5H2O的质量
10.由一种阳离子与两种酸根离子组成的盐称为混盐。混盐CaOCl2 在酸性条件下可以产生Cl2。
下列关于混盐CaOCl2 的有关判断正确的是
A.该混盐具有和漂白粉相似的化学性质 B.该混盐的水溶液呈中性
C.该混盐与硫酸反应产生1 mol Cl2 时转移1 mol e- D.该混盐中氯元素的化合价为零价
11. 下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已略去),当X是强碱时,过量B跟氯气反应除生成C外,另一产物是盐酸盐。
A![]()
下列说法不正确的是
A.当X是强酸时,ABCDEF均含有一种元素,F是硫酸
B.当X是强碱时,ABCDEF均含同一种元素,F是硝酸
C.B和Cl2的反应是氧化还原反应
D.当X是强酸时,C常温下是气态单质
12.新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式为:
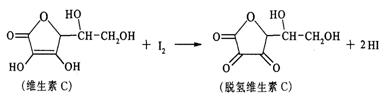
下列说法正确的是
A.上述反应为取代反应 B.滴定时可用淀粉溶液作指示剂
C.滴定时应剧烈振荡锥形瓶 D.脱氢维生素C的分子式为C6H6O6
13.向含下列微粒的溶液中,①HS-、②Fe2+、③![]() 、④
、④![]() 分别加入少量氢氧化钠固体,或少量浓盐酸或几滴酸性KMnO4溶液。(溶液体积变化忽略不计),都使溶液中对应的离子或分子浓度减少的是
分别加入少量氢氧化钠固体,或少量浓盐酸或几滴酸性KMnO4溶液。(溶液体积变化忽略不计),都使溶液中对应的离子或分子浓度减少的是
A.①② B.②③ C.①④ D.③④
14.把SO2通入Fe(NO3)3溶液中,溶液由棕色变为浅绿色,但立即又变为棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀。在上述一系列变化过程中,最终被还原的是
A.SO2 B.Cl - C.Fe3+ D.NO3 -
15.把Ca(OH)2放入蒸馏水中,一段时间后达到如下平衡:Ca(OH)2(s)![]() Ca2+ (aq)+2OH-(aq)。下列说法正确的是
Ca2+ (aq)+2OH-(aq)。下列说法正确的是
A.加热,溶液的pH升高 B.恒温下,加入CaO,溶液pH不变
C.加入CaCl2晶体,Ca(OH)2 固体增多 D.加入Na2CO3晶体, 固体质量减少
16.已知还原性Fe>Cu>Fe2+。现将一定量的m g铁粉加入到某x mol FeCl3和y mol CuCl2的混合溶液中,所得固体质量仍为m g。则x与y的比值可能为
A.2∶7 B. 3∶5 C. 1∶4 D .4∶3
第Ⅱ卷(非选择题 共86分)
三.(本题包括2小题,共22分)
17.(12分)CuO可用作颜料、玻璃磨光剂、有机合成催化剂等。以下是用铜粉氧化法生产CuO的流程图:
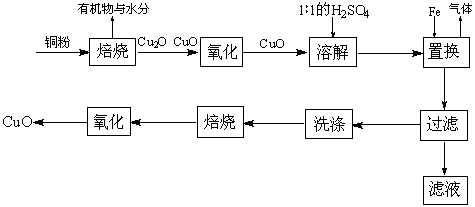
回答下列问题:
(1)写出溶解过程中的离子方程式_____________________________________。
(2)1∶1的H2SO4是用1体积98% H2SO4与1体积水混合而成。配制该硫酸溶液所需的玻璃仪器除玻璃棒外,还需要______________、________________。
(3)该工艺会产生一定量的酸性气体,该气体是_________(写分子式),应加以回收处理。
(4)已知氧化亚铜(Cu2O)与稀H2SO4反应有CuSO4和Cu生成。假设焙烧后固体只含铜的氧化物,为检验该固体的成分,下列实验设计合理的是____________(选填序号)。
(a)加入稀H2SO4,若溶液呈现蓝色,说明固体中一定有CuO
(b)加入稀H2SO4,若有红色沉淀物,说明固体中一定有Cu2O
(c)加入稀HNO3,若有无色气体(随即变成红棕色)产生,说明固体中有Cu2O
(d)加入稀HNO3,若全部溶解,说明固体中没有Cu2O
(5)不考虑生产中的损耗,要计算铜粉中Cu的含量,需要测定的数据是_______________和_____________________(用文字表示)。
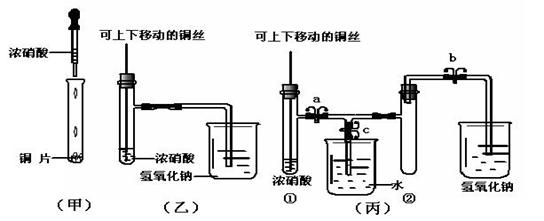 18.(10分)下图甲是课本中验证铜和浓硝酸反应的装置,乙、丙是师生对演示实验改进后的装置:
18.(10分)下图甲是课本中验证铜和浓硝酸反应的装置,乙、丙是师生对演示实验改进后的装置:
(1)甲、乙、丙三个装置中共同发生的离子反应方程式是 。
(2)和甲装置相比,乙装置的优点是 。
(3)为了进一步验证NO2和水的反应,某学生设计了丙装置。先关闭弹簧夹 ,再打开弹簧夹 ,才能使NO2气体充满②试管。
(4)当气体充满②试管后,将铜丝提起与溶液脱离,欲使烧杯中的水进入②试管应如何操作 。
(5)当②试管中的NO2和水充分反应,所得溶液物质的量浓度的最大值是 。(不考虑NO2与N2O4的转化且该实验条件下气体摩尔体积设为Vm L/mol)
四.(本题包括2小题,共18分)
19.(8分)(1)负离子发生器产生的负离子是O2-,它在大气中存在的时间很短。O2、O3、O2- 三种微粒自身所具能量由高到低的顺序是_____________。
(2)某无色溶液中加入一定量盐酸出现了白色浑浊,试推测可能的离子(要求所写的离子是原子团,且一个是阳离子、另一个是阴离子;写出2种)_________、__________ 。
(3)以A、B两根石墨棒作电极,电解硝酸银溶液,通电10分钟时,在B极收集到气体11.2毫升(标况);然后将电源反接,以相同的电流强度再通电5分钟,此时与第一次通电前相比较,两极的质量变化分别是A极__________、 B极________(填“增大”、“减少”、“不变”);若溶液的体积为200毫升(设体积不变),则溶液的pH值为_______。
20.(10分)下图中,A为气体非金属单质,D是空气中含量最多的气体,B、E、Z为无色氢化物,其中B、E为有刺激性气味的气体,C是由三种短周期非金属元素组成的离子化合物,F、I、L为白色沉淀,其中F不溶于稀硝酸,N、P是金属单质;反应②在E的浓溶液中进行,反应⑦在E的稀溶液中进行,反应②、⑦均可用于实验室制取某种气体(图中部分反应物和生成物没有列出)。
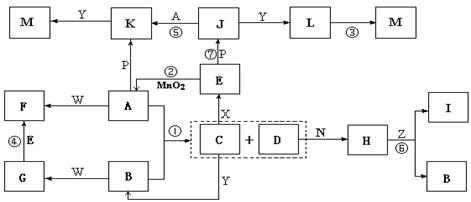
请按要求回答:
(1)写出C的电子式 ,I的化学式 ;
(2)反应③的化学方程式为 ;
(3)反应④的离子方程式为 ;
(4)由C制取E时反应物的状态是 ,由J制取L时反应的环境是 。
五.(本题包括1小题,共10分)
21.(10分)10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为 。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度 (填“大于”或“小于”)NaHCO3。丙同学认为甲、乙的判断都不充分。丙认为:
⑴只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则 (填“甲”或“乙”)判断正确。试剂X是 。
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清的石灰水
⑵将加热后的溶液冷却到10℃,若溶液的pH (填“高于”、“低于”或“等于”)8.3,则 (填“甲”或“乙”)判断正确。
⑶查阅资料,发现NaHCO3的分解温度为150℃,丙断言 (填“甲”或“乙”)判断是错误的,理由是 。
六.(本题包括2小题,共18分)
22.(8分)在有机物分子中,不同位置的氢原子的核磁共振谱中给出的峰值(信号)也不同,
根据峰值(信号)可以确定有机物分子中氢原子的种类和数目。例如二乙醚的结构简式为:
CH3—CH2—O—CH2—CH3其核磁共振谱中给出的峰值(信号)有两个,如图所示:
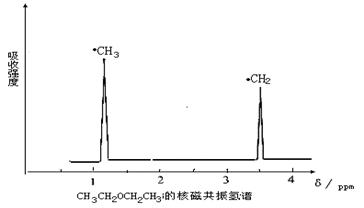
(1)下列物质中,其核磁共振氢谱中给出的峰值(信号)只有一个的是 。
A.CH3CH3 B.CH3COOH C.CH3COOCH3 D.CH3COCH3
(2)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱如下图所示,A的结构简式为 ,请预测B的核磁共振氢谱上有 个峰(信号)
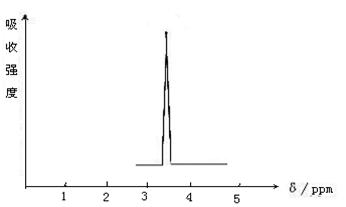
![]()
(3)用核磁共振氢谱的方法来研究C2H6O的结构,请简要说明根据核磁共振氢谱的结果来确定C2H6O分子结构的方法是 。
23.(10分)已知:HCN的结构为H—C≡N;
①R—CN RCOOH,
![]() ②R—Cl+CN-
R—CN+Cl-(R为烃基)。
②R—Cl+CN-
R—CN+Cl-(R为烃基)。
![]() 玉米芯、甘蔗渣等废物水解发酵后可制得糠醛
,它是重要的化工原料,它在一定条件下可发生以下变化:
玉米芯、甘蔗渣等废物水解发酵后可制得糠醛
,它是重要的化工原料,它在一定条件下可发生以下变化:
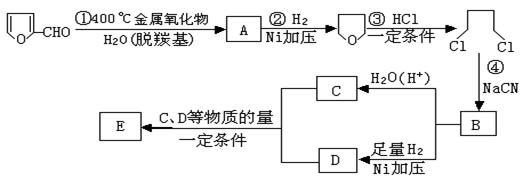
⑴写出反应类型:② ,④ 。
⑵写出反应③的化学方程式: ;
写出能证明糠醛中含有醛基的一个化学反应方程式
。
⑶若E为环状化合物,则其结构简式 。
⑷若E为高聚物,则其结构简式 。
七.(本题包括2小题,共18分)
24.(8分)今有86 g酒石酸样品,其中混有8 g琥珀酸。现要将该样品用结晶法提纯酒石酸,不同温度下两者溶解度见下表(两者共存时不影响各自的溶解度)。
| 温度(℃) | 20 | 30 | 40 | 50 | 70 | 80 |
| 酒石酸溶解度(g/100 g水) | 18 | 25 | 37 | 65 | 81 | 98 |
| 琥珀酸溶解度(g/100 g水) | 7 | 11 | 16 | 36 | 51 | 71 |
(1)80℃时,溶解该样品,应加__________g水(取10的整数倍)最合适。
(2)将该混合液从80℃冷却到20℃,能否析出纯净的酒石酸晶体?请通过计算说明你得出该结论的理由。
(3)要使混合液尽可能多地析出纯净的酒石酸晶体,冷却温度最低为________℃(取10的整数倍),此温度下能析出酒石酸晶体__________g。
25.(10分)(1)测定铜合金中Cu的含量时,可以用硝酸溶解样品,也可用双氧水和盐酸溶解样品。 ①用双氧水和盐酸溶解样品时,发生反应的化学方程式是__ __,此法与硝酸溶解样品相比较,哪种更好? _________为什么?_______________ _______。
②将0.500 g某铜合金样品溶解后,加热煮沸至无气体产生为止,冷却至室温,加入足量的已经酸化的KI溶液,发生如下反应:2Cu2++4I-===2CuI+I2。完全反应后,设法除去CuI,再用0.120
mol·L-1的Na2S2O3溶液滴定(I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]() ),消耗了35.5 mL Na2S2O3溶液。则这种铜合金中Cu的质量分数是(实验时采取了适当措施使合金中的其他金属对测定无影响)___________________________
______。
),消耗了35.5 mL Na2S2O3溶液。则这种铜合金中Cu的质量分数是(实验时采取了适当措施使合金中的其他金属对测定无影响)___________________________
______。
(2)在室温下,向100
mL饱和Cu(IO3)2溶液中加入足量的已经酸化的KI溶液,发生如下反应:5I-+IO3+6H+===3I2+3H2O,2Cu2++4I-===2CuI+I2,完全反应后,设法除去CuI后再用a mol·L-1的Na2S2O3溶液滴定(I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]() ),消耗了V mL Na2S2O3溶液。则饱和Cu(IO3)2溶液的物质的量浓度是____________________________。
),消耗了V mL Na2S2O3溶液。则饱和Cu(IO3)2溶液的物质的量浓度是____________________________。
高考化学模拟试题答案
一、二选择题(每小题4分,共64分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| A | C | B | B | D | A | B | A | A | AC | D | BD | C | D | BC | AC |
三、(本题包括2小题,共22分)
17.(12分)(1)CuO+2H+→Cu2++H2O(2分) (2)烧杯、量筒(2分,各1分)
(3)SO2(2分) (4)bc(2分)(5)铜粉的质量(1分) 最终所得CuO的质量(3分)。
18.(10分)(1)Cu + 4H+ + 2NO3- = Cu2+ + 2 NO2↑+ 2H2O。
(2)①可以控制反应。②吸收NO2气体,防止污染环境。 (3)关闭c;打开a、b。
(4)先关闭b,再关闭a,然后打开c,用手捂住(热水、热毛巾、加热)②试管。(合理答案均给分) (5)1/Vm mol·L-1
四、(本题包括2小题,共18分)
19.(8分)(1)O2- O3 O2 (2) Ag+、Ag(NH3)2+、SiO32-、AlO2- 、C6H5O-、S2O32- (3) 增大、增大、0.108g、0.108g、pH=2 。
20.(10分)(1) 略; Mg(OH)2 (2)4Fe(OH)2+O2+2H2O=4Fe(OH)3
(3)Ag(NH3)2++2H++Cl-=2NH4++AgCl↓ (4)C为固体,X为浓溶液 无氧
五、(本题包括1小题,共10分)
21.(10分)HCO3-+H2O![]() H2CO3+OH-(2分);大于(1分);⑴乙(1分);B(2分);⑵等于(1分);甲(1分);⑶乙(1分);常压下加热NaHCO3的水溶液,溶液的温度达不到150℃(3分)
H2CO3+OH-(2分);大于(1分);⑴乙(1分);B(2分);⑵等于(1分);甲(1分);⑶乙(1分);常压下加热NaHCO3的水溶液,溶液的温度达不到150℃(3分)
六、(本题包括2小题,共18分)
22.(8分)答案:(1)AD (2)BrCH2CH2Br 2 (3)若图谱中给出了3个吸收峰(信号),则说明C2H6O的结构是CH3CH2OH;若图谱中给出了1个吸收峰(信号),则说明C2H6O的结构是CH3OCH3
23.(10分)⑴加成反应 取代反应(各1分,共2分)
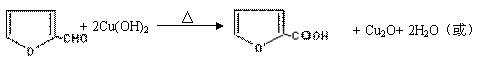 ⑵
⑵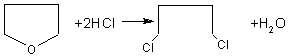 (2分)
(2分)

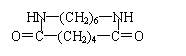
![]()
![]()
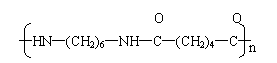 ⑶
(2分)
⑶
(2分)
⑷ (2分)
七、(本题包括2小题,共18分)
24.(8分)(1)80
(2)不能 20℃时80 g水中只能溶解![]() =5.6 g琥珀酸,将会析出8 g-5.6 g=2.4 g琥珀酸。
=5.6 g琥珀酸,将会析出8 g-5.6 g=2.4 g琥珀酸。
(3)30 58
25.(10分)(1)①Cu+H2O2+2HCl===CuCl2+2H2O 用双氧水比硝酸更好,因为铜与硝酸反应会放出NO或NO2,这些气体有毒,容易污染空气 ②54.5%
![]() (2) mol·L-1
(2) mol·L-1